ЭКСПРЕССИВНОСТЬ — это… Что такое ЭКСПРЕССИВНОСТЬ?
- ЭКСПРЕССИВНОСТЬ
- ЭКСПРЕССИВНОСТЬ
(от лат. expressio — выражение), степень фенотипич. проявления одного и того же аллеля определённого гена у разных особей. Термин «Э.» введён Н. В. Тимофеевым-Ресовским в 1927. При отсутствии изменчивости признака, контролируемого данным аллелем, говорят о постоянной Э., в противном случае — об изменчивой (вариабельной) Э. Аллели разл. генов могут характеризоваться разл. степенью Э., напр. аллели системы групп крови АВО у человека практически имеют постоянную Э., а аллели, определяющие окраску глаз,— изменчивую Э. Классич. пример изменчивой Э.— проявление рецессивной мутации, уменьшающей число фасеток глаза у дрозофилы (у разных гомозиготных по этой мутации мух наблюдают разл. число фасеток вплоть до полного их отсутствия). В основе явления изменчивой Э. лежат разл. причины: влияние условий внеш.

.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
.
- ЭКОТИП
- ЭКСТЕРОЦЕПТОРЫ
Смотреть что такое «ЭКСПРЕССИВНОСТЬ» в других словарях:
экспрессивность — см.
 выразительность Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011. экспрессивность сущ., кол во синонимов: 13 … Словарь синонимов
выразительность Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011. экспрессивность сущ., кол во синонимов: 13 … Словарь синонимовЭКСПРЕССИВНОСТЬ — (в генетике) степень выраженности признака, определяемого данным геном. Может меняться в зависимости от генотипа, в который входит данный ген, и от условий внешней среды … Большой Энциклопедический словарь
ЭКСПРЕССИВНОСТЬ — [рэ], экспрессивности, мн. нет, жен. (книжн.). отвлеч. сущ. к экспрессивный. Экспресивность речи. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
экспрессивность — ЭКСПРЕССИВНЫЙ, ая, ое; вен, вна (книжн.). Содержащий экспрессию, выразительный. Экспрессивные средства речи. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЭКСПРЕССИВНОСТЬ — (от лат. expressio выразительность) гена, степень фенотипического проявления гена.

ЭКСПРЕССИВНОСТЬ — (от лат. expresse выразительно, ясно) в лингвистике характеристика языковых единиц и речевых актов, как средств выражения субъективного (личного) оценочного отношения говорящего к содержанию или адресату речи; Э. усиливается паралингвистическими… … Большая психологическая энциклопедия
экспрессивность — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN expressivity … Справочник технического переводчика
Экспрессивность — * экспрэсіўнасць * expressivity степень фенотипического проявления конкретного гена (аллеля) как мера силы его действия, определяемая статистически по степени развития признака (см.). Э. гена у обоих полов может быть одинаковой или различной,… … Генетика. Энциклопедический словарь
Экспрессивность — (от лат.
 expressio выражение) совокупность семантико стилистических признаков единицы языка, которые обеспечивают её способность выступать в коммуникативном акте как средство субъективного выражения отношения говорящего к содержанию или… … Лингвистический энциклопедический словарь
expressio выражение) совокупность семантико стилистических признаков единицы языка, которые обеспечивают её способность выступать в коммуникативном акте как средство субъективного выражения отношения говорящего к содержанию или… … Лингвистический энциклопедический словарьЭКСПРЕССИВНОСТЬ — Степень стенотипического проявления гена как мера силы его действия, определяемая по уровню развития признака. Экспрессивность гена у разных особей может быть одинаковой или различной, постоянной или изменяющейся. На экспрессивность влияют гены… … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
Экспрессия в биологии это: What is Gene Expression?
What is Gene Expression? | Protocol (Translated to Russian)
14.1: Что такое экспрессия гена?
Обзор
Экспрессия генов – это процесс, в котором ДНК направляет синтез функциональных продуктов, таких как белки.
Генетическая информация переходит от ДНК к РНК к белку
Ген является участком ДНК, который служит в качестве плана для функциональных РНК и белков. Поскольку ДНК состоит из нуклеотидов, а белки состоят из аминокислот, необходим посредник для преобразования информации, кодируемой в ДНК, в белки. Этот посредник является мессенджером РНК (мРНК). мРНК копирует план из ДНК процессом, называемым транскрипцией. В эукариотах транскрипция происходит в ядре путем дополнительного базового сопряжения с шаблоном ДНК. Затем мРНК обрабатывается и транспортируется в цитоплазму, где она служит шаблоном для синтеза белка во время трансляции. У прокариот, в которых нет ядра, процессы транскрипции и трансляции происходят в одном и том же месте и почти одновременно, так как новообразованная мРНК подвержена быстрой деградации.
Экспрессия генов может регулироваться на любом этапе во время транскрипции
Каждая клетка организма содержит одинаковую ДНК, и, следовательно, один и тот же набор генов. Тем не менее, не все гены в клетке «включены» или используются для синтеза белков. Ген, как говорят, «выражается», когда белок, который он кодирует, вырабатывается клеткой. Экспрессия генов регулируется для обеспечения правильного генерации белков в определенных клетках в определенное время. Различные внутренние и внешние механизмы регулируют экспрессию генов до и во время транскрипции.
Структура хроматина- уплотненной ДНК и связанных с ней белков гистона — может быть химически изменена, чтобы быть открытой или закрытой.
Такие изменения позволяют или ограничивают доступ транскрипционной машины к ДНК. Модификация хроматина является внутренним механизмом, используемым во время разработки для формирования различных типов клеток (например, нейрона против мышечной клетки) из одного и того же генома.
ДНК-связывающие белки, называемые транскрипционными факторами, регулируют транскрипцию, связываясь с определенными последовательностями ДНК вблизи или внутри кодирующих областей генов. Транскрипционные факторы, способствующие инициированию транскрипции, называются активаторами. Белки, которые предотвращают связывание механизма транскрипции с местом инициации транскрипции, называются репрессорами. Транскрипционные активаторы или репрессоры реагируют на внешние раздражители, такие как сигнальные молекулы, дефицит питательных средств, температура и кислород.
Экспрессия генов может пост-транскрипционно и пост-трансляционно регулироваться
Экспрессия генов может регулироваться посттранскрипционной обработкой мРНК.
В эукариотах транскрибированная мРНК подвергается сплайсированию и другим модификациям, которые защищают концы нити РНК от деградации. Сплайсирование удаляет интроны–сегменты, которые не кодируют белки, и соединяет регионы, кодирующие белок, называемые экзонами.
Экспрессия генов также может быть изменена путем регулирования трансляции мРНК в белки. Трансляция может регулироваться микроРНК- малыми, некодирующих РНК, которые связываются с определенной последовательностью мРНК и блокируют инициирование трансляции или ухудшают транскрибированную мРНК. Кроме того, белки, называемые трансляционными репрессорами, могут связываться с РНК и мешать инициированию трансляции.
Переведенные полипептиды проходят обработку для формирования функциональных белков. Добавление или удаление химических групп может изменить активность, стабильность и локализацию белков в клетке. Например, добавление или удаление фосфориловых групп (-PO32)может активировать или инактивировать белки. Аналогичным образом, добавление убиквитиных групп вызывает деградацию белка. Таким образом, пост-трансляционные модификации белка являются заключительной стадией регуляции генов.
Аналогичным образом, добавление убиквитиных групп вызывает деградацию белка. Таким образом, пост-трансляционные модификации белка являются заключительной стадией регуляции генов.
Литература для дополнительного чтения
Phillips, Theresa. “Regulation of transcription and gene expression in eukaryotes.” Nature Education 1 no. 1 (2008): 199 [Source]
Ralston, Amy. “Examining histone modifications with chromatin immunoprecipitation and quantitative PCR.” Nature Education 1 no. 1 (2008): 118 [Source]
Регуляция экспрессии генов
☰
Экспрессия генов — это реализация заложенной в них информации, то есть синтез РНК и белков. Другими словами, под экспрессией генов понимают их активность.
В клетках живых организмов экспрессия генов регулируется: одни гены могут быть реализованы, другие — нет. Причем регуляция может осуществляться на разных этапах: может выполняться или нет транскрипция, из пре-мРНК в результате альтернативного сплайсинга могут образовываться разные мРНК, может блокироваться трансляция и др.
У эукариот, обладающих отграниченным от цитоплазмы ядерным содержимым и более сложным геномом, регуляция экспрессии генов намного разнообразнее и сложнее, чем у прокариот.
Регуляция экспрессии генов у прокариот
У прокариот пока молекула РНК синтезируется на участке ДНК, она тут же может транслироваться (начиная с уже синтезированного конца). Поэтому у них регуляция экспрессии (активности) генов осуществляется почти исключительно на уровне ДНК, так как в РНК часто невозможно внести какие-нибудь изменения до ее трансляции.
В 1961 г. Жакобом и Моно была предложена модель оперона как системы регуляции генов у бактерий. Оперон состоит из промотора, оператора, структурных генов оперона (их может быть разное количество) и терминатора. В области промотора прикрепляется фермент РНК-полимераза. В области оператора присоединяется белок-репрессор, который кодируется отдельно отстоящим от оперона геном-регулятором (может быть сцеплен со своим опероном, а может находиться на расстоянии).
Если белок-репрессор соединяется с оператором, то транскрипция всех структурных генов оперона становится невозможной, так как РНК-полимераза не может перемещаться по цепи ДНК.
В свою очередь активность белка-репрессора может блокироваться определенным для него низкомолекулярным соединением — индуктором (тем или иным питательным веществом бактерий). В результате взаимодействия с индуктором белок-репрессор видоизменяется и уже не может присоединиться к оператору своего оперона. В этом случае гены оперона экспрессируются (т. е. на них идет синтез).
Бывает обратная ситуация, когда индуктор активирует белок-репрессор.
Таким образом, в зависимости от того, какие индукторы находятся в цитоплазме, у прокариот экспрессируются те или иные генные группы.
Вышеописанный механизм экспрессии генов относится к негативной регуляции, так как гены транскрибируются, если они не выключены репрессором. И наоборот: не транскрибируются, если выключены.
Кроме негативной регуляции у бактерий существует также позитивная. В этом случае вместо белка-репрессора действие оказывает белок-активатор. На эти белки также действуют индукторы, активируя или инактивируя их.
В этом случае вместо белка-репрессора действие оказывает белок-активатор. На эти белки также действуют индукторы, активируя или инактивируя их.
Также у прокариот были выявлены опероны, которые актируются двумя регуляторными белками, соединенными друг с другом.
Регуляция экспрессии генов у эукариот
У многоклеточных организмов в клетках разных тканей экспрессируются разные гены, т. е. для эукариот характерна дифференциальная экспрессия.
У эукариот, также как и у прокариот, существуют регуляторные белки с похожим механизмом действия. При этом для эукариот не характерна регуляция по типу оперона. Цистроны (транскрибируемые участки) эукариот обычно содержат по одному гену. (Это не касается геномов хлоропластов и митохондрий.)
Кроме регуляторных белков, взаимодействующих с ДНК, у эукариот существуют и другие способы регуляции экспрессии генов.Конденсация и деконденсация хроматина. Это наиболее универсальный метод регуляции транскрипции. Когда нужно экспрессировать определенные гены, хроматин в этом месте деконденсируется.
Альтернативные промоторы. У гена может быть несколько промоторов, каждый из которых начинает транскрипцию с разных его экзонов в зависимости от типа клетки. В конечном итоге будут синтезированы разные белки.
Метилирование и деметилирование ДНК. Метилирование ДНК происходит в регуляторных областях гена. Метилируется цитозин в последовательности ЦГ, после чего ген инактивируется. При деметилировании активность гена восстанавливается. Процесс регулируется ферментом метилтрансферазой.
Гормональная регуляция. При гормональной регуляции гены активируются в ответ на внешний химический сигнал (поступление в клетку определенного гормона). Этот гормон запускает те гены, которые имеют специфические последовательности нуклеотидов в регуляторных областях.
Геномный импринтинг. Это малоизученный способ регуляции экспрессии генов у эукариот. Он возможен только у диплоидных организмов и выражается в том, что активность генов зависит, от какого из родителей они были получены. Выключение генов осуществляется путем метилирования ДНК.
Выключение генов осуществляется путем метилирования ДНК.
Альтернативный сплайсинг. Это регуляция на уровне процессинга. При альтернативном сплайсинге порядок сшивки экзонов может быть различным. Отсюда следует, что на основе одной и той же нуклеотидной последовательности ДНК могут быть синтезированы разные белки. Хотя их отличие друг от друга будет в основном заключаться лишь в разных сочетаниях одних и тех же аминокислот.
Тканеспецифическое редактирование РНК также протекает на уровне процессинга. Выражается в замене отдельных нуклеотидов в РНК в определенных тканях организма.
Кроме того, у эукариот иРНК часто не подвергается процессингу вообще (а распадается) или подвергается с задержкой. Это токже можно рассматривать как способ регуляции экспрессии генов.
Регуляция стабильности иРНК. У эукариот существует регуляция и на уровне трансляции, когда готовые иРНК не «допускаются» к рибосомам или разрушаются. Другие же иРНК могут дополнительно стабилизироваться для многократного использования.
Посттрансляционная модификация белка. Чтобы молекула полипептида превратилась в активную молекулу белка, в ней должны произойти различные модификации определенных аминокислот, должны быть сформированы вторичная, третичная и возможно четверичная структуры. На этом этапе также можно повлиять на реализацию генетической информации, например, не дав молекуле сформироваться.
Риборегуляторы. Были обнаружены РНК, выполняющие регуляторные функции путем ослабления работы отдельных генов.
Для высокоорганизованных животных отмечается существование надклеточного уровня регуляции экспрессии генов.
Составлена самая подробная карта экспрессии генов в эмбрионе дрозофилы
Секвенирование РНК из тысяч индивидуальных клеток позволило германским биологам составить самую детальную на сегодняшний день карту экспрессии генов в эмбрионе дрозофилы на стадии начала гаструляции. Карта довольно точно отражает экспрессию 6–8 тысяч генов в каждой клетке эмбриона.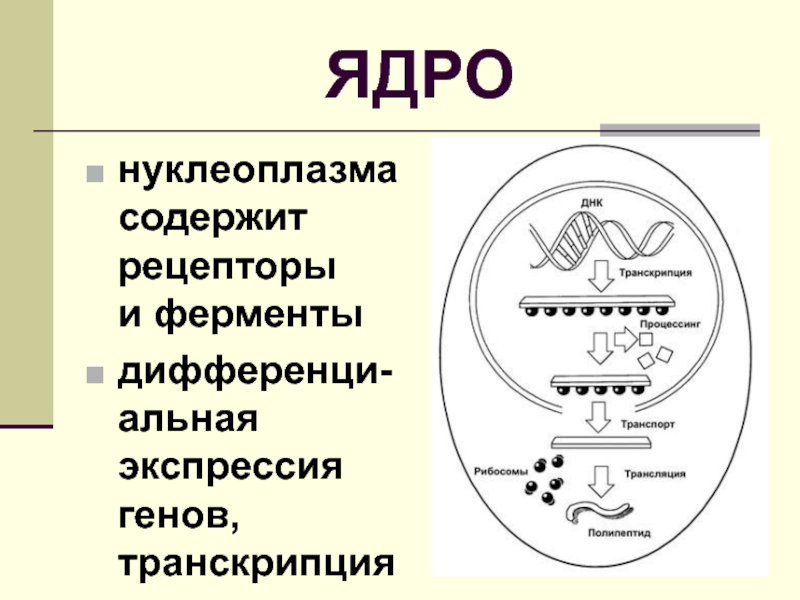 Она позволяет решать разнообразные исследовательские задачи: обнаруживать неизвестные ранее регуляторы развития, анализировать общие закономерности трехмерной организации эмбриона и эволюции онтогенеза. Работа представляет собой важный шаг на пути к решению главной задачи биологии развития — полному и исчерпывающему пониманию того, как генотип воплощается в фенотипе.
Она позволяет решать разнообразные исследовательские задачи: обнаруживать неизвестные ранее регуляторы развития, анализировать общие закономерности трехмерной организации эмбриона и эволюции онтогенеза. Работа представляет собой важный шаг на пути к решению главной задачи биологии развития — полному и исчерпывающему пониманию того, как генотип воплощается в фенотипе.
Ключевую роль в эмбриональном развитии играет дифференцировка клеток, в основе которой лежит включение разных наборов генов в разных клетках в ответ на определенные сигналы (см. Как клетки понимают, что одни должны стать волосами, другие костями, третьи мозгами и т. п.?). Паттерны экспрессии генов — регуляторов развития создают пространственную разметку эмбриона, поэтапно рисуя на нем нечто вроде чертежа будущего организма (рис. 1).
Для дрозофилы Drosophila melanogaster, одного из самых изученных животных, уже известны пространственно-временные паттерны экспрессии десятков регуляторных генов. Это позволило в общих чертах разобраться в том, как формируются передний и задний концы тела, спинная и брюшная стороны, сегменты и органы (см. Михаил Никитин. Генные сети, управляющие строением тела животных). Но всё же картина остается неполной: изучены далеко не все гены, влияющие на развитие, а области их экспрессии картированы зачастую лишь приблизительно.
Михаил Никитин. Генные сети, управляющие строением тела животных). Но всё же картина остается неполной: изучены далеко не все гены, влияющие на развитие, а области их экспрессии картированы зачастую лишь приблизительно.
В идеале хотелось бы иметь точную информацию по экспрессии каждого гена в каждой клетке эмбриона на каждом этапе развития. Но возможно ли это? До сих пор такой уровень детализации был недостижим. Но наука не стоит на месте, и то, что казалось еще недавно недостижимой мечтой, вдруг становится реальностью.
В статье, опубликованной в журнале Science 13 октября, ученые из Центра Молекулярной Медицины Макса Дельбрюка (Max Delbrück Center for Molecular Medicine) в Берлине сообщили о создании самой детальной на сегодняшний день карты генной экспрессии эмбриона дрозофилы на этапе развития, предшествующем началу морфогенеза. В это время (так называемая стадия 6, см. Stage 6) эмбрион состоит примерно из 6000 клеток, еще не имеет видимых морфологических структур и только приступает к гаструляции.
Авторы сделали всё возможное, чтобы включить в анализ максимальное число генов (причем не только белок-кодирующих, но и генов регуляторных РНК), и чтобы добиться максимального пространственного разрешения, картировав экспрессию в каждой клетке эмбриона по отдельности. Для этого они воспользовались недавно изобретенной технологией Drop-Seq, основанной на помещении клеток в крошечные капельки воды, мечении РНК в каждой капле особой меткой и последующем тотальном секвенировании РНК (см. E. Z. Macosko et al., 2015. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets). Метод Drop-Seq позволяет одновременно измерить в каждой клетке экспрессию нескольких тысяч генов. Индивидуальные метки дают возможность понять, какие из отсеквенированных молекул РНК происходят из одной и той же, а какие — из разных клеток.
Авторам удалось с высокой точностью измерить экспрессию генов примерно в 1300 клетках эмбрионов дрозофилы на стадии 6. Для каждой клетки уровень экспрессии был надежно определен в среднем для 3100 генов.
Предварительный анализ полученных данных показал, что профили экспрессии в разных клетках эмбриона различаются очень сильно: свой уникальный профиль имеет чуть ли не каждая клетка. Это значит, что составление карты экспрессии с максимальным, то есть клеточным уровнем разрешения — не блажь, а правильный и необходимый шаг на пути к пониманию механизмов развития.
К сожалению, метод Drop-Seq требует предварительного разделения эмбриона на отдельные клетки. При этом информация о том, из какой части эмбриона происходит та или иная клетка, теряется, и ее нужно потом как-то восстановить. В этом и состояла главная методологическая трудность, которую авторы должны были преодолеть. Для этого они использовали ту информацию по паттернам экспрессии отдельных генов, которая была получена ранее. В частности, в рамках проекта Berkeley Drosophila Transcription Network Project (BDTNP) была с большой точностью картирована экспрессия 84 генов — регуляторов развития (C. C. Fowlkes et al., 2008. A Quantitative Spatiotemporal Atlas of Gene Expression in the Drosophila Blastoderm). Проанализировав эти данные и сопоставив их с результатами Drop-Seq, авторы пришли к выводу, что, зная уровень экспрессии каждого из 84 генов в анализируемой клетке, можно довольно точно (с точностью до нескольких клеточных диаметров) определить, из какого места эмбриона происходит клетка.
A Quantitative Spatiotemporal Atlas of Gene Expression in the Drosophila Blastoderm). Проанализировав эти данные и сопоставив их с результатами Drop-Seq, авторы пришли к выводу, что, зная уровень экспрессии каждого из 84 генов в анализируемой клетке, можно довольно точно (с точностью до нескольких клеточных диаметров) определить, из какого места эмбриона происходит клетка.
Таким образом, каждая клетка была надежно «привязана» к определенному, очень небольшому участку эмбриона. Поскольку к каждому такому участку была привязана не одна, а несколько клеток, в каждой из которых был измерен уровень экспрессии в среднем 3100 генов (причем наборы генов с измеренной экспрессией были разными для разных клеток), то для каждого участка удалось в конечном счете оценить экспрессию 6–8 тысяч генов.
В результате получилась самая детальная на сегодняшний день трехмерная карта экспрессии генов в эмбрионе дрозофилы на стадии начала гаструляции. Карта представлена в виде интерактивной системы Drosophila Virtual Expression eXplorer (DVEX), которая для любого выбранного гена может показать паттерн экспрессии.
Авторы сравнивали изображения, нарисованные их программой, с реальными паттернами экспрессии отдельных генов, полученными классическим способом — при помощи гибридизации in situ. Сравнение показало, что карта получилась довольно точная (рис. 2).
Значение этой работы в том, что специалисты по биологии развития получили новый мощный инструмент для решения разнообразных научных задач. В заключительной части статьи авторы показали несколько возможных направлений, где их детище может найти применение.
Например, можно искать общие закономерности в разнообразии рисунков экспрессии различных генов. Это прольет свет на базовые принципы пространственной организации эмбриона. Авторы попытались классифицировать паттерны экспрессии изученных генов, построив для них дендрограмму сходства (рис. 3). Оказалось, что разнообразие рисунков экспрессии распадается на 10 кластеров, для каждого из которых можно составить обобщенный «архетипический» рисунок экспрессии. Подобные сведения важны для расшифровки регуляторных генных сетей: например, логично предположить, что гены, относящиеся к одному кластеру, имеют сходную систему регуляции, то есть похожим образом реагируют на те или иные сигналы.
Кроме того, подробная карта генной экспрессии может быть использована для обнаружения новых регуляторов развития. Один из примеров показан на рис. 2 справа внизу. Длинная некодирующая РНК CR43432, экспрессия которой ранее не картировалась и чья функция неизвестна, экспрессируется, как выяснилось, там и только там, где не экспрессируются важнейшие гены, контролирующие развитие нейроэктодермы, такие как SoxN. Это значит, что CR43432 с большой вероятностью является регулятором эмбрионального развития: возможно, она ограничивает распространение нейроэктодермы или влияет на развитие клеток, избравших не-нейроэктодермальную судьбу.
Имея точную карту экспрессии, можно проследить, в каких участках эмбриона производятся те или иные сигнальные вещества, и догадаться, для каких участков предназначены эти сигналы. Кроме того, карта поможет в изучении эволюции онтогенеза. Авторы проиллюстрировали эту возможность, построив для другого вида дрозофил, D. virilis, менее детальную карту экспрессии генов на той же стадии развития и обнаружив несколько контрастных отличий от D. melanogaster.
melanogaster.
Работа представляет собой важный шаг на пути к решению главной задачи биологии развития, которая состоит в том, чтобы понять, каким образом наследственная информация воплощается в фенотипе. Причем понять не в общих чертах (для дрозофилы это уже, можно сказать, сделано), а во всех подробностях. Обладание полной информацией о том, как регулируется и на что влияет работа каждого гена в ходе онтогенеза, откроет перед человечеством небывалые возможности, вплоть до проектирования искусственных организмов с любыми желаемыми свойствами.
Источник: Nikos Karaiskos, Philipp Wahle, Jonathan Alles, Anastasiya Boltengagen, Salah Ayoub, Claudia Kipar, Christine Kocks, Nikolaus Rajewsky and Robert P. Zinzen. The Drosophila embryo at single-cell transcriptome resolution // Science. 2017. V. 358. P. 194–199. DOI: 10.1126/science.aan3235.
См. также:
1) Михаил Никитин. Генные сети, управляющие строением тела животных.
2) Шон Кэрролл. Бесконечное число самых прекрасных форм.
Бесконечное число самых прекрасных форм.
3) Как клетки понимают, что одни должны стать волосами, другие костями, третьи мозгами и т. п.?
Александр Марков
Медицинская геномика: организация генома, регуляция экспрессии генов, генетическая вариабельность | Титов
1. Титов, Л. П. Вирусы и эукариотические клетки: стадии взаимодействия, стратегия геномов, репродукция и исходы инфекции / Л. П. Титов // Мед. журн. — 2008. — № 1. — С. 10-16.
2. Braga-Neto, U. M. From Genomics to Functional Immunomics: New challenges, Old problems, Big Rewards / U. M. Braga-Neto, E. T. A. Marques // Plos comput. biol. — 2006. — Vol. 2. — Iss. 7. — eB1.P.0651-0662.
3. Microbiome Composition by Pyrosequencing in Mesenteric Lymph Nodes of Rats with CCL4-induced Cirrhosis / S. Cuenca [et al.] // J. Innate Immunol. — 2014. — Vol. 6. — P. 263-271.
4. An Immunomics Approach to Schistosome antigen discovery: antibody signatures of naturally resistant and chronically infected individuals from endemic areas / S. Gaze [et al.] // PLOS Pathogens. — 2014. — Vol. 10. — Iss. 3. — P. 1-16. — E1004033.
Gaze [et al.] // PLOS Pathogens. — 2014. — Vol. 10. — Iss. 3. — P. 1-16. — E1004033.
5. Титов, Л. П. Иммунология: терминологический словарь / Л. П. Титов. — М.: МИА, 2008. — 521 с.
6. Хромов-Борисов, Н. Н. Эволюционная медицинская геномика / Н. Н. Хромов-Борисов, А. В. Рубанович // Молек. медицина. — 2014. — № 2. — С. 13-17.
7. Структурная геномика и медицина / И. Е. Ясный [и др.] // Молек. медицина. — 2009. — № 6. — С. 15-20.
8. Groot, A. S. D. Immunomics discovering new targets for vaccine and therapeutics / A. S. D. Groot // Drug Discov. Today. — 2006. — Vol. 11. — P. 203-209.
9. Miller, M. B. Basic concept of microarrays and potential application in clinical microbiology / M. B. Miller, Y. W. Tang // Clin. Microbiol. Rev. — 2009. — Vol. 22 (4). — P. 611-633.
10. Пинегин, Б. В. Роль клеток иммунной системы и цитокинов в развитии псориаза / Б. В. Пинегин, О. Л. Иванов, В. Б. Пинегин // Иммунология. — 2012. — Т. 33, № 4. — С. 213-219.
11. Титов, Л. П. Противовирусный иммунитет: молекулярно-клеточные механизмы, закономерности развития и иммунопатология / Л. П.Титов, И. А. Карпов // Мед. журн. — 2007. — № 1. — С. 4-14.
Титов, Л. П. Противовирусный иммунитет: молекулярно-клеточные механизмы, закономерности развития и иммунопатология / Л. П.Титов, И. А. Карпов // Мед. журн. — 2007. — № 1. — С. 4-14.
12. Бокуть, С. Б. Молекулярная биология / С. Б. Бокуть, Н. В. Герасимович, А. А. Милютин. — Минск: Вышэйш. школа, 2005. — 463 с.
13. The sequence of human genome / J. C. Venter [et al.] // Science. — 2001. — Vol. 291. — Р. 1304-1309.
14. Read, A. The human Genome: structure and organization / A. Read // Genetics and Medicine / еd. D. Kumar, D. Weatherall. — Oxford press, 2008. — P. 17-29.
15. Antonarakis, S. E. Human Genome Sequence and Variation / S. E. Antonarakis // Vogel and Matulsky’s Human Genetics, Problems and Approaches / eds. M. R. Speicher et al. — 2010. — Berlin; Heidelberg: Springer-Verlag. — Р. 31-53.
16. Global gene expression analysis reveals evidence for decreased lipid biosynthesis and increased innate immunity in uninvolved psoriatic skin / J. E. Gudjonsson [et al. ] // J. Invest. Dermatol. — 2009. — Vol. 129. — Р. 2795-2804.
] // J. Invest. Dermatol. — 2009. — Vol. 129. — Р. 2795-2804.
17. Collaborative association study of genome-wide scan reveals association of psoriasis with IL-23 and NF-kappa B pathways / R. P. Nair [et al.] // Nat. genetics. — 2009. — Vol. 41. — Р. 199-204.
18. Garaev, P. P. Another Understanding of the Model of Genetic Code Theoretical Analysis / P. P. Garaev // Open J. of Genetics. — 2015. — Vol. 5, N 1. — Р. 92-109.
19. Mardis, E. R. Cancer genome sequencing / E. R. Mardis, R. K. Wilson // Human mol. genetics. — 2009. — Vol. 18. -Iss. 2. — Doi:10109/ddp396.
20. Consortium biology in immunology: the perspective from the Immunological Genome Project / С. Benoist [et al.] // Nature Rev. Immunol. — 2012. — P. 1-6.
21. Heng, T. S. P. The immunological Genome Project: network of gene expression in immune cells / T. S. P. Heng, M. W. Painter // Immunology. — 2008. — Vol. 4, N 10. — Р. 1091-1094.
22. Grander, D. I. Immunomics: principles and practis / D. I. Grander // IRTI. — 2004. — Vol. 2.- Р. 1-6.
I. Grander // IRTI. — 2004. — Vol. 2.- Р. 1-6.
23. Титов, Л. П. Геномико-протеомические основы эволюции и молекулярной эпидемиологии вирусов / Л. П. Титов, В. И. Вотяков // Вес. НАН Беларусi Сер. мед. навук. — 2011. — № 1. — С. 109-124.
24. Epigenetic regulation of inducible gene expression in the immune system / P. S. Lim [et al.] // Immunology. — 2013. -Vol. 139. — Iss. 3. — Р. 285-293.
25. Josefowicz, S. Z. Regulatory of chromatin state and transcription in CD4 T-cells polarization / S. Z. Josefowicz // Immunology. — 2013. — Vol. 139. — Iss. 1. — Р. 299-308.
26. Титов, Л. П. Особенности строения, развития и функционирования иммунной системы детского организма / Л. П. Титов, Е. Ю. Кирильчик, Т. А. Канашкова // Мед. новости. — 2009. — № 5. — С. 7-16.
27. Transcription factors and CD4 T-cell seeking identity: masters, minions, setters and spikers / G. Vahedi [et al.] // Immunology. — 2013. — Vol. 139. — Iss. 3. — P. 294-298.
28. Chen, W. Development of thymic Foxp3 regulatory T-cells: TGF-b matters / W. Chen, J. E. Konkel // Eur. J. of Immunol. — 2015. — Vol. 45. — P. 958-965.
Chen, J. E. Konkel // Eur. J. of Immunol. — 2015. — Vol. 45. — P. 958-965.
29. Lee, G. R. Transcriptional regulation T-helper type 2 / G. R. Lee // Immunology. — 2014. — Vol. 141. — Iss. 4. — P. 498-505.
30. Wang, Y. An essential role of the transcriptional factor GATA-3 for the function of regulatory Т-cells / Y. Wang, M. A. Su, Y. Y. Wan // Immunity. — 2011. — Vol. 35. — P. 337-348.
31. Wen, A. Y. The role of the transcriptional factor CREB in immune function / A. Y. Wen, K. M. Sakamoto, L. S. Miller // J. Immunol. — 2010. — Vol. 185. — P. 6413-6419.
32. Rico-Rosillo, G. The involvement of NF-kB transcription factor in asthma / G. Rico-Rosillo, G. B. Vega-Robledo // Rev. Alergia Mex. — 2011. — Vol. 58, N 2. — P. 107-111.
33. Титов, Л. П. Молекулярные механизмы активации Т- и В-лимфоцитов / Л. П. Титов // Современные проблемы инфекционной патологии человека: материалы 2-й науч.-практ. конф. — Минск, 2001. — С. 287-317.
34. From single-cell to cell pool transcriptomes: stochasticity in gene expression and RNA splicing / G. K. Maurinov [et al.] // Genome Res. — 2011. — Vol. 24. — P. 496-510.
K. Maurinov [et al.] // Genome Res. — 2011. — Vol. 24. — P. 496-510.
35. Youngblood, B. T-cell memory differentiational signatures and epigenetics / B. Youngblood, J. S. Hall, R. Ahmed // Immunology. — 2013. — Vol. 139. — Iss. 3. — P. 325-335.
36. Banerji, J. Expression of a beta-globin gene is enchanced by remоte SV40 DNA sequences / J. Banerji, R. Sandro, M. Schaffner // Cell. — 1981. — Vol. 27. — P. 299-308.
37. Ogbourne, S. Transcriptional control and the role of silencers in transcriptional regulation in eukaryotes / S. Ogbourne, T. M. Antalis // Biochemistry. — 1998. — Vol. 231. — P. 1-14.
38. Enchancers and silencers: an integrated and simple model for their function / P. Kolovos [et al.] // Epigenetics & Chromatin. — 2012. — Vol. 5, N 1. — P. 2-8.
39. Разин, С. В. Регуляторные элементы эукариотического генома, контролирующие транскрипцию / С. В. Разин, А. А. Говрилов, С. В. Ульянов // Молек. биология. — 2015. — Т. 49, № 2. — С. 212-223.
40. Гонзвгло, М. МикроРНК как биомаркер для диагностики рака мочевого пузыря / М. Гонзвгло, Г. Ишханова // Молек. медицина. — 2014. — № 2. — С. 18-24.
Гонзвгло, М. МикроРНК как биомаркер для диагностики рака мочевого пузыря / М. Гонзвгло, Г. Ишханова // Молек. медицина. — 2014. — № 2. — С. 18-24.
41. Титов, Л. П. Микро-РНК: новый класс регуляторных молекул иммунного ответа и инфекционного процесса / Л. П. Титов // Современные проблемы инфекционной патологии человека: сб. науч. тр. — 2012. — В. 5. — С. 256-261.
42. Perez-Ortin, J. E. Genomics of mRNA turnover / J. E. Perez-Ortin // Briefing in functional genomics and proteomics. — 2007. — Vol. 6, N 4. — P. 282-291.
43. Cross-regulation between cytokine and microRNA pathways in T-cells / T. Amado [et al.] // Eur. J. of Immunol. -2015. — Vol. 45. — Iss. 6. — P. 1584-1595.
44. Phisiological and pathological roles for microRNAs in the immune system / R. M. O’Connel [et al.] // Nat. Rev. Immunol. — 2010. — P. 11-122.
45. A role for Dicer in immune regulation / B. S. Cobb [et al.] // J. Exp. Med. — 2006. — Vol. 203. — P. 2519-2527.
46. The RNAseIII enzyme Drosha is critical in T cells for preventing lethal in inflammatory disease / M. M. Chang [et al.] // J. Exp. Med. — 2008. — Vol. 205. — P. 2005-2017.
M. Chang [et al.] // J. Exp. Med. — 2008. — Vol. 205. — P. 2005-2017.
47. Role of mir-155 in the regulatory of lymphocytes immune function and disease / N. Seddiki [et al.] // Immunology. — 2014. — Vol. 142. — Iss. 1. — P. 32-38.
48. Ortutay, C. Immonomic Knowledge base (IKB): an integrated service for immune research / C. Ortutay, M. Vikinen // BMC Immunol. — 2009. — Vol. 10. — doi: 101186/1471-2172-10-3.
49. Kan, Y. W. Polymorphism of DNA sequence adjacent to human beta-globin structural gene: relationship to sickle mutation / Y. W. Kan // Proc. Natl. Sci. — 1878.- Vol. 75, N 11. — P. 5631-5635.
50. Increased expression of Wnt5a in psoriatic plaques / J. Reischl [et al.] // J. Invest. Dermatol. — 2007. — Vol. 127. -P. 163-169.
51. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infection disease / C. Skevaki [et al.] // Clin. аМ Exp. Immunol. — 2015. — Vol. 180. — P. 165-177.
52. Marietta, E. Immunogenetic control of the intestinal microbiota / E.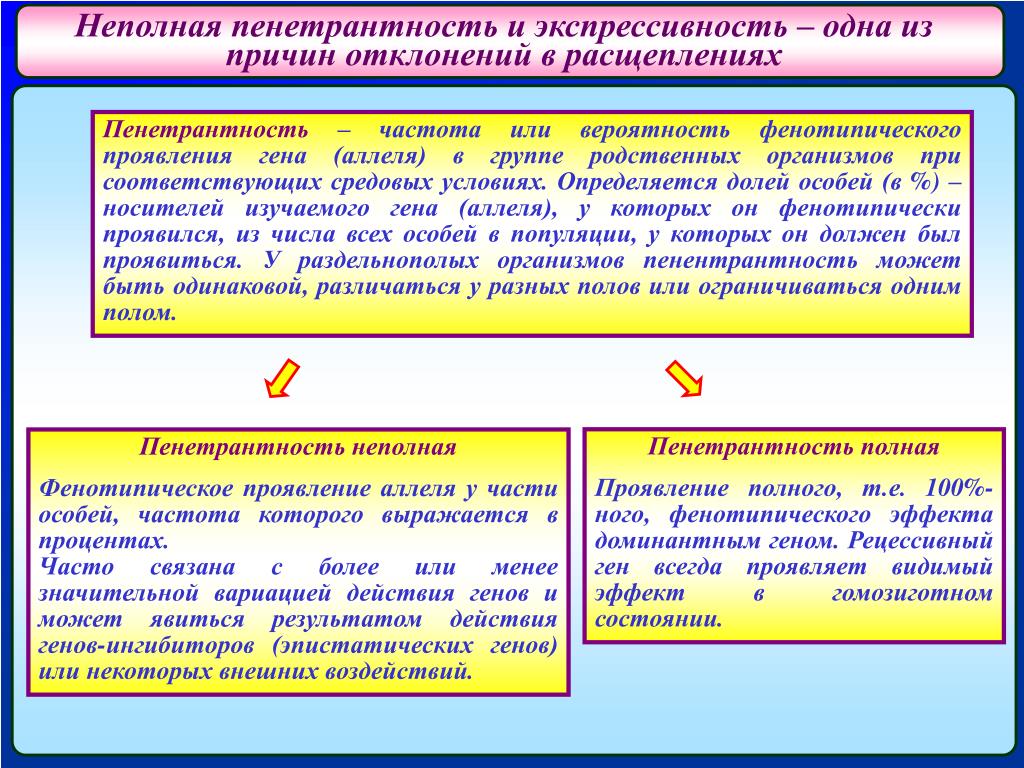 Marietta, A. Rishi, V. Taneja // Immunology. — 2015. — Vol. 145. — P. 313-322.
Marietta, A. Rishi, V. Taneja // Immunology. — 2015. — Vol. 145. — P. 313-322.
53. Severe combined immunodeficiency. A national surveillance study / A. Yee [et al.] // Pediatric Allergy and Immunol. — 2008. — Vol. 19 (4). — P. 298-302.
54. Quantitative monitoring of gene expression patterns with a complementary DNA microarray / M. Schena [et al.] // Science. — 1995. — Vol. 270. — P. 467-470.
55. Clinical interpretation and implications of whole genome sequencing / F. E. Dewey [et al.] // JAMA. — 2014. — Vol. 31, N 10. — P. 1035-1041.
56. Cordero, P. Whole genome sequencing in personalized therapeutics / P. Cordero, E. A. Ashely // Clin. Pharmacol. and Ther. — 2012. — Vol. 91, N 6. — P. 1001-1009.
57. Use of whole genome sequencing for diagnosis and discovery in the cancer genetics clinic / S. B. Foley [et al.] // Ebiomedicine. — 2015. — Vol. 2. — P. 74-81.
58. Whole genome sequencing in health care / C. G. van El [et al.] // Eur. J. of Human Genetics. — 2013. — Vol. 21. — P. 580-584.
— 2013. — Vol. 21. — P. 580-584.
59. Swanson, C. I. Rapid еvolutionary of a structurally constrained еye enchancer / C. I. Swanson, D. B. Schwimmer, S. Barolo // Curr. Biol. — 2011. — Vol. 21, N 14. — P. 1186-1196.
60. Preparing the next generation of genomicists: a laboratory-style course in medical genomics / M. D. Lindemann [et al.] // BMC med. genomics. — 2015. — Vol. 8, N 47. — P. 1-3.
61. Ngo, D. A. Genomic approaches to identifying targets for treating beta-hemoglobulinopathies / D. A. Ngo, M. H. Steinberg // BMC med. genomics. — 2015. — Vol. 8, N 44. — P. 1-13.
62. Karki, R. Defining «mutation» and «polymorphism» in the era of personal genomics / R. Karki, D. Pandya, R. C. Elston // BMC med. genomics. — 2015. — Vol. 8, N 37. — P. 1-8.
63. Alyass, A. From big data analysis to personalized medicine for all: challenges and apportunities / A. Alyass, M. Turlotbe, D. Meyre // BMC med. genomics. — 2015. — Vol. 8, N 33. — P. 1-12.
64. Титов, Л. П. Компьютерная иммунология: сравнительный анализ нуклеотидных замен в CDR и FR фрагментах генов иммуноглобулинов при гепатите С, криоглобулинемии и лейкозах / Л. П. Титов, Т. А. Столярова, Е. А. Столярова // Вес. НАН Беларусi Сер. мед. навук. — 2010. — № 3. — С. 10-18.
П. Компьютерная иммунология: сравнительный анализ нуклеотидных замен в CDR и FR фрагментах генов иммуноглобулинов при гепатите С, криоглобулинемии и лейкозах / Л. П. Титов, Т. А. Столярова, Е. А. Столярова // Вес. НАН Беларусi Сер. мед. навук. — 2010. — № 3. — С. 10-18.
65. Medical genomics: The intricate path from genetic variant identification to clinical interpretation / B. Quintas [et al.] // Appl. & Transl. Genomics. — 2014. — Vol. 3. — Iss. 3. — P. 60-67.
Влияние метилирования ДНК на экспрессию гена тиреоглобулина при тиреоидной патологии | Туракулов
Аннотация
Влияние метилирования разных областей ДНК на экспрессию гена может проявляться на всех регуляторных уровнях, связанных с этим процессом: на уровне транскрипции и посттранскрипционном, на уровне трансляции и посттрансляционном. Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Целью настоящей работы было исследование влияния метилирования ДНК на экспрессию гена ТГ при тиреоидной патологии. Нами была изучена возможность участия метилирования ДНК в регуляции экспрессии гена ТГ. Статус метилирования гена ТГ изучали при узловом эутиреоидном, диффузном токсическом зобах и при раке щитовидной железы. Была проанализирована 5′-фланкирующая область гена, которая содержит последовательности, признаваемые рестрикт азами НраН и MspI. Показано, что при раке щитовидной железы происходит гиперметилирование 5′-фланкирующей области гена ТГ. Эти данные свидетельствуют о том, что между экспрессией гена ТГ и его метилированием существует обратная корреляция.
Изучение закономерностей регуляции активности генов в клетках высших организмов является одной из интенсивно развивающихся областей молекулярной биологии и эндокринологии. В настоящее время накопилось довольно много данных о значении метилирования в регуляции генетической экспрессии. Влияние метилирования разных областей ДНК на экспрессию генов может проявляться на всех регуляторных уровнях, связанных с этим процессом: на уровне транскрипции и посттранскрипционном, на уровне трансляции и посттрансляционном. Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Изучение взаимосвязи метилирования ДНК и экспрессии гена тиреоглобулина (ТГ) при некоторых видах тиреоидной патологии представляет интерес для познания механизмов регуляции генетической информации вообще.
Материалы и методы
Для выделения высокомолекулярной ДНК использовали щитовидные железы людей, удаленные во время операции по поводу зоба в лаборатории тиреоидной патологии Института эндокринологии АН Республики Узбекистан.
Выделение ДНК из клеток щитовидной железы проводили методом фенольной экстракции [2].
Рестрикционный анализ проводили с помощью рестрикционных эндонуклеаз BamHI, Hindlll, НраН, MspI. Фрагменты ДНК (1 мкг на пробу) разделяли методом электрофореза в 0,8% агарозном геле. Перенос ДНК из геля на нейлоновые фильтры «Biodan» осуществляли по методу К. Southern [4] в течение 24 ч.
Введение радиоактивной метки в плазмидную ДНК проводили методом нуклеотидного замещения с помощью ДНК-полимеразы Е. coli. Гибридизацию проводили с меченной 32Р плазмидной ДНК (удельная активность 107—108 имп/мкг) в течение 18 ч при 65°С в смеси, содержащей 4 х ССР, четырехкратный раствор Денхарта, 0,5 мг (У), 0,1% ДСН, 5% раствор декстрансульфата. После гибридизации фильтры тщательно отмывали и подвергали авторадиографии в течение 5—15 дней при —70°С, используя пленку РМ1 и усиливающие экраны.
После гибридизации фильтры тщательно отмывали и подвергали авторадиографии в течение 5—15 дней при —70°С, используя пленку РМ1 и усиливающие экраны.
Результаты и их обсуждение
Ранее при исследовании экспрессии гена ТГ при узловом эутиреоидном, диффузном токсическом и врожденном зобах, а также при раке щитовидной железы было показано снижение количества ТГ мРНК при узловом эутиреоидном и врожденном зобах. При раке щитовидной железы наблюдалось полное отсутствие ТГ мРНК. Выявленное снижение количества ТГ мРНК свидетельствовало о том, что при изученных видах тиреоидной патологии имеет место нарушение синтеза ТГ на уровне транскрипции [1].
Для того чтобы проанализировать, является ли снижение уровня ТГ мРНК результатом блокирования транскрипции гена или изменением стабильности ТГ мРНК, нами были проведены эксперименты по гибридизации ДНК, выделенной из клеток щитовидной железы при узловом эутиреоидном, диффузном токсическом зобах и при раке, с различными зондами.
Блокирование транскрипции гена ТГ при узловом эутиреоидном зобе может быть вызвано значительными перегруппировками в структуре гена ТГ в пределах кодирующей области или в пределах регуляторной фланкирующей 5-области гена.
Высокомолекулярная ДНК, выделенная из клеток щитовидной железы при диффузном токсическом, узловом эутиреоидном зобах и при раке, была обработана рестриктазами BamHI, Hindlll и гибридизована с различными зондами.
Для гибридизации использовали разные кДНК-зонды, которые покрывают 80% кодирующей ТГ области и фрагмент ДНК, близкий к 5 -области гена ТГ.
Мы исследовали возможность перегруппировок в пределах кодирующей области гена ТГ. На рис. 1 показано, что разницы в рестрикционных структурах ДНК из клеток щитовидной железы при узловом эутиреоидном и диффузном токсическом зобах нет. Эти данные ясно показывают, что значительных перегруппировок в ТГ-кодирующей области гена не обнаружено, что можно было бы отнести на счет транскрипционной реактивности этого гена при данной патологии.
Нами была исследована также возможность значительных перегруппировок в 5-фланкирующей области гена ТГ. В качестве зонда использовали фрагмент ДНК, близкий к 5-области гена. На рис. 2 видно, что разницы в рестрикционных структурах ДНК из клеток щитовидной железы при узловом эутиреоидном и диффузном токсическом зобах нет.
Таким образом, полученные данные показывают, что значительных перегруппировок в ТГ-кодирующей области и 5-фланкирующей области гена ТГ не обнаружено.
Мы исследовали возможность участия метилирования в регуляции экспрессии гена ТГ. Статус метилирования изучали в клетках щитовидной железы при раке и диффузном токсическом зобе. Была проанализирована 5-фланкирующая об-
Рис. 1. Авторадиограф образцов ДНК, обработанных рестриктазой BamHI.
Здесь и на рис. 2: / — узловой эутиреоидный зоб; 2 — диффузный токсический зоб.
ласть гена, которая содержит 2 последовательности, признаваемые рестриктазами, чувствительными к метилированию НраН и MspI, которые картируются соответственно на 680 и 1800 п. п. от исходного участка транскрипции [3].
Как показано на рис. 3, при обработке ДНК, выделенной из клеток щитовидной железы при раке, рестриктазой MspI наблюдается гиперметилирование 5-фланкирующей области гена ТГ при полном блокировании синтеза ТГ [1], т. е. между экспрессией гена ТГ и его метилированием существует обратная корреляция.
При изучении взаимосвязи экспрессии гена ТГ и его метилирования показано, что чувствительные к метилированию сайты, расположенные в
Рис. 3. Авторадиограф образцов ДНК, обработанных рестриктазой MspI.
1,4 — диффузный токсический зоб; 2 — рак щитовидной железы; 3 — узловой эутиреоидный зоб.
5-фланкирующей области гена, гиперметилируются при раке щитовидной железы, в то время как при диффузном токсическом зобе наблюдается недометилирование этих сайтов.
Участие метилирования ДНК в регуляции экспрессии гена ТГ подтверждено в работе F. Libert и G. Vassart [3]. Авторы определяли характер метилирования 5-концевой области гена ТГ человека в различных тканях. В щитовидной железе 1 из 4 НраН — MspI-сайтов найден в этой области, 3 сайта были неметилированы, тогда как в печени, слюнных железах и сперме наблюдали метилирование всех 4 сайтов. Следовательно, такое деметилирование коррелирует с экспрессией гена ТГ. Показано, что степень метилирования 5-конца гена ТГ, по-видимому, отражает активность гена во взрослых соматических тканях.
Деметилирование гена является сигналом, детерминирующим возможность его экспрессии. В целом ясно, что это относится главным образом к состоянию 5-области гена. Данные о роли недометилированности остальных частей гена пока отрывочны. Можно допустить, что изменение метилирования 5-области гена ТГ является важным, так как контролирует какие-то факторы транскрипции гена в его активации, являющиеся общими для всех генов.
При изучении взаимосвязи экспрессии гена ТГ и его метилирования показано, что чувствительные к метилированию сайты, расположенные в 5-фланкирующей области гена, гиперметилируются при раке щитовидной железы, в то время как при диффузном токсическом зобе наблюдается недометилирование этих сайтов.
Выводы
- Блокирование синтеза ТГ при раке щитовидной железы происходит при метилировании.
- При раке щитовидной железы наблюдается гиперметилирование 5 -фланкирующей области гена ТГ, т. е. между экспрессией гена и его метилированием существует обратная корреляция.
1. Кадырова Д. А., Атаханова Б. А., Туракулов Я. X., Шипицына Г. И. II Молекул, биол. — 1989. — Т. 23, № 4. — С. 1101-1106.
2. Шипицына Г. И., Лунц М. Г., Шифтер К. А. и др. // Генетика. 1980. Т. 16, № 1. С. 78-85.
3. Libert F., Vassart G. // Biochem. biophys. Res. Commun. — 1986. Vol. 134. P. 1109-1116.
4. Southern К M. // J. Mol. Biol. 1973. Vol. 98. P. 509-517.
Экспрессия — что это и как она проявляется?
Вам приходилось слышать выражения «экспрессивная девушка» или «экспрессивный танец»? Слово «экспрессия» в переводе означает выразительность, интенсивное проявление настроения и эмоций. Экспрессия еще толкуется в качестве предъявления другим людям скрытых психологических личностных особенностей для прямого наблюдения.
Определение экспрессии
Что такое экспрессия? В медицине это генетический процесс, посредством которого содержащаяся в генах информация преобразуется в определенные клеточные структуры. Экспрессивность в биологии – это неразрывно связанное с жизнедеятельностью и здоровьем человека определение, которое получает дальнейшее развитие в психологии и психотерапии. К этой же медицинско-биологической сфере относится понятие «экспрессировать» – это означает транскрибировать и транслировать ген.
Экспрессивность – это степень выраженности определенного состояния, чувства, эмоции, отношения. Понятия «экспрессивность» и «экспрессия» применяются не только в психологии, но и в театроведении, искусствоведении, если требуется подчеркивать уровень выраженности духовности. А также показать средства выражения, к примеру, живопись, музыка, архитектурные элементы. Получается, что в имеющихся определениях данных терминов есть указания на связь этого явления с душевным и духовным миром людей.
Экспрессия – это выразительность чувств и эмоций, показ внутреннего состояния путем проявления его во внешности.
Противоположным по смыслу значением является импрессивность – склонность к внутренним, а не внешним переживаниям, накоплению преимущественно отрицательных чувств. О таких людях говорят, что они держат переживания в себе, не склонны делиться эмоциями и проблемами, обиды и расстройства к ним приходят не сразу, не моментально.
Мнения о связи внутреннего мира людей и экспрессии, которые сформировались по большей части в искусствоведении и философии, дополняются психологией. Сущность этой связи в психологическом выражении видна в том, что экспрессия получает место не только сопровождения действий внешне. Она выступает частью данных явлений, формой их проявления.
Экспрессивная девушка рассказывает что-то своей подругеПо этой причине стоит говорить об экспрессии в виде личностного образования, способа познания духовного мира личности, а также в качестве внешнего «Я».
Экспрессивное поведение
В науке под личностным экспрессивным поведением подразумевается соединение стойких и изменяющихся средств выражения, что организуются в разного рода структуры. Они перестраиваются в процессе создания социальных и психологических личностных качеств.
Подобное соединение средств включает части, которые обладают разным развитием изменений, а также отличаются уровнем требуемых усилий для этой цели. Итак, в составе личностного экспрессивного поведения содержатся части, которые обладают высоким уровнем непостоянства (мимика, интонации), в том числе средним и низким уровнями. Если человек экспрессивен, это включает и физиогномические элементы выразительности, одежда и прическа относятся к среднему уровню непостоянства. Существует также понятие «экспрессивный репертуар человека», означающий набор поз, интонаций, жестов, мимических состояний и их комбинаций для различных ситуаций общения.
Что такое экспрессивный человек? Это значит, что поведение личности представляет собой постоянно изменяющееся самоизваяние. Наше тело является зеркалом, которое отражает действие внешности и души. Внутренние перемены личности тянут за собой внешние изменения. По этой причине внешний вид не является беспорядочным сочетанием элементов, а строгим четким отражением личностных особенностей.
В экспериментальной науке привилегию получают непостоянные элементы экспрессии. Это сочетание движений, которые неустанно меняются согласно с положением и отношением человека. Подобные движения показываются с применением оптической системы. К зрительным методам общения психологами относится кинесика. Она являет собой широту движений, которая воспринимается зрительно и несет разную информацию с разных точек зрения партнеров. В ее состав включены только показательные жесты и позы с четкой семантикой.
Экспрессивных людей отличает эмоциональное, выразительное поведениеЭкспрессивные действия в виде внешнего «Я» связаны с его непостоянными и стойкими подструктурами. Это действительный показатель множества черт личности. Его можно рассматривать в виде:
проявления выразительных элементов всеобщей личностной активности, которая связана с темпераментом;
выразительного состава состояний психики;
показателя модальности знаков связи одной личности с другой;
способы экспрессии качеств;
признака развитости личности как субъекта коммуникации;
показа выразительных элементов социального статуса человека;
скрытия внешних «Я» личности;
способа показа и создания допустимого поведения.
Экспрессивность личности
Экспрессивность личности – это умение ярко и живо показывать собственные чувства, эмоции и отношение. Это понятие противоположно сдержанности. По мнению А. Маслоу, в нормальной личности обе черты существуют в гармонии, балансе. Адекватная личность не просто спонтанна: она спонтанна и экспрессивна тогда, когда ей этого хочется. Она способна расслабляться, отказываться от контроля, когда это к месту. Но такая личность способна и контролировать себя, откладывать удовольствия, проявлять вежливость и т. д.
В сопутствующих экспрессивности качествах нет обдуманности, осторожности, разумности и самообладания. Ее спутниками является возбудимость, внезапность и восторженность.
Наша душа отличается природной красотой. В зависимости от качеств личности, которые обуславливают демонстрацию энергетики души, наружу выходят инстинктивность, темпераментность, восторженность. А если энергетика души обуславливается пороками, то во внешнем мире проявляется необузданность и излишняя эмоциональность.
Экспрессивная личность проявляет все эмоции и чувства ярко, несдержанно. Для нее характерна чрезмерная возбудимость.
Слово «экспрессия» пришло из латыни – expressio, что означает нагнетание и выжимание. Экспрессия является внешним выражением переживаний и эмоций в первую очередь. Сюда стоит отнести слезы, истерику, восклицания, эмоциональные жесты, печаль, крики, апатичное состояние. В лингвистике русского языка присутствует термин «экспрессема» – это стилистическая единица, которая служит для раскрытия выразительных конструкций.
В каждой культуре экспрессивность в виде личностной черты по-разному трактуется. Активно жестикулирующий испанец в странах Прибалтики будет считаться экспрессивным человеком. Но на Родине его примут за меланхоличного человека. Получается, что проявление экспрессии немало определяется особенностью культуры.
Экспрессивная личность проявляет все эмоции и чувства ярко, несдержанноВ психологии эмоциональная экспрессия – это выразительность, сила проявления чувств, переживаний. Она рассматривается в виде обширного набора средств, применяя который личность показывает свои способности другим. Экспрессию в виде показа эмоций сумели «поймать» художники-экспрессионисты. Если зрители способны видеть в работах выражение эмоций, то они считаются экспрессивными.
Заключение
Понятно, что нет такого прибора или датчика, чтобы измерить, сколько экспрессии содержится в картине художника, хореографическом танце или поведении человека. Экспрессивные действия являются зеркалом, которое отражает или показывает состояние личности. Более того, подобное поведение – это часть естественного состояния человека.
И на десерт предлагаем видео – по-настоящему экспрессивное выступление гимнасток на Кубке России по эстетической гимнастике:
Международный научный семинар и практическая школа «Экспрессия генов»
7 декабря 2016 года аспирантка кафедры биохимии, молекулярной биологии и генетики Екатерина Сивопляс выступила с докладом «Регуляция экспрессии высококонсервативного гена Dras1 с помощью микроРНК у дрозофил группы virilis» на международном научном семинаре и практической школе «Экспрессия генов», проходившей 7-9 декабря на факультете биоинженерии и биоинформатики Московского государственного университета имени М.В. Ломоносова. В рамках международного семинара участвовал приглашенный докладчик Дэвид Жетьен, Институт Мари Кюри (Париж, Франция), который представил доклад об использовании результатов анализа экспрессии генов в диагностике опухолей. Третьим днем работы конференции стала практическая школа, на которой были представлены современное оборудование и методики работы по экспрессии генов.
На международном семинаре были обсуждены следующие фундаментальные вопросы:
• Регуляторные элементы генома;
• Факторы транскрипции и хроматин;
• Биология мРНК;
• Экспрессия генов в норме и при патологии.
Культура
Новогодний флеш-моб в Институте биологии и химии30 / 12 / 2020
В преддверии Нового Года каждый спешит поздравить друг друга: покупают подарки, записывают видео-ролики, некоторые пишут письма, участвуют в семейной фотосессии. Всюду царит предпраздничная суета. Улицы украшены, в окнах горят гирлянды, запах мандаринов и корицы слышен в воздухе. 2021 ждут с…
Культура
Поздравления с Новым годом из городов России29 / 12 / 2020
Все меньше дней остаётся в этом году и все ближе становится новый, 2021 год. Несмотря на количество испытаний, выпавших в этом году на преподавателей и студентов Института биологии и химии, мы смогли достойно их вынести и подойти к дверям Нового…
Новости образования
Из Москвы в Усть-Чём29 / 12 / 2020
Выпускница Института биологии и химии 2020 года Любовь Артюхина прошла отбор по программе «Учитель для России» и отправилась в Новосибирскую область учительствовать в сельскую школу! Люба с воодушевлением рассказывала о школе, рассчитанной на 200 человек, об оборудовании в кабинете биологии,…
Новости МПГУ
Студенты Института биологии и химии приняли участие в Эстафете успеха11 / 12 / 2020
10 декабря 2020 года состоялась общественно-педагогическая акция «Эстафета профессионального успеха». В её рамках проходили различные мастер-классы, некоторые из которых посетили студенты Института биологии и химии. Так, студенты 3 курса Института биологии и химии МПГУ посетили мастер-класс «Проекты и исследования школьников по…
Новости МПГУ
Взгляд, устремлённый в будущее10 / 12 / 2020
Для координации студентов Института биологии и химии МПГУ 4 декабря 2020 года на Форсайт-сессии в рамках Всероссийского форума «Новая образовательная среда 20/21», которую запустило Министерство просвещения России, была проведена работа над актуальным проектом, посвящённым школе будущего. В его основу легли…
Новости МПГУ
Экологичный новый год10 / 12 / 2020
Не так давно студенческий экологический клуб Recovery_MSPU провёл социальной опрос среди студентов и преподавателей нашего университета. Его цель — узнать, насколько экологично празднуется Новый год в нашей стране. Респондентам предлагалось ответить на вопросы о том, какие украшения они используют для…
Что такое экспрессия гена? | Факты
Экспрессия гена — это процесс, с помощью которого инструкции в нашей ДНК преобразуются в функциональный продукт, такой как белок.
- Когда информация, хранящаяся в нашей ДНК, преобразуется в инструкции по созданию белков или других молекул, это называется экспрессией генов.
- Экспрессия гена — это строго регулируемый процесс, который позволяет клетке реагировать на изменение окружающей среды.
- Он действует как переключатель включения / выключения для управления производством белков, а также как регулятор объема, который увеличивает или уменьшает количество производимых белков.
- Есть два ключевых этапа создания белка: транскрипция и трансляция.
Транскрипция
- Транскрипция — это когда ДНК в гене копируется для получения транскрипта РНК, называемого информационной РНК (мРНК).
- Это осуществляется ферментом, называемым РНК-полимеразой, который использует доступные основания из ядра клетки для формирования мРНК.
- РНК — это химическое вещество, сходное по структуре и свойствам с ДНК, но оно имеет только одну цепь оснований, а вместо основания тимина (T) РНК имеет основание, называемое урацилом (U).
Иллюстрация, показывающая процесс транскрипции.
Изображение предоставлено: Genome Research Limited
Трансляция
- Трансляция происходит после того, как информационная РНК (мРНК) передала транскрибированное «сообщение» от ДНК к фабрикам по производству белка в клетке, называемым рибосомами.
- Сообщение, переносимое мРНК, считывается молекулой-носителем, называемой транспортной РНК (тРНК).
- МРНК считывается по трем буквам (кодону) за раз.
- Каждый кодон определяет определенную аминокислоту. Например, три основания «GGU» кодируют аминокислоту под названием глицин.
- Поскольку существует только 20 аминокислот, но 64 потенциальных комбинации кодонов, более одного кодона могут кодировать одну и ту же аминокислоту. Например, кодоны «GGU» и «GGC» кодируют глицин.
- Каждая аминокислота специфически прикрепляется к своей собственной молекуле тРНК.
- Когда последовательность мРНК считывается, каждая молекула тРНК доставляет свою аминокислоту на рибосому и временно связывается с соответствующим кодоном на молекуле мРНК.
- Как только тРНК связывается, она высвобождает свою аминокислоту, и все соседние аминокислоты объединяются в длинную цепь, называемую полипептидом.
- Этот процесс продолжается до образования белка.
- Белки выполняют большинство активных функций клетки.
Иллюстрация, показывающая процесс перевода.
Изображение предоставлено: Genome Research Limited
Эта страница последний раз обновлялась 25.01.2016
белков и экспрессия генов | Изучайте науку в Scitable
Через призму клеточной биологии изучение экспрессии генов тесно связано с нашим пониманием белков.Начиная с ранних работ Кристиана Анфинсена в 1950-х годах, мы знаем, что последовательность аминокислот в белке определяет его окончательную трехмерную структуру. Исходя из этого, ученые неоднократно наблюдали, что структура белка определяет, где он будет действовать и что он будет делать. Нигде это не было так очевидно, как с функцией ферментов. Форма и структура белков — это важный аспект биологии экспрессии генов, который связывает наше понимание экспрессии генов с биологией клетки.Хотя в первую очередь речь идет о белковых молекулах, которые действуют на последовательности ДНК и РНК, таких как факторы транскрипции и гистоны, изучение экспрессии генов также сосредоточено на том, где в клетке модулируется экспрессия. Фактически, модуляция экспрессии генов может происходить в ядре, цитоплазме или даже на клеточной мембране из-за воздействия белков на РНК в этих клеточных субрегионах.
Как ученые изучают форму и функцию белка? Метод, называемый масс-спектрометрией, позволяет ученым определять последовательность аминокислот в белке.После того, как последовательность известна, сравнение ее аминокислотной последовательности с базами данных позволяет ученым определить, существуют ли связанные белки, функция которых уже известна. Часто аналогичные аминокислотные последовательности будут выполнять аналогичные функции в клетке. Аминокислотная последовательность также позволяет ученым предсказать заряд молекулы, ее размер и вероятную трехмерную структуру. Позже заряд и размер могут быть подтверждены экспериментально (с помощью SDS-PAGE и двухмерных гелей). Чтобы понять сложности трехмерной структуры, ученые попытаются кристаллизовать белок, чтобы подтвердить его молекулярную структуру с помощью рентгеновской кристаллографии и / или спектроскопии ядерного магнитного резонанса (pNMR).
Как ученые изучают влияние белков на гены или другие белки? Хороший способ изучить функцию белка — посмотреть, что происходит в клетке, когда белок отсутствует. Для этого ученые используют модельные системы, такие как культура клеток или целые организмы, в которых они могут тестировать функцию определенных белков или генов, изменяя или мутируя их. Уровень экспрессии гена может быть рассчитан путем измерения транскрибированной мРНК (нозерн-блот), экспрессированного белка (вестерн-блот) или путем прямого окрашивания белка или мРНК, когда они все еще находятся в клетке.Новые методы изменили способ изучения экспрессии генов — микроматрицы ДНК, последовательный анализ экспрессии генов (SAGE) и высокопроизводительное секвенирование позволяют проводить более широкий анализ нескольких молекул одновременно и открывают возможность для новых и более широких видов вопросов. Чтобы проанализировать большие наборы данных и увидеть, как взаимодействуют сети молекул, новая дисциплина, называемая системной биологией, обеспечивает основу для более широкого и интегрированного понимания регуляторных сетей.
Интересно, что белки — не единственные регуляторы генов.Регуляторные молекулы имеют форму РНК и действуют на другие нуклеиновые кислоты, изменяя или разрушая их. Одним из примеров является семейство рибопереключателей, молекул рибонуклеиновой кислоты, которые образуют трехмерные структуры, которые останавливают или препятствуют транскрипции при наличии надлежащего внешнего сигнала. Другим примером воздействия РНК на другие РНК является механизм РНК-интерференции (РНКи), при котором молекулы двухцепочечной РНК разлагают мРНК перед трансляцией, таким образом эффективно препятствуя экспрессии белка.Рассмотрение этого механизма и его последующее экспериментальное имитация было благом для тех, кто заинтересован в манипулировании функцией генов.
В конечном счете, результаты исследований такого рода имеют фундаментальное значение — от базового понимания нормальных функций клеток, таких как дифференциация, рост и деление клеток, до разработки принципиально новых подходов к лечению заболеваний. Фактически, некоторые заболевания человека могут возникать просто из-за дефекта трехмерной структуры белка.Изучая экспрессию генов и белков, легко увидеть, как мелкие изменения на молекулярном уровне имеют реверберирующий эффект.
Изображение: Библиотека биохимических алгоритмов.
экспрессии генов | Биология для майоров I
Результаты обучения
- Обсудите, почему каждая клетка не экспрессирует все свои гены
Чтобы клетка функционировала должным образом, необходимые белки должны синтезироваться в нужное время.Все клетки контролируют или регулируют синтез белков на основе информации, закодированной в их ДНК. Процесс включения гена для производства РНК и белка называется экспрессией гена . Будь то простой одноклеточный организм или сложный многоклеточный организм, каждая клетка контролирует, когда и как экспрессируются ее гены. Чтобы это произошло, должен существовать механизм, позволяющий контролировать, когда ген экспрессируется для образования РНК и белка, сколько белка производится и когда пора прекратить производство этого белка, потому что он больше не нужен.
Регулирование экспрессии генов сохраняет энергию и пространство. Организму потребуется значительное количество энергии для постоянной экспрессии каждого гена, поэтому более энергоэффективно включать гены только тогда, когда они необходимы. Кроме того, экспрессия только подмножества генов в каждой клетке экономит место, потому что ДНК необходимо раскручивать из ее плотно скрученной структуры, чтобы транскрибировать и транслировать ДНК. Клетки должны были бы быть огромными, если бы каждый белок экспрессировался в каждой клетке все время.
Контроль экспрессии генов чрезвычайно сложен. Сбои в этом процессе губительны для клетки и могут привести к развитию многих заболеваний, в том числе рака.
Генная регуляция делает клетки разными
Регуляция гена — это то, как клетка контролирует, какие гены из множества генов в ее геноме «включаются» (экспрессируются). Благодаря регуляции генов каждый тип клеток в вашем теле имеет разный набор активных генов, несмотря на то, что почти все клетки вашего тела содержат одну и ту же ДНК.Эти разные паттерны экспрессии генов приводят к тому, что разные типы клеток имеют разные наборы белков, что делает каждый тип клеток уникально специализированным для выполнения своей работы.
Например, одна из функций печени — удалять токсичные вещества, такие как алкоголь, из кровотока. Для этого клетки печени экспрессируют гены, кодирующие субъединицы (кусочки) фермента, называемого алкогольдегидрогеназой. Этот фермент расщепляет алкоголь на нетоксичные молекулы. Нейроны в мозгу человека не выводят токсины из организма, поэтому они сохраняют эти гены невыраженными или «выключенными».Точно так же клетки печени не посылают сигналы с помощью нейротрансмиттеров, поэтому они отключают гены нейротрансмиттеров (рис. 1).
Рис. 1. В разных клетках «включены» разные гены.
Есть много других генов, которые по-разному экспрессируются в клетках печени и нейронах (или любых двух типах клеток в многоклеточном организме, таком как вы).
Как клетки «решают», какие гены включить?
Возникает каверзный вопрос! Множество факторов, которые могут повлиять на то, какие гены экспрессирует клетка.Как мы видели выше, разные типы клеток экспрессируют разные наборы генов. Однако две разные клетки одного и того же типа могут также иметь разные паттерны экспрессии генов в зависимости от их среды и внутреннего состояния.
Вообще говоря, мы можем сказать, что паттерн экспрессии гена в клетке определяется информацией как изнутри, так и вне клетки.
- Примеры информации от внутри клетки : белки, которые она унаследовала от материнской клетки, повреждена ли ее ДНК и сколько в ней АТФ.
- Примеры информации от за пределами клетки: химические сигналы от других клеток, механические сигналы от внеклеточного матрикса и уровни питательных веществ.
Как эти сигналы помогают клетке «решить», какие гены экспрессировать? Клетки не принимают решений в том смысле, в каком это сделали бы вы или я. Вместо этого у них есть молекулярные пути, которые преобразуют информацию, такую как связывание химического сигнала с его рецептором, в изменение экспрессии генов.
В качестве примера рассмотрим, как клетки реагируют на факторы роста.Фактор роста — это химический сигнал от соседней клетки, который заставляет клетку-мишень расти и делиться. Можно сказать, что клетка «замечает» фактор роста и «решает» делиться, но как эти процессы на самом деле происходят?
Рисунок 2. Фактор роста, провоцирующий деление клетки
- Клетка обнаруживает фактор роста посредством физического связывания фактора роста с рецепторным белком на поверхности клетки.
- Связывание фактора роста заставляет рецептор изменять форму, вызывая серию химических событий в клетке, которые активируют белки, называемые факторами транскрипции.
- Факторы транскрипции связываются с определенными последовательностями ДНК в ядре и вызывают транскрипцию генов, связанных с делением клетки.
- Продукты этих генов представляют собой различные типы белков, которые заставляют клетку делиться (стимулировать рост клеток и / или продвигать клетку вперед в клеточном цикле).
Это всего лишь один пример того, как клетка может преобразовать источник информации в изменение экспрессии генов. Есть много других, и понимание логики регуляции генов — это область текущих исследований в биологии сегодня.
Передача сигналов фактора роста сложна и включает активацию множества мишеней, включая как факторы транскрипции, так и белки факторов нетранскрипции.
Вкратце: Экспрессия генов
- Регуляция генов — это процесс контроля того, какие гены в ДНК клетки экспрессируются (используются для производства функционального продукта, такого как белок).
- Различные клетки многоклеточного организма могут экспрессировать очень разные наборы генов, даже если они содержат одну и ту же ДНК.
- Набор генов, экспрессируемых в клетке, определяет набор белков и функциональных РНК, которые она содержит, что придает ей уникальные свойства.
- У эукариот, таких как люди, экспрессия генов включает много этапов, и регуляция генов может происходить на любом из этих этапов. Однако многие гены регулируются в первую очередь на уровне транскрипции.
Алкогольдегидрогеназа. (2016, 6 января). Получено 26 апреля 2016 г. из Википедии: https://en.wikipedia.org/wiki/Alcohol_dehydrogenase.
Купер, Г. М. (2000). Регуляция транскрипции у эукариот. In Клетка: молекулярный подход . Сандерленд, Массачусетс: Sinauer Associates. Получено с http://www.ncbi.nlm.nih.gov/books/NBK9904/.
Кимбалл, Джон В. (2014, 19 апреля). Геномы человека и шимпанзе. В страницах биологии Кимбалла . Получено с http://www.biology-pages.info/H/HominoidClade.html.
Колледж OpenStax, Биология. (2016, 23 марта). Регуляция генов транскрипции эукариот.В _OpenStax CNX. Получено с http://cnx.org/contents/[email protected]:[email protected]/Eukaryotic-Transcription-Gene-.
Колледж OpenStax, Биология. (2016, 23 марта). Регуляция экспрессии генов. В _OpenStax CNX. Получено с http://cnx.org/contents/[email protected]:[email protected]/Regulation-of-Gene-Expression
Филлипс, Т. (2008). Регуляция транскрипции и экспрессии генов у эукариот. Nature Education , 1 (1), 199. Получено с http: //www.nature.com / scitable / topicpage / регуляция-транскрипции-и-экспрессии-генов-в-1086.
Первес, В. К., Садава, Д. Э., Орианс, Г. Х., Хеллер, Х. К. (2003). Транскрипционная регуляция экспрессии генов. В Жизнь: Биология (7-е изд., Стр. 290-296). Сандерленд, Массачусетс: Sinauer Associates.
Рис, Дж. Б., Урри, Л. А., Каин, М. Л., Вассерман, С. А., Минорски, П. В., и Джексон, Р. Б. (2011). Экспрессия эукариотических генов регулируется на многих этапах. В Campbell Biology (10-е изд., стр. 365-373). Сан-Франциско, Калифорния: Пирсон.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
4.11: Экспрессия генов — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Экспрессия гена
- Как регулируется экспрессия гена
- Сводка
- Узнать больше
- Review
Может ли ваша экспрессия измениться в любой момент?
Как известно, выражение лица человека может меняться мгновенно.Выражение, которое демонстрируется, обычно подходит для чувств в этот момент. Экспрессия гена — это использование гена, продукт которого необходим в данный момент. Это может быть момент в процессе развития, это может быть момент повышенной тревожности или может быть реакцией на изменение окружающей среды. Когда нужен конкретный белок, его обеспечивает экспрессия генов.
Экспрессия гена
Каждая из ваших клеток имеет не менее 20 000 генов. Фактически, все ваши клетки имеют одни и те же гены.Все ли ваши клетки производят одни и те же белки? Очевидно нет. Если бы они это сделали, то все ваши клетки были бы похожи. Вместо этого у вас есть клетки с разными структурами и функциями. Это потому, что разные клетки производят разные белки. Они делают это, используя или экспрессируя разные гены. Использование гена для создания белка называется экспрессией гена .
Как регулируется экспрессия генов
Экспрессия генов регулируется, чтобы гарантировать, что правильные белки производятся тогда и там, где они необходимы.Регуляция может происходить в любой момент экспрессии гена, от начала транскрипции до процессинга белка после трансляции. Ниже приводится список стадий, на которых регулируется экспрессия гена:
- Химическая и структурная модификация ДНК или хроматина
- Транскрипция
- Трансляция
- Посттранскрипционная модификация
- Транспорт РНК
- Деградация мРНК
- Посттрансляционные модификации
Как показано на Рисунке ниже, транскрипция контролируется регуляторными белками , связывающимися с ДНК.В частности, регуляция генов на уровне транскрипции контролирует, когда транскрипция происходит, а также сколько создается РНК. Регуляторный белок, или фактор транскрипции , представляет собой белок, участвующий в регуляции экспрессии генов. Обычно он связан с цис-регуляторным элементом , который является частью ДНК. Регуляторные белки часто должны быть связаны с цис-регуляторным элементом, чтобы включить ген (активатор , ) или выключить ген (репрессор , ).
Транскрипция гена РНК-полимеразой может регулироваться по крайней мере пятью механизмами:
- Факторы специфичности (белки) изменяют специфичность РНК-полимеразы в отношении промотора или набора промоторов, делая ее более или менее вероятной для связывания с промотор и начать транскрипцию.
- Белки-активаторы усиливают взаимодействие между РНК-полимеразой и конкретным промотором.
- Репрессорные белки связываются с некодирующими последовательностями ДНК, которые находятся рядом с промоторной областью или перекрывают ее, препятствуя продвижению РНК-полимеразы по цепи.
- Базальные факторы — это факторы транскрипции, которые помогают позиционировать РНК-полимеразу в начале гена.
- Энхансеры — это участки на цепи ДНК, которые связываются активаторами, чтобы создать петлю ДНК, привнося в комплекс инициации специфический фактор транскрипции.Инициирующий комплекс состоит из РНК-полимеразы и факторов транскрипции.
По мере того, как организм становится более сложным, регуляция генов становится более сложной, хотя прокариотические организмы обладают некоторыми строго регулируемыми системами. Некоторые гены человека контролируются множеством активаторов и репрессоров, работающих вместе. Очевидно, что мутация в цис-регуляторной области, такой как промотор, может сильно повлиять на правильную экспрессию гена. Он может постоянно держать ген выключенным, так что белок не может быть произведен, или он может держать ген постоянно включенным, так что соответствующий белок вырабатывается постоянно.Оба они могут иметь пагубные последствия для клетки.
Регулирование транскрипции. Регуляторные белки связываются с регуляторными элементами для контроля транскрипции. Регуляторные элементы встроены в ДНК.
Резюме
- Транскрипция гена контролируется регуляторными белками, которые связываются с регуляторными элементами ДНК.
- Белки обычно либо активируют, либо репрессируют транскрипцию.
Узнать больше
Используйте этот ресурс, чтобы ответить на следующие вопросы.
- Что такое экспрессия гена? на сайте www.news-medical.net/health/What-is-Gene-Expression.aspx.
- Что такое экспрессия гена?
- Что нужно для начала транскрипции?
- Что получается при «чтении» ДНК?
- Где находится промотор гена по отношению к сайту начала транскрипции?
Обзор
- Что такое экспрессия гена?
- Почему регулируется экспрессия генов?
- Перечислите три стадии, на которых регулируется экспрессия генов.
- Опишите, как регуляторные белки регулируют экспрессию генов.
- Сравните активаторы с репрессорами.
Экспрессия и регуляция генов — Лестерский университет
Экспрессия гена
Экспрессия гена — это процесс, с помощью которого генетический код — нуклеотидная последовательность — гена используется для управления синтезом белка и создания структур клетки. Гены, кодирующие аминокислотные последовательности, известны как «структурные гены».
Процесс экспрессии гена включает два основных этапа:
Транскрипция: производство информационной РНК (мРНК) ферментом РНК-полимеразой и обработка полученной молекулы мРНК.
Трансляция : использование мРНК для управления синтезом белка и последующий посттрансляционный процессинг белковой молекулы.
Некоторые гены ответственны за производство других форм РНК, которые играют роль в трансляции, включая РНК переноса (тРНК) и рибосомную РНК (рРНК).
Структурный ген включает ряд различных компонентов:
- экзонов. Экзоны кодируют аминокислоты и вместе определяют аминокислотную последовательность белкового продукта. Именно эти части гена представлены в конечной зрелой молекуле мРНК.
- Интронов. Интроны — это части гена, которые не кодируют аминокислоты и удаляются (сплайсируются) из молекулы мРНК перед трансляцией.
Области контроля генов
- Стартовая площадка .Стартовый сайт для транскрипции.
- Промоутер . Область на несколько сотен нуклеотидов «выше» гена (ближе к 5′-концу). Он не транскрибируется в мРНК, но играет роль в контроле транскрипции гена. Факторы транскрипции связываются со специфическими нуклеотидными последовательностями в промоторной области и способствуют связыванию РНК-полимераз.
- Усилители . Некоторые факторы транскрипции (называемые активаторами) связываются с участками, называемыми «энхансерами», которые увеличивают скорость транскрипции.Эти сайты могут состоять из тысяч нуклеотидов кодирующих последовательностей или внутри интрона. Некоторые энхансеры являются условными и работают только в присутствии других факторов, а также факторов транскрипции.
- Глушители . Некоторые факторы транскрипции (называемые репрессорами) связываются с участками, называемыми «сайленсерами», которые снижают скорость транскрипции.
Примечание. Термин «экспрессия гена» иногда используется для обозначения только фазы транскрипции.
Транскрипция
Транскрипция — это процесс синтеза РНК, контролируемый взаимодействием промоторов и энхансеров.Производится несколько различных типов РНК, в том числе матричная РНК ( мРНК ), которая определяет последовательность аминокислот в белковом продукте, плюс РНК-переносчик ( тРНК ) и рибосомная РНК ( рРНК ). ), которые играют роль в процессе перевода.
Транскрипция включает четыре этапа:
- Инициирование . Молекула ДНК раскручивается и разделяется с образованием небольшого открытого комплекса .РНК-полимераза связывается с промотором матричной цепи .
- Удлинение . РНК-полимераза перемещается по матричной цепи, синтезируя молекулу мРНК. В прокариотах РНК-полимераза представляет собой холофермент, состоящий из ряда субъединиц, включая сигма-фактор (фактор транскрипции), который распознает промотор. У эукариот есть три РНК-полимеразы: I, II и III. Процесс включает в себя механизм корректуры.
- Прекращение действия .У прокариот есть два пути обрыва транскрипции. В Rho-зависимом терминации белковый фактор, называемый «Rho», ответственен за разрушение комплекса, включающего матричную цепь, РНК-полимеразу и молекулу РНК. В Rho-независимом окончании на конце молекулы РНК образуется петля, заставляющая ее отщепляться. Терминирование у эукариот более сложное, включая добавление дополнительных нуклеотидов аденина в 3 ‘транскрипта РНК (процесс, называемый полиаденилированием ).
- Обработка . После транскрипции молекула РНК подвергается процессингу несколькими способами: интроны удаляются, а экзоны соединяются вместе, образуя зрелую молекулу мРНК, состоящую из единственной последовательности, кодирующей белок. Синтез РНК включает нормальные правила спаривания оснований, но основание тимина заменяется основанием урацилом .
Перевод
При трансляции зрелая молекула мРНК используется в качестве матрицы для сборки ряда аминокислот для получения полипептида с определенной аминокислотной последовательностью.Комплекс в цитоплазме, в котором это происходит, называется рибосомой . Рибосомы представляют собой смесь рибосомных белков и рибосомальной РНК (рРНК) и состоят из большой субъединицы и небольшой субъединицы.
Перевод состоит из четырех этапов:
- Инициирование . Маленькая субъединица рибосомы связывается на 5′-конце молекулы мРНК и движется в 3′-направлении, пока не встретит стартовый кодон (AUG). Затем он образует комплекс с большой единицей рибосомного комплекса и инициирующей молекулой тРНК.
- Удлинение . Последующие кодоны на молекуле мРНК определяют, какая молекула тРНК, связанная с аминокислотой, связывается с мРНК. Фермент пептидилтрансфераза связывает аминокислоты вместе с помощью пептидных связей. Процесс продолжается, образуя цепочку аминокислот по мере того, как рибосома движется вдоль молекулы мРНК.
- Прекращение действия . Трансляция прекращается, когда рибосомный комплекс достигает одного или нескольких стоп-кодонов (UAA, UAG, UGA). Рибосомный комплекс у эукариот крупнее и сложнее, чем у прокариот.Кроме того, процессы транскрипции и трансляции у эукариот разделены между ядром (транскрипция) и цитоплазмой (трансляция), что предоставляет больше возможностей для регуляции экспрессии генов.
- Посттрансляционная обработка белка
Генная регуляция
Регуляция генов — это метка для клеточных процессов, которые контролируют скорость и характер экспрессии генов. Сложный набор взаимодействий между генами, молекулами РНК, белками (включая факторы транскрипции) и другими компонентами системы экспрессии определяет, когда и где активируются определенные гены, а также количество продуцируемого белка или продукта РНК.
Некоторые гены экспрессируются непрерывно, поскольку они продуцируют белки, участвующие в основных метаболических функциях; некоторые гены экспрессируются как часть процесса дифференцировки клеток; и некоторые гены экспрессируются в результате дифференцировки клеток.
Механизмы регуляции генов включают:
- Регулировка скорости транскрипции. Это наиболее экономичный способ регулирования.
- Регулирование процессинга молекул РНК, включая альтернативный сплайсинг для получения более чем одного белкового продукта из одного гена.
- Регулирование стабильности молекул мРНК.
- Регулирование скорости перевода.
Факторы транскрипции — это белки, которые играют роль в регуляции транскрипции генов путем связывания со специфическими регуляторными нуклеотидными последовательностями.
Вернуться к началу
Это произведение находится под лицензией Creative Commons License.
Экспрессия гена— обзор
3.3 Базы данных по геномной экспрессии
Базы данных по экспрессии генов на геномном уровне включают Атлас экспрессии генов мышей (таблица 1.3; Siddiqui et al ., 2005). Этот атлас обеспечивает доступ к библиотекам последовательного анализа экспрессии генов (SAGE), полученным из эмбрионов мыши на всех стадиях развития, включая оплодотворенные яйца и эмбриональные стволовые (ES) клетки. Подход был разработан для идентификации дифференциально экспрессируемых генов на протяжении эмбриогенеза. Библиотеки SAGE и программное обеспечение DiscoverySpace для анализа общедоступны и содержат ссылки на другие общедоступные базы данных.Гены, представляющие интерес в Атласе экспрессии генов мышей, должны быть локализованы путем ссылки на базы данных экспрессии, которые включают анатомические аннотации.
Таблица 1.3. Геномные библиотеки экспрессии генов
| Мышиный Атлас экспрессии генов |
| http://www.mouseatlas.org/data/mouse/devstages |
| GermSAGE: Транскриптом мужской зародышевой клетки |
| http: //germsage.nichd.nih.gov |
| GonadSAGE: транскриптом мужских эмбриональных гонад |
| http: // gonadsage.nichd.nih.gov |
| Атлас экспрессии генов ArrayExpress |
| http://www.ebi.ac.uk/microarray-as/atlas |
| Омнибус экспрессии генов |
| http: // www .ncbi.nlm.nih.gov / geo |
| База данных экспрессии генов в 4D |
| http://4dx.embl.de/4DXpress |
GermSAGE и GonadSAGE предназначены для транскриптома мужского зародыша клетки и развивающиеся гонады самцов мыши соответственно (таблица 1.3; Ли и др. , 2009, 2010). Для GermSAGE библиотеки получали из сперматогоний типа А, пахитеновых сперматоцитов или круглых сперматид. Для GonadSage библиотеки были сконструированы из гонад самцов мышей, собранных на e10.5, e11.5, e12.5, e13.5, e15.5 и e17.5. База данных с возможностью поиска по названию гена доступна для каждой стадии развития. Локализация генов в зародышевых клетках доступна в GermSAGE, но специфическая для клеток экспрессия в гонадах не аннотирована.
Данные об экспрессии генов, основанные на экспериментах на микроматрицах, быстро распространились, и к ним можно получить доступ через различные веб-интерфейсы.К ним относятся Атлас экспрессии генов ArrayExpress, поддерживаемый Европейским институтом биоинформатики, Омнибус экспрессии генов (GEO), поддерживаемый Национальным центром биотехнологической информации (NIH), и база данных экспрессии генов в 4D, поддерживаемая Европейской лабораторией молекулярной биологии (таблица 1.3. ; Barrett et al ., 2009; Haudry et al ., 2008; Капушески et al ., 2010). Конкретные подмножества данных с микрочипов, которые могут представлять интерес, включают данные из ряда линий ES-клеток мыши, депонированных в GEO.Исследователи могут загружать наборы данных генов, экспрессируемых в линиях ES-клеток мыши, включая R1, J1, V6.5, гомозиготные мутантные ES-клетки, дифференцированные ES-клетки и т. Д. Открытый доступ к данным об экспрессии генов имеет жизненно важное значение для исследований и может привести к важным открытиям. Например, цифровой дифференциальный дисплей был использован для анализа библиотек экспрессируемых последовательностей тегов в GEO для идентификации генов, специфически экспрессируемых в ES-клетках мыши (Tokuzawa et al. , 2003, 2006). Это исследование привело к созданию мыши с нокаутом Fbx15 , которая сыграла важную роль в идентификации четырех факторов транскрипции ( Pou5f1 , Sox2 , c-myc и Klf4 ), необходимых для создания индуцированных плюрипотентные стволовые клетки из фибробластов мыши (Takahashi and Yamanaka, 2006).
9.5 Как регулируются гены — Концепции биологии — 1-е канадское издание
Цели обученияК концу этого раздела вы сможете:
- Обсудите, почему каждая клетка не экспрессирует все свои гены
- Опишите, как экспрессия прокариотических генов происходит на уровне транскрипции
- Понимать, что экспрессия эукариотических генов происходит на эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном уровнях
Чтобы клетка функционировала должным образом, необходимые белки должны синтезироваться в нужное время.Все организмы и клетки контролируют или регулируют транскрипцию и трансляцию своей ДНК в белок. Процесс включения гена для производства РНК и белка называется экспрессией гена. Будь то простой одноклеточный организм или сложный многоклеточный организм, каждая клетка контролирует, когда и как экспрессируются ее гены. Чтобы это произошло, должен существовать механизм, позволяющий контролировать, когда ген экспрессируется для образования РНК и белка, сколько белка производится и когда пора прекратить производство этого белка, потому что он больше не нужен.
Клетки в многоклеточных организмах специализированы; клетки в разных тканях выглядят очень по-разному и выполняют разные функции. Например, мышечная клетка сильно отличается от клетки печени, которая сильно отличается от клетки кожи. Эти различия являются следствием экспрессии разных наборов генов в каждой из этих клеток. У всех клеток есть определенные основные функции, которые они должны выполнять сами, например, преобразование энергии молекул сахара в энергию АТФ. Каждая клетка также имеет много генов, которые не экспрессируются, и экспрессирует многие из них, которые не экспрессируются другими клетками, так что она может выполнять свои специализированные функции.Кроме того, клетки будут включать или выключать определенные гены в разное время в ответ на изменения в окружающей среде или в разное время в ходе развития организма. Одноклеточные организмы, как эукариотические, так и прокариотические, также включают и выключают гены в ответ на требования окружающей среды, чтобы они могли реагировать на особые условия.
Контроль экспрессии генов чрезвычайно сложен. Сбои в этом процессе губительны для клетки и могут привести к развитию многих заболеваний, в том числе рака.
Чтобы понять, как регулируется экспрессия генов, мы должны сначала понять, как ген становится функциональным белком в клетке. Этот процесс происходит как в прокариотических, так и в эукариотических клетках, но несколько по-разному.
Поскольку у прокариотических организмов отсутствует клеточное ядро, процессы транскрипции и трансляции происходят почти одновременно. Когда белок больше не нужен, транскрипция прекращается. В результате основным методом контроля того, какой тип и сколько белка экспрессируется в прокариотической клетке, является регуляция транскрипции ДНК в РНК.Все последующие шаги происходят автоматически. Когда требуется больше белка, происходит больше транскрипции. Следовательно, в прокариотических клетках контроль экспрессии генов почти полностью осуществляется на уровне транскрипции.
Первый пример такого контроля был обнаружен с использованием E . coli в 1950-х и 1960-х французскими исследователями и называется опероном lac . Оперон lac представляет собой участок ДНК с тремя соседними генами, которые кодируют белки, которые участвуют в абсорбции и метаболизме лактозы, источника пищи для E . coli . Когда лактоза отсутствует в среде бактерии, гены lac транскрибируются в небольших количествах. Когда присутствует лактоза, гены транскрибируются, и бактерия может использовать лактозу в качестве источника пищи. Оперон также содержит промоторную последовательность, с которой связывается РНК-полимераза, чтобы начать транскрипцию; между промотором и тремя генами находится область, называемая оператором. При отсутствии лактозы белок, известный как репрессор, связывается с оператором и предотвращает связывание РНК-полимеразы с промотором, за исключением редких случаев.Таким образом, белковых продуктов трех генов вырабатывается очень мало. Когда присутствует лактоза, конечный продукт метаболизма лактозы связывается с репрессорным белком и предотвращает его связывание с оператором. Это позволяет РНК-полимеразе связываться с промотором и свободно транскрибировать три гена, позволяя организму метаболизировать лактозу.
Эукариотические клетки, напротив, имеют внутриклеточные органеллы и намного сложнее. Напомним, что в эукариотических клетках ДНК содержится внутри ядра клетки и там транскрибируется в мРНК.Вновь синтезированная мРНК затем транспортируется из ядра в цитоплазму, где рибосомы переводят мРНК в белок. Процессы транскрипции и трансляции физически разделены ядерной мембраной; транскрипция происходит только внутри ядра, а трансляция происходит только вне ядра в цитоплазме. Регуляция экспрессии генов может происходить на всех этапах процесса (рис. 9.22). Регуляция может происходить, когда ДНК разматывается и отделяется от нуклеосом для связывания факторов транскрипции (эпигенетический уровень), когда РНК транскрибируется (уровень транскрипции), когда РНК обрабатывается и экспортируется в цитоплазму после ее транскрипции (посттранскрипционный уровень) , когда РНК транслируется в белок (уровень трансляции) или после того, как белок был произведен (посттрансляционный уровень).
Рисунок 9.22. Экспрессия эукариотических генов регулируется во время транскрипции и процессинга РНК, которые происходят в ядре, а также во время трансляции белка, которая происходит в цитоплазме. Дальнейшая регуляция может происходить посредством посттрансляционных модификаций белков.Различия в регуляции экспрессии генов между прокариотами и эукариотами суммированы в таблице ниже.
| Прокариотические организмы | Эукариотические организмы |
|---|---|
| Отсутствие ядра | Содержит ядро |
| Транскрипция РНК и трансляция белка происходят почти одновременно |
|
| Экспрессия гена регулируется в первую очередь на уровне транскрипции | Экспрессия гена регулируется на многих уровнях (эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном) |
Альтернативный сплайсинг РНК
В 1970-х годах были впервые обнаружены гены, которые демонстрируют альтернативный сплайсинг РНК.Альтернативный сплайсинг РНК — это механизм, который позволяет производить различные белковые продукты из одного гена, когда из транскрипта удаляются разные комбинации интронов (а иногда и экзонов) (рис. 9.23). Этот альтернативный сплайсинг может быть случайным, но чаще он контролируется и действует как механизм генной регуляции, при этом частота различных альтернатив сплайсинга контролируется клеткой как способ контроля производства различных белковых продуктов в разных клетках или разные стадии развития.Альтернативный сплайсинг теперь считается обычным механизмом регуляции генов у эукариот; согласно одной оценке, 70% генов у человека экспрессируются как множественные белки посредством альтернативного сплайсинга.
Рисунок 9.23 Существует пять основных режимов альтернативного сращивания. Сегменты пре-мРНК с экзонами, показанными синим, красным, оранжевым и розовым цветом, могут быть сплайсированы для получения множества новых зрелых сегментов мРНК.Как могло развиваться альтернативное сращивание? Интроны имеют начальную и конечную последовательность распознавания, и легко представить себе неспособность механизма сплайсинга идентифицировать конец интрона и найти конец следующего интрона, таким образом удаляя два интрона и промежуточный экзон.Фактически, существуют механизмы, предотвращающие такой пропуск экзонов, но мутации, скорее всего, приведут к их отказу. Такие «ошибки» более чем вероятно приведут к нефункциональному белку. Действительно, причиной многих генетических заболеваний является альтернативный сплайсинг, а не мутации в последовательности. Однако альтернативный сплайсинг мог бы создать вариант белка без потери исходного белка, открывая возможности для адаптации нового варианта к новым функциям. Дублирование генов сыграло важную роль в развитии новых функций аналогичным образом — предоставив гены, которые могут развиваться, не устраняя исходный функциональный белок.
Хотя все соматические клетки в организме содержат одну и ту же ДНК, не все клетки в этом организме экспрессируют одни и те же белки. Прокариотические организмы экспрессируют всю ДНК, которую они кодируют в каждой клетке, но не обязательно все одновременно. Белки экспрессируются только тогда, когда они необходимы. Эукариотические организмы экспрессируют часть ДНК, которая кодируется в любой данной клетке. В каждом типе клеток тип и количество белка регулируются путем контроля экспрессии генов. Для экспрессии белка ДНК сначала транскрибируется в РНК, а затем транслируется в белки.В прокариотических клетках эти процессы происходят практически одновременно. В эукариотических клетках транскрипция происходит в ядре и отделена от трансляции, происходящей в цитоплазме. Экспрессия генов у прокариот регулируется только на уровне транскрипции, тогда как в эукариотических клетках экспрессия генов регулируется на эпигенетическом, транскрипционном, посттранскрипционном, трансляционном и посттрансляционном уровнях.
Глоссарийальтернативный сплайсинг РНК: посттранскрипционный механизм регуляции гена у эукариот, в котором несколько белковых продуктов продуцируются одним геном посредством альтернативных комбинаций сплайсинга транскрипта РНК
эпигенетический: , описывающий негенетические регуляторные факторы, такие как изменения в модификациях гистоновых белков и ДНК, которые контролируют доступность генов в хромосомах
экспрессия гена: процессов, которые контролируют, экспрессируется ли ген
посттранскрипционный: контроль экспрессии гена после создания молекулы РНК, но до ее трансляции в белок
посттрансляционный: контроль экспрессии гена после создания белка
.Действие генов реферат по биологии
ДЕЙСТВИЕ ГЕНОВ Под действием генов (экспрессией, выражением генов) понимают способность их контролировать свойства или, точнее, синтез белков. Для действия генов характерен ряд особенностей, важнейшей из которых является их экспрессивность, под которой понимают степень фенотипической выраженности генов, т. е. «силу» действия генов, проявляющуюся в степени развития контролируемых ими признаков. Термин предложен Н. В. Тимофеевым-Ресовским (1900-1981). Экспрессивность генов не является постоянным свойством наследственности, ибо она очень вариабельна у растений, животных и у человека. Например, у разных людей проявляется по- разному такой признак, как способность ощущать вкус фенилтиокарбамида. Для одних людей это вещество является слишком горьким, для других его горечь кажется меньшей, что является результатом разной степени экспрессивности гена, контролирующего способность ощущать вкус этого соединения. Примером вариабельности экспрессивности генов является также экспрессивность доминантного гена, контролирующего ювенильную катаракту глаз человека. Экспрессия этого гена у разных индивидуумов варьирует от слабого помутнения хрусталика глаз до его полной непрозрачности. С другой стороны, для действия генов у млекопитающих характерен так называемый геномный импринтинг, заключающийся в том, что два аллеля гена экспрессируются дифференциально, т. е. экспрессируется только один аллель из двух аллелей (отцовского и материнского), унаследованных от родителей. Например, у человека ген инсулинподобного фактора 2 нормально экспрессируется только из аллеля, унаследованного от отца, тогда как соседний с ним ген, кодирующий нетранслируемую РНК, экспрессируется только из аллеля, унаследованного от матери. Важнейшей особенностью действия генов является также их пенетрантность, впервые описанная тоже Н. В. Тимофеевым-Ресовским. Под ней понимают частоту проявления того или иного гена, измеряемую частотой встречаемости признака в популяции, т. е. частотой встречаемости в популяции организмов, обладающих этим признаком. Перетрантность является статистической концепцией регулярности, с которой выражается (экспрессируется) тот или иной ген в популяции. Если какой-либо ген в популяции фенотипически выражается у индивидуумов, количество которых составляет 75% обследованных, то считают, что его пенетрантность тоже составляет 75%. Например, доминантный ген, контролирующий изменение цвета склеры глаз человека встречается у 90% людей. Следовательно, пенетрантность этого гена составляет 90%. Экспрессивность и пенетрантность подвержены колебаниям. Причины этих колебаний не совсем ясны. Тем не менее, обычно вариабельность в экспрессивности и пенетрантности генов объясняют либо модифицирующим влиянием других генов, которые получили название генов-модификаторов, либо совместным действием обоих этих факторов, а возможно и других факторов. Учет природы экспрессивности и пенетрантности генов имеет большое практическое значение в генетике человека, животных и растений. В случае человека эти явления учитывают при диагностике наследственных болезней, тогда как в животноводстве и растениеводстве они используются в селекции животных и растений. Организмы наследуют от своих родителей не признаки и не свойства, как это долго считали ранее. Они наследуют гены, которые действуют на протяжении всей жизни организмов. В соответствии с существующими представлениями действие генов осуществляется через мРНК и приводит к образованию белков. Следовательно, мРНК являются первичными продуктами, тогда как белки являются конечными продуктами действия генов, т.е. результатом действия генов. Другими словами, гены контролируют структуру белков и ничего больше. Поскольку материалом генов является ДНК, то в самом начале после открытия генетической роли ДНК возник вопрос и сводился к следующему: каким образом ДНК осуществляет свои функции в контроле синтеза белков? Ответ на этот вопрос заключается в том, что в ДНК содержится у некоторых других эукариотов — даже несколько недель. У прокариотов молекулы мРНК являются непосредственными продуктами транскрипции. Напротив, у эукариотов они являются продуктами процессинга первичных РНК-транскриптов Синтез молекул мРНК происходит в ядре клетки и очень сходен с репликацией ДНК. Отличие заключается лишь в том, что в качестве матрицы (шаблона) для копирования цепи мРНК используется лишь одна цепь ДНК. При этом копирование мРНК может начаться с любого пункта одиночной цепи ДНК, к которому прикрепляется РНК-полимераза и который называют промотором. Однако возможны случаи, когда два даже соседних гена могут транскрибироваться с разных цепей. Таким образом, для транскрипции может быть использована любая из двух цепей ДНК но в любом случае одна из цепей транскрибируется одними РНК-полимеразами, другая — другими РНК-полимеразами, причем выбор цепи ДНК для транскрипции определяется промоторной последовательностью, которая задает направление движения РНК-полимеразы . Поскольку обе цепи ДНК имеют противоположную полярность, а цепи РНК растут лишь в направлении от 5′-конца к 3′-концу, то транскрипции на каждой из цепей ДНК проходят в противоположных направлениях. Выбор цепи ДНК для транскрипции определяется содержанием последовательностей на ее промоторных участках (местах присоединения РНК-полимеразы). Цепь, которая содержит те же последовательности, что и мРНК, называют кодирующей, а цепь, обеспечивающую синтез мРНК (на основе комплементарного спаривания) — антикодирующей. Из-за считывания кода с мРНК для его записи используют основания не А, Г, Т, Ц, а А, Г, У, Ц. Далее, мРНК не остается комплементарно связанной с ДНК- шаблоном, т. к. она освобождается от ДНК, которая затем восстанавливает свою двойную структуру. Наконец, молекулы мРНК значительно короче цепи шаблона ДНК. В одной эукаритической клетке количество молекул мРНК доходит до 10 000 и более. Однако наряду с молекулами мРНК на ДНК образуются и другие транскрипты. В частности, транскрибируются молекулы рибосомной и транспортных РНК, которые также имеют важное значение в реализации генетической информации. Все эти РНК называют еще ядерными. Размеры транскриптов (транскрибируемых молекул РНК) зависят от посылаемых с цепи ДНК-шаблона сигналов начала и остановки синтеза (кодонов инициации и терминации). Наиболее обильными РНК в клетках всех видов являются молекулы рибосомной РНК (рРНК), которые выполняют роль структурных компонентов рибосом. У эукариот синтез рРНК контролируется огромным количеством генов (сотни-тысячи копий) и происходит в ядрышке. В клетках человека гены для рРНК локализованы на 13, 14, 15, 21 и 22 парах хромосом. В меньших количествах в клетках обнаруживаются молекулы транспортных РНК (тРНК), которые участвуют в декодировании информации (трансляции). Все РНК транскрибируются с ДНК, которая несет множественные копии соответствующих генов. Непосредственными предшественниками в синтезе РНК являются рибонуклеозидтрифосфаты, причем здесь действует то же правило спаривания оснований за исключением того, что кодируются лишь ограниченные сегменты цепи ДНК и что тимин в ДНК заменяется на урацил в РНК. Ура-цил спаривается с аденином таким же образом, как и тимин. Цепь РНК растет в направлении от 5′- к 3′-концу с освобождением пирофосфата. Синтез РНК обеспечивается РНК-полимеразами. У прокариот синтез мРНК, рРНК и тРНК осуществляет лишь один тип РНК-полимеразы, количество молекул которой в клетках достигает до 3000 молекул. Каждая из молекул этой РНК-полимеразы состоит из шести полипептидов, какими являются субъединицы р’ и (3 (м. м. 155 ПОО и 151 000 соответственно), двух субъединиц а м. м. 36 000 и еще двух низкомолекулярных субъединиц (8 и ю). Инициация транскрипции обеспечивается субъединицей 5 — РНК- полимеразы, которая является, по существу, фактором инициации транскрипции. Как отмечено выше, связывание РНК-полимеразы с ДНК происходит на участке, называемом промотором и содержащем старт-сигнал для синтеза РНК, и контролируется белковым фактором. У Е. coli промоторы содержат последовательность ТАТААТ (бокс Прибнау), отстоящую от сайта начала транскрипции мРНК на расстояние в шесть оснований. После присоединения к промотору РНК-полимераза раскручивает в этом участке двойную спираль ДНК, обнажая цепи, каждая из которых служит затем матрицей, на которой происходит спаривание комплементарных оснований ДНК и рибонуклеозидтрифосфатов. Как только произошло спаривание двух первых мономеров РНК-полимераза продвигается дальше, обнажая дальнейшие участки цепей ДНК и добавляя последующие мономеры РНК. Удлинение цепи РНК происходит до тех пор, пока РНК-полимераза на своем пути не встретит «стоп-сигнал» и не отделится затем как от ДНК-шаблона (матрицы), так и РНК. Напротив, в клетках эукариот (в частности, у дрожжей и человека) существуют три РНК-полимеразы (I, II, III), представляющие собой сложные молекулы, содержащие по нескольку полипептид-ных цепей. Каждая из этих РНК-полимераз, прикрепляясь к про-мотору на ДНК, обеспечивает транскрипцию разных последовательностей ДНК. РНК-полимераза I синтезирует крупные рРНК (основные молекулы РНК больших и малых субъединиц рибосом). РНК-полимераза II синтезирует все мРНК и часть малых рРНК, РНК-полимераза III синтезирует тРНК и РНК 5з-субъединиц рибосом. Количество РНК-полимераз в клетках млекопитающих различно (около 40 000 молекул РНК-полимераз I и II и около 20 000 молекул РНК- полимеразы III на клетку). Эукариотические РНК-полимеразы также характеризуются сложным строением. РНК-полимераза II многих организмов построена из 12 различных полипептидов, три из которых гомологич-ны субъединицам р’, р и а РНК-полимеразы Е. coli. РНК-полимеразы I и III обладают 5 субъединицами, сходными с субъединицами РНК-полимеразы II. РНК- полимераза II инициирует транскрипцию, причем для этого требуется белок Молекулы рРНК и тРНК также являются продуктами процессинга. Открытие интронов поставило вопрос об их происхождении. В объяснении их происхождения используют две гипотезы. В соответствии с одной гипотезой интроны были представлены уже в предковых генах, в соответствии с другой интроны были включены в гены, которые оригинально были непрерывными. Наряду с описанной схемой транскрипции у некоторых РНК-овых вирусов известна так называемая обратная транскрипция, при которой матрицей для синтеза ДЕК является РНК и которая осуществляется ферментом, получившим название обратной транскриптазы (ревертазы). Здесь реализация генетической информации идет по схеме РНК — ДНК — белок. Как свидетельствуют исследования, обратная транскриптаза найдена как у прокариотов, так и эукариотов. Считают, что ревертаза имеет очень древнее происхождение и существовала еще до разделения организмов на прокариоты и эукариоты. Трансляция является важной составной частью общего метаболизма клетки и ее сущность заключается в переводе генетической информации с мРНК, являющейся первичным продуктом действия генов, в аминокислотную последовательность белков. Трансляция происходит в цитоплазме на рибосомах и является центральным процессом в синтезе белков, в котором помимо рибосом участвуют мРНК, 3-5 молекул рРНК, 40-60 молекул разных тРНК, аминокислоты, около 20 ферментов (аминоацил- тРНК синтетаз), активирующих аминокислоты, растворимые белки, вовлекаемые в инициацию, элонгацию и терминацию полипептидной цепи. Рибосомы состоят наполовину из белка и наполовину из рРНК (по 3-5 молекул на каждую рибосому). Размеры рибосом выражают в единицах скорости седиментации при центрифугировании (S). У прокариот размеры рибосом составляют 70 S, у эукариот — 80 S. Рибосомы построены из пары субъединиц (большой и малой), которые диссоциируют по завершению трансляции мРНК. У Е. coli большая субъединица (50 S) содержит две молекулы рРНК (5 S и 23 S) и 30 полипептидов, тогда как малая субъединица (30 S) содержит одну молекулу рРНК (16 S) и 19 полипептидов. У эукариот большая субъединица содержит три разных молекулы рРНК (58, 5,8 S и 20 S), тогда как малая субъединица — одну молекулу рРНК (18 S). Транспортные (адапторные, растворимые) РНК являются малыми (5 S) молекулами длиной в 75—80 нуклеотидов. Их необходимость в трансляции определяется тем, что в отличие от ферментов, узнающих субстрат прямым образом, кодоны мРНК не способны прямо узнавать аминокислоты. Для этого должны существовать специальные адаптеры, узнающие и кодон и аминокислоту. Функцией таких адаптеров и обладает тРНК. Нуклеотиды тРНК построены из остатка фосфорной кислоты, углеводной части (рибозы) и основания. Главными нуклеотидами тРНК являются адениловый, гуаниловый, цитидиловый и уридиловый нуклеотиды. Вместе с тем одна из особенностей структуры тРНК заключается в том, что все они содержат по нескольку необычных, так называемых минорных нуклеотидов, причем последние являются химическими модификациями аденилового, гуанилового, питидилового и уридилового нуклеотидов (в основном в виде метилированных пуринов или нуклеотидов, обладающих метилированной рибозой). Некоторые из этих минорных нуклеотидов находятся в одном и том же районе у разных тРНК. В молекуле тРНК вопреки ее одноцепочечной структуре имеет место комплементарное спаривание оснований, а это ведет к определенной конформации тРНК, заключающейся в том, что четыре ее сегмента формируют свернутую структуру (вторичную), которая имеет форму клеверного листа. В свою очередь эта структура подвергается дальнейшему свертыванию, превращаясь в так называемую многоскладчатую L-образную форму. Важнейшая особенность тРНК заключается в том, что по обоим концам L-образной фигуры сохраняются неспаренные нуклеотиды. Нуклеотиды одного конца фигуры формируют антикодон, а нуклеотиды другого конца (3′-конца) образуют последовательность (ЦЦА), обеспечивающую ковалентную связь с присоединяемой свободной аминокислотой. Все тРНК характеризуются специфической последовательностью нуклеотидов. Их антикодоны комплементарны кодонам мРНК. Антикодоны располагаются в центре тРНК. Известно 55 антико-донов. Каждая тРНК способна присоединять и переносить только одну аминокислоту, но на каждую аминокислоту имеется 1-4 молекул тРНК. Первый этап трансляции происходит в цитоплазме и заключается в комбинировании каждой аминокислоты с АТФ (в образовании аденилированной аминокислоты) и специфическим ферментом аминоацил- тРНК-синтетазой В результате этого устанавливается связь между фосфатом АМФ и карбоксильной группой аминокислоты (-Р-О-С-), которая приводит к образованию комплексов, состоящих из аминокислоты, АМФ и специфического фермента. Пирофосфаты в процессе образования этих комплексов удаляются. Следует заметить, что для каждой аминокислоты существует своя синтетаза, т. е. в клетках имеется 20 разных синтетаз. Второй этап трансляции осуществляется также в цитоплазме. Поскольку аминоацил-тРНК-синтетазы специфически распознают аминокислоты и их тРНК, то второй этап состоит во взаимодействии образованных комплексов аминокислота — АМФ — специфический фермент (аминоацил-тРНК-синтетаза) со специфическими тРНК (один комплекс — одна тРНК). Поскольку на одном из концов имеется последовательность (конечное основание — аденин, а два предыдущих — цитозин и цитозин), то связывание одной аминокислоты со специфической тРНК происходит путем установления связи между рибозой конечного нуклеотида (адениловой кислотой) и карбоксильной группой аминокислоты (-С—О-С-). Вследствие этого взаимодействия происходит формирование так называемых аминоацил- тРНК, представляющих собой комплексы аминокислоты со специфической тРНК, и освобождение в процессе образования этих комплексов АМФ и фермента (аминоацил-тРНК-синтетазы). Следовательно, аминоацил-тРНК являются прямыми предшественниками полипептидного синтеза на рибосомах. (ОНС F 0D 7NH F 0 D 7CH F 0 D 7(Ch3 F 0 D 7Ch3 F 0 D 7 SCh4)CO F 0 D 7О F 0 D 7тРНК) образуется в результате формилирования а-аминогруппы метионина Nh3 F 0D 7СН (СН2 F 0D 7СН2 F 0 D 7SCh4) F 0 D 7СО F 0 D 7ОН в метионил-тРНК. Поскольку формулирование характерно только для метионина и катализируется ферментом трансформилазой, то считают, что формилметионин-тРНК является инициатором синтеза полипептида. Это означает, что все полипептиды в процессе синтеза начинаются с метионина. N-формилметионин является N- концевой аминокислотой всех белков. Инициация полипептидной цепи у кишечной палочки начинается с образования комплекса между мРНК, формилметионин-тРНК и рибосомной единицей 30 8, которое обеспечивается факторами (белками) инициации IF1, IF2 и IF3, а также ГТФ. Этот комплекс вступает в комбинацию с 50 S- рибосомной единицей, в результате чего формилметионин-тРНК становится связанной с пептидиловым сайтом. Энергия для этого обеспечивается гидролизом одной молекулы ГТФ. Кодоны АУГ, ГУА и ГУГ на 5′-конце или рядом с ним направляют включение N-формилметионина в качестве N- концевой аминокислоты белка. Можно сказать, что эти кодоны являются специфическими инициаторами белкового синтеза. Наиболее активным является кодон АУГ. Элонгация (удлинение) полипептидной цепи обеспечивается белковыми факторами элонгации ef-TS и EF-Tu, а также гидролизом одной молекулы ГТФ, а движение молекулы мРНК с одного сайта рибосомы на другой обеспечивается фактором элонгации EF-G и гидролизом одной молекулы ГТФ. Каждый раз мРНК движется на три нуклеотида. У бактерий частота элонгации составляет 16 аминокислот в секунду. Это означает, что рибосомы двигаются вдоль мРНК со скоростью 48 нуклеотидов в секунду. Терминация (окончание) синтеза детерминируется стоп-кодо-нами УАГ, УАА и УГА. Когда один из этих кодонов подойдет к А-сайту рибосомы, то полипептид, тРНК в Р-сайте и мРНК освобождаются, а рибосомные субъединицы диссоциируют. Окончание синтеза белка связано с активностью белковых факторов освобождения — RF-1 и RF-2. Диссоциировав, рибосомные субъединицы начинают трансляцию другой молекулы мРНК. Большинство мРНК симультанно транслируется несколькими рибосомами (полисомами). Например, цепь гемоглобина из 150 аминокислот синтезируется на пентарибосомном комплексе. У прокариот синтез и трансляция мРНК происходят в направлении от 5′-конца к 3′-концу. Далее, у них нет ядерной мембраны. Поэтому трансляция мРНК начинается еще до завершения ее синтеза. Напротив, у эукариот транскрипция и трансляция разделены во времени, поскольку требуется время для перехода мРНК из ядра через ядерную мембрану в цитоплазму. Синтез белков является исключительно точным механизмом. Обобщенные результаты исследований частоты ошибок в белковом синтезе показывают, что одна ошибка, т. е. одно включение «неправильной» аминокислоты, происходит лишь на каждые 10 000 включенных аминокислот. Точность механизма белкового синтеза обеспечивается точностью связывания аминокислот со своими тРНК и точностью спаривания кодонов мРНК с антикодонами тРНК. МИТОХОНДРИАЛЬНЫЙ И ХЛОРОПЛАСТНЫЙ ГЕНЕТИЧЕСКИЕ КОДЫ Помимо генетического кода, который содержится в ядерной ДНК, существует генетический код, содержащийся в ДНК митохондрий животных и человека, а также в ДНК хлоропластов растений. В митохондриях и хлоропластах помимо ДНК существуют и другие структуры, которые в совокупности с ДНК образуют самостоятельный аппарат синтеза белков. Размеры митохондриальных рибосом очень варьируют. В частности, размеры митохондриальных рибосом человека составляют 60 S. Для митохондриального генетического кода характерны те же структуры и свойства и те же механизмы транскрипции и трансляции, что и в случае ядерного генетического кода. Однако известны и отличия. В митохондриальной ДНК все нуклеотиды входят в состав кодонов, кодирующих либо белки, либо рРНК и тРНК. Для трансляции используется только 22 тРНК (в отличие от 31 тРНК в ядерном коде и 30 тРНК в хлоропластном коде), причем отдельные молекулы тРНК могут узнавать любое основание, находящееся в кодоне в третьем положении. Митохондриальная ДНК человека и других млекопитающих содержит 64 кодона, из которых 4 являются стоп-кодонами. Известно содержание антикодонов всех 22 тРНК Каждый антикодон в случае митохондриального генетического кода способен спариваться с несколькими кодонами мРНК. Например, антикодон УАГ спаривается с кодонами ЦУУ, ЦУЦ, ЦУА и ЦУТ, кодирующими лейцин. 22 антикодона тРНК спариваются с 60 кодонами иРНК. Установлено, что митохондриальные тРНК подвержены «редактированию» (модификации транспорта тРНК) путем полиаденилирования, в результате чего создаются антикодоны терминации. Генетический код ДНК и белоксинтезирующий аппарат хлоропластов несколько отличны от кода и белоксинтезирующего аппарата митохондрий. Прежде всего хлоропластный код кодирует намного больше белков по сравнению с митохондриальным кодом. Рибосомы хлоро-палстов сходны с рибосомами кишечной палочки, а синтез полипептидной цепи начинается с N-формилметионина (как и у бактерий). УНИВЕРСАЛЬНОСТЬ И ПРОИСХОЖДЕНИЕ ГЕНЕТИЧЕСКОГО КОДА Генетический код ядерной ДНК универсален, т. к. он одинаков у всех живых существ, т. е. у всех живых существ используются одинаковые наборы кодонов. Признание универсального характера генетического кода является выдающимся современным доказательством единства происхождения органических форм (см. главы XIV, XV и XVI). С тех пор как были определены основные черты структуры генетического кода, стали формулировать также гипотезы относительно его эволюции, причем к настоящему времени известно несколько таких гипотез. Сведения о регуляторных механизмах экспрессии генов по большей части получены в результате изучения образцов контроля активности генов, распространяемых на последовательность реакции в биосинтезе микроорганизмами белков, на гены фага лямбда, 5 S-гены Xenopus, гены, обеспечивающие скрещивание дрожжей, и гены, вовлеченные в контроль развития эукариотов. Сравнение механизмов, контролирующих действие генов у разных организмов, показывают чрезвычайное разнообразие в этих механизмах. В этом убеждает рассмотрение наиболее изученных систем. В применении к бактериям известно два механизма, один из которых контролирует активность ферментов, тогда как второй — синтез ферментов (синтез специфических белков). Сущность контроля (регуляции) активности ферментов иллюстрируется примером биосинтеза изолейцина, ранним предшественником которого является треонин и превращение которого в изолейцин осуществляется в результате пяти последовательных реакций с участием ферментов. Если к культуре бактерий, обладающих самостоятельной способностью синтезировать аминокислоты, в том числе изолейцин, прибавить изолейцин, то это приводит к прекращению клетками синтеза данной аминокислоты. Ростовые потребности клеток в это время обеспечиваются лишь экзогенным изолейцином. Механизм этого явления заключается в ингибировании (подавлении) активности фермента, катализирующего превращение треонина в последующий предшественник изолейцина. Синтез восстанавливается лишь тогда, когда экзогенный изолейцин истощается в среде. Уникальность этого явления связана с тем, что ингибитор (конечный продукт) и нормальный субстрат имеют различную структуру и не конкурируют за один и тот же сайт связывания на ферменте. Можно сказать, что фермент несет два сайта связывания, один из которых специфичен для субстрата, другой — для ингибитора. Нормально субстрат прикрепляется к активному сайту фермента. Однако если к этому специфическому сайту прикрепляется ингибитор, то наступает структурное превращение (транзиция) в ферменте, вследствие чего нормальный субстрат больше не прикрепляется, что блокирует активность фермента, катализирующего конец биосинтеза либо одну из его стадий. Это явление получило название аллостерической транзиции В основе аллостерического взаимодействия лежит любое измерение в активности фермента, вызываемое избирательным связыванием на втором сайте фермента, причем этот сайт не перекрывает сайта на ферменте для связывания субстрата. Фермент, по существу, становится химическим трансдуктором, позволяющим взаимодействие между двумя молекулами — ингибитором и субстратом, которое другим способом исключено. Определенные ферменты чувствительны к активированию при соединении их с эф- фекторной молекулой, отличной от каталитического субстрата. Кроме того, определенные ферменты чувствительны к активированию одним метаболитом и подавлению другим. Поскольку возможны мутации, которые могут поражать один ингибиторный сайт, не затрагивая другого, фенотипически они проявляются в резистентности клеток к ингибированию конечным продуктом и в выработке ими больших количеств конечного продукта. Таким образом, аллостерическая транзиция обеспечивает исключительно гибкую систему регуляции активности ферментов Синтез ферментов регулируется с помощью индукции и репрессии ферментов, заключающихся в стимуляции или подавлении синтеза специфических ферментов как ответной реакции на добавление в среду компонента, повышающего концентрацию эффектора в клетке. Примером индукции ферментов является случай с ферментами бактерий, обеспечивающих утилизацию лактозы. Бактерии приобретают способность сбраживать лактозу после некоторого культивирования в присутствии этого углевода. Это определяется синтезом ими F 06 2- галактозидазы, которая расщепляет лактозу на глюкозу и галактозу, а также F 0 6 2-галактозидпермеазы и F 0 6 2-галактозидтранс-цетилазы, обеспечивающих проникновение субстрата в клетку и ацетилирование некоторых токсических галактозидов в направлении их детоксификации (соответственно). Следовательно, лактоза индуцирует синтез ферментов, причем этот синтез является координированным . Примером репрессии ферментов может служить синтез трипто-фана, который образуется из антраниловой кислоты с участием ант- ранилатсинтетазы. Если бактерии посеять в среду, в которой в качестве источника азота и углерода содержатся Nh5Cl и глюкоза, соответственно, то они очень хорошо растут и самостоятельно синтезируют триптофан (как и другие аминокислоты). Но если в среду добавить экзогенный триптофан, то бактерии перестают синтезировать эту аминокислоту. Важно заметить, что добавление триптофана останавливает синтез всех ферментов, участвующих в его биосинтезе. Таким образом, конечный продукт подавляет весь биосинтез. Опираясь на данные об индукции и репрессии белков, французские ученые Ф. Жакоб и Ж. Моно (1961) сформулировали модель генетического контроля синтеза белков, компонентами которой являются гены структуры, регуляции и операторные гены, а также цитоплазматический репрессор. По этой модели молекулярная структура белков определяется генами структуры, первичным продуктом которых является мРНК. Синтез мРНК может быть начат лишь на определенном пункте цепи ДНК (операторе), от которого может зависеть и транскрипция нескольких сцепленных структурных генов. Группа генов, транскрипционная активность которых координируется одиночным оператором, представляет собой опе-рон, являющийся единицей первичной транскрипции и единицей координированной экспрессии генов. Таким образом, бактериальные опероны транскрибируются в полицистронные мРНК. Существуют также гены-регуляторы. Под контролем того или иного гена-регулятора продуцируется цитоплазматический фактор- репрессор, который обладает реверсивной способностью связываться со специфическим оператором. Благодаря этому связыванию комбинация репрессора и оператора блокирует начало транскрипции всего оперона (формирование мРНК), контролируемой оператором и, следовательно, предотвращает синтез белков, управляемый структурными генами, Образующийся продукт (хоризмат) с помощью ферментов превращается в триптофан. Экспрессия этого оперона находится под негативным контролем репрессора, являющегося продуктом гена trp R. Репрессия конечным продуктом (трип-тофаном) заключается в том, что неактивный в свободном состоянии репрессор не мешает переходу РНК-полимеразы к промотору, т. е. не мешает транскрипции мРНК. Репрессор становится активным в результате связывания с конечным продуктом (триптофаном). Когда комплекс репрессор + триптофан связывает оператор, то это предупреждает преход РНК- полимеразы к промоторам, т. е. подавляет синтез мРНК. Более тонкий механизм заключается в том, что продукт гена trp R (репрессор) ингибирует синтез одной из ДАГФ-синтетаз, в частности, синтетазу АгоН, путем ингибирования ее мРНК, а следовательно, ингибирует и мРНК всего гистидинового оперона. То, что существуют различные пути регуляции генов, подтверждается данными о регуляции оперона ara BAD, который ответственен за метаболизм арабинозы, встречающейся обычно в стенках клеток растений, а у микроорганизмов — являющейся одним из источников углерода и энергии. Арабиноза попадает в организм животных или человека с растительной пищей, где она метаболи-зируется микроорганизмами. Однако прежде она должна поступить в бактерии. Это поступление арабинозы в бактериальные клетки, т. е. транспорт арабинозы обеспечивается двумя независимыми системами, представляющими собой продукты генов ara Е и ara FG Система ara Е обладает низким родством к арабинозе, поэтому она используется лишь при очень высоких концентрациях этого углевода, тогда как система ara FG, обладающая высоким родством к арабинозе, используется при очень низких концентрациях углевода (порядка 10-7 М). Гены, кодирующие ферменты, которые необходимы для катаболизма арабинозы. Катаболизм арабинозы начинается с того, что она вначале конвертируется синтезируемая под контролем гена ara А арабинозной изомеразой в L-рибулозу. Затем рибулоза фосфорилируется рибулозокиназой, являющейся продуктом гена ara В в L-рибулозу-б-фосфат. В свою очередь рибулозо-фосфат конвертируется в П-ксилозу-б-фосфат с помощью рибулозо- фосфатэпимеразы, являющейся продуктом гена ara D. Важно отметить, что гены транспортной системы, а также дополнительный арабинозоиндуцируемый ген и гены метаболизма арабинозы локализованы в разных районах хромосомной карты Е. coil. Все эти наборы генов регулируются позитивно арабинозой. Репрессия метаболических и транспортных генов в ага-опероне осуществляется продуктом (белком) гена ara С. Этот белок является позитивным регулятором. В то же время белок гена ага С может и репрессировать экспрессию этих генов. Таким образом, этот белок существует в двух состояниях — индуцирующем и репрессирующем, индуцируя или репрессируя инициацию транскрипции (начало синтеза мРНК) арабинозного оперона. Индуцирующим свойством белок ага С обладает в присутствии арабинозы, позитивно действуя на один сайт, репрессирующим — в отсутствие этого углевода, действуя негативно на другой сайт. Индукция арабинозного оперона происходит в присутствии цАМФ и белка CRP, являющегося рецептором для цАМФ. Главная роль этого белка заключается в позволении индукции арабинозного оперона только в отсутствие глюкозы. Это получило название катаболитной репрессии. Опероноподобная организация генетического контроля действия генов показана у фага лямбда, вируса иммунодефицита человека и многих других микроорганизмов. Считают, что в геноме эукариотических клеток содержится 10 000-50 000 генов-регуляторов. Регулирующие белки, синтезируемые под контролем этих генов, связываются со специфическими последовательностями ДНК вблизи регулируемых генов. Для некоторых организмов — эукариотов (например, дрожжей) также характерна опероновая организация функционально связанных генов. Рассмотрение вопроса о регуляции действия генов у организмов на более высокой ступени эволюционной лестницы показывает, что здесь отмечается еще большее усложнение и разнообразие в контроле. Изучение генов, контролирующих синтез 5S-PHK у южноафриканской жабы Xenopus показало, что в овоцитах гены, кодирующие 5S-PHK, экспрессируются лишь в период развития овоци-тов, тогда как ядерные гены соматических клеток, кодирующие синтез 5S-PHK, экспрессируются как в овоцитах, так и в клетках эмбрионов. Установлено также, что синтез 5S-PHK стимулируется белковыми факторами TFA, TFB и TFC. Два последних фактора используются также в транскрипции других генов. В случае большинства эукариотов считают, что у них нет опе- роноподобной организации генетического контроля действия генов, т. е. эукариотические гены регулируются индивидуально, транс-крибируясь в моноцистронные мРНК, либо эукариотические гены регулируются частично полицистронно, частично моноцистронно. В пользу второго предположения свидетельствуют данные об обнаружении у нематоды С. elegans генов, организованных в опероны. У организма этого вида процессинг полицистронной мРНК в моно-цистронную мРНК происходит до трансляции. Считают, что генетический контроль синтеза белков у прокари-отов и у эукариотов осуществляется как на уровне транскрипции (частота синтеза мРНК, процессинг мРНК, транспорт мРНК из ядра, стабильность мРНК), так и на уровне трансляции (частота трансляций, регуляции синтеза белковых факторов, ответственных за инициацию, элонгацию и терминацию полипептидной цепи). Считают также, что у эукариотов в генетической регуляции имеет значение структура хроматина, которая блокирует доступ специфических активирующих белков (активаторов) к промоторам. В клетках эукариотов установлен специфический комплекс, который обеспечивает АТФ-зависимое разрушение нуклеосом, позволяя при этом активаторам связываться с нуклеосомным стержнем, что ведет к транскрипции. С другой стороны, установлено, что синтез некоторых ферментов интенсифицируется под влиянием стероид-ных гормонов. Контроль может осуществляться и после трансляции (контроль протеолиза).
«Генетика», 2018 г., № 2
Аннотации статей. Том 54, 2018 г., № 2
САРКОГЛИКАНОПАТИИ: КЛИНИКО-МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА, ЭПИДЕМИОЛОГИЯ, ДИАГНОСТИКА И ВОЗМОЖНОСТИ ТЕРАПИИ
М.В. Булах*, О.П. Рыжкова, А.В. Поляков**
Медико-генетический научный центр, Москва 115478; e-mail: * [email protected] , ** [email protected]
В настоящем обзоре кратко рассмотрены основные аспекты саркогликанопатий – группы аутосомно-рецессивных поясно-конечностных мышечных дистрофий (ПКМД), вызываемых мутациями в генах SGCA (ПКМД 2D, MIM 600119), SGCB (ПКМД 2Е, MIM 604286), SGCG (ПКМД 2С, MIM 353700) и SGCD (ПКМД 2F, MIM 601287). Перечисленные гены кодируют трансмембранные белки саркогликаны, участвующие в формировании дистрофин-дистрогликанового комплекса сарколеммы мышечных клеток. Клиническая картина саркогликанопатий сходна с таковой при мышечной дистрофии Дюшенна/Беккера и некоторых других аутосомно-рецессивных формах ПКМД, чем и продиктована актуальность изучения этой группы заболеваний. Помимо клинического описания, спектра мутаций, этиологии и диагностических подходов в настоящем обзоре сделан упор на фундаментальные механизмы патогенеза саркогликанопатий, которые помогут понять открывающиеся перспективы терапии мышечных дистрофий как группы в целом, так и саркогликанопатий в частности.
DOI: 10.7868/S0016675818020054
ГЕНЕТИЧЕСКИЕ РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ ЭВОЛЮЦИИ И ЭМБРИОГЕНЕЗА В «КРИВОМ ЗЕРКАЛЕ» КАНЦЕРОГЕНЕЗА
И.В. Алексеенко*, Т.В. Виноградова, Е.Д. Свердлов
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук, Москва 117997; e-mail: [email protected]
В обзоре предпринимается попытка обсудить взаимосвязь регуляторных генетических механизмов трех фундаментальных процессов биологии: развития, эволюции и рака. Рассмотрены проблема эволюционной неизбежности возникновения рака, эволюционно выработанные системы защиты организма от опухолей, а также общие системы регуляции, используемые при эволюции, развитии и раке.
DOI: 10.7868/S0016675818020029
ОСОБЕННОСТИ МУТАЦИОННОГО ПРОЦЕССА В Х-ХРОМОСОМЕ ЛИНИИ Z3314Drosophila melanogaster ИЗ ПРИРОДНОЙ ПОПУЛЯЦИИ ЗВЕНИГОРОДКА (УКРАИНА)
Ю.А. Коромыслов1, Ю.Ю. Илинский1,2,3, А.В. Иванников1, И.К. Захаров1,2*
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского
отделения Российской академии наук, Новосибирск 630090; e-mail: [email protected]
2 Новосибирский национальный исследовательский государственный университет, Новосибирск 630090
3 Институт живых систем Балтийского федерального университета им. И. Канта, Калининград, 236041
Выделенная из природной популяции Звенигородка (Украина) линия Z3314Drosophila melanogaster характеризуется проявлением и возникновением широкого спектра морфологических аберраций. Среди них наиболее представленными были два типа – аномалия жилкования крыльев и нарушение сегментации ног. Показано, что с ростом температуры развития частота проявления (пенетрантность) и экспрессивность этих фенотипических аберраций увеличиваются. При разведении линии Z3314 в лаборатории была обнаружена (выделена и идентифицирована) аутосомная видимая мутация rase (ra: 3 – 97.3), которая приводит к редукции части дорзоцентральных и скутеллярных макрохет. При исследовании мутационного процесса в линии Z3314 был обнаружен ряд генетических особенностей, которые и определили последовательность и перспективы исследования. Линия Z3314 характеризуется высокой частотой возникновения видимых мутаций в X-Z3314-xpoмосомe, которые сохранялись на протяжении длительного времени разведения в лабораторных условиях (с 2003 по 2011 г.). Локус-специфичная высокая генетическая нестабильность в локусе singed в X-Z3314-хромосоме сохранялась с момента возникновения первых мутантных аллелей в 2006 г. до окончания исследования. Возникновение мутаций наблюдалось как при ведении линии «в себе» – при братско-сестринских скрещиваниях, так и после скрещиваний самцов-носителей Х-Z3314-хромосомы с самками лабораторной линии со сцепленными Х-хромосомами C(1)DX,ywf/Y.
DOI: 10.7868/S001667581802011X
АНАЛИЗ РАСПРОСТРАНЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА Triticum timopheevii Zhuk. В СОРТАХ МЯГКОЙ ПШЕНИЦЫ (Triticum aestivum L.)
С.П. Мартынов1,*, Т.В. Добротворская1, В.А. Крупнов2
1 Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова, Санкт-Петербург
190000; e-mail: [email protected]
2 Научно-исследовательский институт сельского хозяйства Юго-Востока, Саратов 410010
Проведено сканирование базы данных мирового генофонда пшеницы по родословным и установлено участие генетического материала от Т. timopheevii в создании 3088 сортов мягкой пшеницы. Исследована пространственная и временная динамика распространения этих сортов. С помощью анализа родословных изучено разнообразие доноров генетического материала Т. timopheevii. Установлена специфичность доноров Т. timopheevii для регионов селекции пшеницы. Основным источником генов устойчивости для большинства сортов является образец D-357-1 из грузинского сорта-популяции Зандури. Это существенно снижает разнообразие генетического материала Т. timopheevii, использованного в селекции. У 369 сортов и 184 линий были идентифицированы гены устойчивости к патогенам от Т. timopheevii. Гены Т. timopheevii распространены преимущественно в озимых сортах, а также яровых, высеваемых осенью. Ценность доноров как источников генов Т. timopheevii неоднозначна, несмотря на то, что большинство из них происходит от одного и того же образца D-357-1. Ген Sr36 наиболее часто встречается в США, Западной Европе и Австралии и передан от линии Wisconsin-245 через Arthur или ТР-114-1965а. Ген Pm6 распространен в Западной Европе, передан от пребридинговой линии Wisconsin 245/5*Cappelle-Desprez//Hybrid-46/Cappelle Desprez. Ген Lr18 чаще встречается в США, был передан сортами Blueboy или Vogel 5 от линии Coker-55-9. Крайне ограниченный набор генов устойчивости к патогенам от Т. timopheevii, используемых в коммерческих сортах, и специфика их географического распространения, возможно, связаны с уникальностью G-субгенома и плазмона у этого вида, низким потенциалом его пластичности, толерантности к засухе. Кроме того, несовершенство методов пребридинга и рекомбинационной селекции препятствует устранению в транслокации тесного сцепления целевых генов с нежелательными.
DOI: 10.7868/S0016675818020121
ГЕНЕТИЧЕСКОЕ РАЗНООБРАЗИЕ КУЛЬТУРНОЙ ЯБЛОНИ, ВОЗДЕЛЫВАЕМОЙ В КАЗАХСТАНЕ
М.Е. Омашева, А.С. Пожарский, Б.Б. Смайлов*, Н.А. Рябушкина, Н.Н. Галиакпаров
Институт биологии и биотехнологии растений, Алматы 050040, Казахстан; e-mail: [email protected]
Идентификация сортов является первоочередным требованием для характеристики генофонда в сельскохозяйственном производстве и осуществления селекционных программ. В настоящей работе набор из шести SSR-маркеров был использован для идентификации на молекулярной основе собранного в различных садоводческих хозяйствах Казахстана сортового материала яблонь: 31 сорт казахстанской селекции, 40 зарубежных сортов, а также 16 сорт-клонов Джангалиева, отобранных в популяциях дикой яблони. Ожидаемая (He) и наблюдаемая (Ho) гетерозиготность по группам всех анализированных образцов была высокой: от 0.67 до 0.89 и от 0.29 до 0.90 соответственно. Кластерный анализ, анализ генетических расстояний (STRUCTURE, UPGMA) показал распределение всех образцов по четырем группам при наличии ряда небольших подгрупп, что обусловлено многообразием происхождения. В первой группе оказались казахстанские сорта с Ренетом Бурхардта в родословной, вторая группа — сорта с Апортом в родословной, третья группа представлена подкластерами с преимуществом зарубежных сортов, четвертая — сорт-клоны и казахстанские сорта с участием в их родословной дикой яблони. Генотипирование позволило выявить отдельные несоответствия образцов (и/или родословной) заявляемым названиям. Генотипирование по маркерам генов Md-ACS1 и Md-ACO1, определяющих уровень этилена в плодах, что коррелирует по литературным данным с их твердостью и лежкостью, не выявило в казахстанских сортах гомозигот по ACS1-2/2, связанных с наибольшей выраженностью данных характеристик. Четверть казахстанских сортов и около половины зарубежных сортов были гетерозиготны по ACS1, что может указывать на промежуточную твердость и относительно продолжительный период хранения плодов. В двух казахстанских и двух зарубежных сортах, гетерозиготных по гену ACS1, возможно улучшение этих показателей за счет гомозиготы по АС01-1/1.
DOI: 10.7868/S0016675818020133
ISSR-АНАЛИЗ ИЗМЕНЧИВОСТИ КУЛЬТИВИРУЕМЫХ ФОРМ И СОРТОВ ГРАНАТА (Punica granatum L.) АЗЕРБАЙДЖАНА
С.В. Гаджиева*, 3.И. Акпаров, Н.А. Гасанов, 3.П. Мустафаева, Э.С. Гаджиев, А.Т. Мамедов, В.И. Иззатуллаева, С.М. Бабаева, С.С. Шарифова, А.М. Мамедов, М.А. Аббасов
Институт генетических ресурсов Национальной академии наук Азербайджана, Баку 1106, Азербайджан; e-mail; [email protected]
Впервые проведен анализ генетического разнообразия сортов и форм граната, произрастающих в Азербайджане, с использованием 14 ISSR-праймеров. Было идентифицировано 102 ПЦР-фрагмента, из них 80 оказались полиморфными. Среди изученной коллекции граната был выявлен высокий уровень полиморфизма (75.5%). В результате анализа полученных данных и на основе значений параметров PIC, EMR, MI, RP, MRp, определяющих меру информативности маркеров, все 14 ISSR-апробированных праймеров оказались эффективными для генотипирования образцов граната, а наиболее эффективно работающими оказались UBC808, UBC811, UBC834 и UBC840. Кластерный анализ позволил сгруппировать изученные образцы в 16 основных групп. Индекс генетического сходства варьировал от 0.032 до 0.94.
DOI: 10.7868/S0016675818020078
ЦИТОГЕНЕТИЧЕСКИЙ АНАЛИЗ МАЛЯРИЙНЫХ КОМАРОВ КАЛИНИНГРАДСКОЙ ОБЛАСТИ
В.П. Перевозкин1,2,*, С.С. Бондарчук1, А.В. Кормилицин1
1 Томский государственный педагогический университет, кафедра общей биологии и
методики обучения биологии, Томск 634061; e-mail: [email protected]
2 Томский государственный университет, Томск 634050
Проведен цитогенетический анализ малярийных комаров г. Калининграда и его окрестностей. Идентифицированы два биотопически специализированных вида Anopheles – An. messeae и An. maculipennis. Для An. messeae установлен относительно невысокий уровень инверсионного полиморфизма по половой хромосоме и правому плечу аутосомы 3R, что вполне закономерно для северо-западных периферийных популяций ареала вида.
DOI: 10.7868/S0016675818020145
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ СИБИРСКОГО ОСЕТРА Acipenser baerii Brandt, 1869 В АКВАКУЛЬТУРЕ
А.Е. Барминцева1,2,*, Н.С. Мюге1,2,**
1 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии,
Москва 107140
2 Институт биологии развития им. Н.К. Кольцова Российской академии наук, Москва 119334
e-mail: * [email protected] , ** [email protected]
Представлены результаты исследования генетического полиморфизма аквакультурных стад сибирского осетра различного происхождения из 13 хозяйств по всей территории Российской Федерации по пяти тетраплоидным микросателлитным локусам и контрольному региону митохондриальной ДНК. В аквакультуре сибирского осетра ленского и обского происхождения на сегодняшний день произошло резкое падение гаплотипического разнообразия. Основная масса аквакультурных особей несет два мажорных гаплотипа, характерных для европейской части России («ленская» аквакультура), и два гаплотипа, свойственных западной части Сибири («обская» аквакультура). По результатам микросателлитного анализа в аквакультуре осетра ленского происхождения выделяются два генетических кластера, один из которых представлен стадами, вследствие имбредности поголовья характеризующимися падением аллельного разнообразия и исчезновением редких аллелей.
DOI: 10.7868/S0016675818020030
ПОИСК СЛЕДОВ ЕСТЕСТВЕННОГО ОТБОРА МЕЖДУ ПОПУЛЯЦИЯМИ ЧЕРНОГО САДОВОГО МУРАВЬЯ Lasius niger ИЗ УРБАНИЗИРОВАННЫХ И ПРИРОДНЫХ БИОТОПОВ
Е.А. Коноров1,2
1 Московский государственный университет им. М.В. Ломоносова, кафедра биологической
эволюции, Москва 119234; e-mail: [email protected]
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук, Москва 119991
Представлены результаты полногеномного сравнения популяций Lasius niger из г. Москвы и с лугов Московской области. Были получены смешанные образцы отдельно для городских и природных популяций, их полный геном был прочитан с помощью Illumina HiSeq. Подсчет частот однонуклеотидных полиморфизмов в популяциях, а также индекс фиксации Fst и D Таджимы проводился с помощью программ PoPoolation и PoPoolation2. В итоге выявлено 64 гена, частоты аллелей которых значимо отличаются у особей из городских и природных популяций, часть из них находится под воздействием положительного или диверсифицирующего отбора. При этом 26 из 64 генов являются генами, кодирующими белки ретротранспозонов. Среди генов, отличающихся по спектру аллелей у особей двух популяций (городская и природная), есть гены, вовлекаемые в иммунный ответ на вирусные и грибковые инфекции, синтазы жирных кислот, элементы сигнального пути Hippo/Fat. Часть генов ретротранспозонов также может находиться под действием отбора. Примечательно, что по частотам аллелей отличаются репрессоры и ингибиторы РНК-полимеразы II, от активности которой зависит мобильность транспозонов.
DOI: 10.7868/S0016675818020108
ЭТНИЧЕСКИЕ ОСОБЕННОСТИ ФОРМИРОВАНИЯ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
М.А. Бермишева1,*, Н.В. Богданова2, И.Р. Гилязова1, Г.Ф. Зиннатуллина3, 3.И. Бисултанова4, Э.К. Хуснутдинова1,5
1 Институт биохимии и генетики Уфимского научного центра Российской академии наук,
Уфа 450054; e-mail: [email protected]
2 Высшая медицинская школа, Ганновер D-30625, Германия
3 Республиканский клинический онкологический диспансер, Уфа 450000
4 Чеченский государственный университет, кафедра клеточной биологии, морфологии и микробиологии,
Грозный 364093
5 Башкирский государственный университет, кафедра генетики и фундаментальной медицины, Уфа 450076
Представлены результаты скрининга мутаций генов BRCA1, BRCA2, АTМ, NBN, СНЕК2, PALB2 и BLM у пациенток с раком молочной железы (РМЖ) из Республики Башкортостан (РБ). В целом только 7.5% случаев РМЖ можно объяснить наличием одной из изученных мутаций. Для женщин славянского происхождения характерен наиболее широкий спектр выявленных изменений, который представлен мутациями c.5266dupC, c.181T>G и c.4034delA в гене BRCA1, c.5932G>T в гене АTМ, c.657_661del5 в гене NBN, c.444+lG>A, c.1100delC, dele9,10(5kb) в гене СНЕК2; c.509_510delGA и c.l72_175delTTGT в гене PALB2 и с.1642С>Т в гене BLM.
DOI: 10.7868/S0016675818020042
ПОЛИМОРФИЗМ ГЕНОВ ТЕРМОРЕЦЕПТОРОВ TRPV1 И TRPA1 ЧЕЛОВЕКА В ПОПУЛЯЦИЯХ АЛТАЕ-САЯНСКОГО РЕГИОНА И ДАЛЬНЕГО ВОСТОКА
М.А. Губина1,*, П.С. Орлов1, В.Н. Бабенко1, А.П. Забияко2, Д.Е. Иванощук1, М.И. Воевода1,3
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского
отделения Российской академии наук, Новосибирск 630090; e-mail: [email protected]
2 Амурский государственный университет, Благовещенск 675027
3 Научно-исследовательский институт терапии и профилактической медицины Сибирского отделения Российской
академии медицинских наук, Новосибирск 630099
Проведено генотипирование генов терморецепторов TRPV1 и TRPA1 в популяциях Алтае-Саянского региона и Дальнего Востока. Выборку для исследования составили 15 популяций общей численностью 1482 человека. При исследовании rs222747 гена TRPV1 было выявлено, что наиболее близкими по частоте M315I к популяциям Восточной Азии были только нанайцы и коряки (56 и 64% соответственно). Сибирские татары, якуты, эвенки наиболее близки к европеоидам. Все популяции Алтае-Саянского региона по частоте M315I заняли промежуточное положение между европеоидами и восточными монголоидами. Отклонений от распределения Харди–Вайнберга не обнаружено. В восьми популяциях наблюдаемая гетерозиготность была выше ожидаемой. При исследовании гена терморецептора TRPA1 rsl3268757 было выявлено, что популяции чукчей, юкагиров, коряков, тувинцев, южных алтайцев и теленгитов по частоте замены R3C наиболее близки к популяциям Восточной Азии (3–7%), а популяции сибирских татар, нанайцев, эвенков, якутов, шорцев, хакасов и казахов по частоте данного полиморфизма занимают промежуточное положение между европеоидами (18–23%) и монголоидами Восточной Азии (3–7%). Отклонение от распределения Харди–Вайнберга выявлено только в популяции юкагиров. В девяти популяциях наблюдаемая гетерозиготность была выше ожидаемой. Проведена трансассоциация вариантов генов TRPAl и. TRPV1 с помощью метода регрессионного анализа в 14 популяциях. Определены отрицательная корреляция –0.545, число степеней свободы d.f. = 13, оценка достоверности P-value – 0.048. Полученные нами данные свидетельствуют, что изученные варианты полиморфизма скоррелированы; это подтверждает ранее полученный вывод о том, что присутствие TRPA1 ингибирует функции TRPV1. Результаты, возможно, свидетельствуют о коэволюции исследованных генов.
DOI: 10.7868/S001667581802008X
ИСПОЛЬЗОВАНИЕ ГЕНОТИПОВ РАСПРОСТРАНЕННЫХ ВАРИАНТОВ ДЛЯ ПОЛНОГЕНОМНОГО РЕГИОНАЛЬНОГО АНАЛИЗА АССОЦИАЦИЙ
А.В. Кириченко1, И.В. Зоркольцева1, Н.М. Белоногова1, Т.И. Аксенович1,2,*
1 Федеральный исследовательский центр, Институт цитологии и генетики Сибирского
отделения Российской академии наук, Новосибирск 630090; e-mail: [email protected]
2 Новосибирский государственный университет, кафедра цитологии и генетики, Новосибирск 630090
Региональный анализ ассоциаций является новым статистическим методом, который одновременно рассматривает все варианты в выбранном регионе генома. Этот метод был создан для анализа редких генетических вариантов, генотипы которых определяются путем секвенирования экзома или генома. Регионом, как правило, считается ген. Было также предложено использовать региональный анализ для тестирования ассоциации между сложным признаком и набором распространенных вариантов, генотипированных с помощью панелей, разработанных для полногеномного анализа ассоциаций. В этом случае в качестве региона обычно рассматривают перекрывающиеся участки генома (скользящие окна). Поскольку размер регионов может быть достаточно большим, возникает риск завышения (инфляции) тестовой статистики и увеличения ошибки I рода. В данной работе изучено влияние размера региона на величину ошибки I рода при различных коэффициентах наследуемости признака. Результаты генетико-стохастического эксперимента показали, что лимитирующим фактором является физический размер региона, а не число генетических вариантов в нем. Чем выше коэффициент наследуемости признака, тем больше ошибка I рода отличается от декларируемого значения. Анализ большого числа реальных признаков подтвердил эти выводы. Полученные результаты необходимо учитывать при интерпретации результатов регионального анализа ассоциаций, проведенного на больших регионах с использованием распространенных генетических вариантов.
DOI: 10.7868/S0016675818010071
ВЛИЯНИЕ СТРЕСС-СВЯЗАННЫХ ГОРМОНОВ НА СТРЕССОУСТОЙЧИВОСТЬ Drosophila melanogaster С МУТАЦИЕЙ ГЕНА ИНСУЛИНОПОДОБНОГО БЕЛКА DILP6
Е.В. Бурдина*, Н.В. Адоньева, Н.Е. Грунтенко, И.Ю. Раушенбах
Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск 630090; e-mail: [email protected]
Исследована устойчивость к тепловому стрессу самок Drosophila melanogaster, несущих гипоморфную мутацию гена инсулиноподобного белка DILP6 (dilp641), при изменении уровня стресс-связанных гормонов (ювенильного и октопамина). Обнаружено, что мутация dilp641 вызывает снижение устойчивости к тепловому стрессу половозрелых самок D. melanogaster. Показано, что экспериментальное снижение уровня ювенильного гормона восстанавливает стрессоустойчивость мутантных самок до уровня этого параметра у самок дикого типа Canton S. Полученные данные позволяют предположить, что влияние мутации dilp641 на стрессоустойчивость самок обусловлено повышенным уровнем ювенильного гормона. Экспериментальное повышение уровня октопамина, вызывающее повышение уровня ювенильного гормона, подтвердило это предположение: устойчивость к тепловому стрессу снижается у самок обеих линий, причем у мутантных самок это снижение более выражено, чем у самок контрольной линии. Таким образом, впервые установлено, что влияние гипоморфной мутации гена dilp6 на устойчивость самок D. melanogaster к тепловому стрессу опосредуется ювенильным гормоном.
DOI: 10.7868/S0016675818020066
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ГЕНЕТИЧЕСКОЙ ИЗМЕНЧИВОСТИ И ДИФФЕРЕНЦИАЦИИ Panax vietnamensis На et Grushv. И Р. ginseng C.A. Meyer С ИСПОЛЬЗОВАНИЕМ ISSR МАРКЕРОВ
E.А. Васюткина1,*, И.Ю. Адрианова1, Г.Д. Реунова1, Т.Ф.Ч. Нгуэн2, Ю.Н. Журавлёв1
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии Дальневосточного
отделения Российской академии наук, Владивосток 690022; e-mail: [email protected]
2 Institute of Ecology and Biological Resources, Vietnam Academy of Science and Technology, Hanoi,
Vietnam
На основе маркеров межмикросателлитной области ДНК проведен сравнительный анализ генетической изменчивости и дифференциации редких лекарственных видов женьшеня Panax vietnamensis На et Grushv. и P. ginseng C.A. Meyer. Показано, что все параметры генетического разнообразия вьетнамского женьшеня были высокими и значительно превышали таковые у P. ginseng. Напротив, уровень генетической подразделенности оказался более высоким у женьшеня настоящего. Предполагается, что на различия в уровнях генетической изменчивости и дифференциации двух видов женьшеня повлияли демографическая история, особенности системы размножения и антропогенная нагрузка.
DOI: 10.7868/S0016675818020169
Статьи, опубликованные только в Russian J. of Genetics, № 2 – 2018 г.
EVALUATION OF BARLEY lncRNAs EXPRESSION ANALYSIS IN SALINITY STRESS
E. Karlik1,*, N. Gözükirmizi2
1 Department of Biotechnology, Istanbul University, 34134, Vezneciler, Istanbul, Turkey; e-mail: [email protected]
2 Department of Molecular Biology and Genetics, Istanbul University, 34134, Vezneciler, Istanbul, Turkey
Long noncoding RNAs (lncRNAs) act important roles in a wide range of biological processes. The regulatory roles of lncRNAs are still poorly understood. One of the major problems of limiting plant productivity is the salinity in the worldwide. However, barley (Hordeum vulgare L.) seems to be relatively well adapted to salinity environments. The aim of this study is the investigation of lncRNAs’ expression levels on four barley genotypes (Hasat, Beysehir 99, Konevi 98 and Tarm 92) to 150 mM salt stress application during 3 days germination. Grains were placed randomly in petri dishes containing filter paper soaked in (a) only H2O (control), (b) 150 mM NaCl for 72 h. RNA extraction were carried out using TriPure® reagent from root and shoot samples obtained after 150 mM salt treatment. Expression levels of CNT0018772 and CNT0031477 were determined by qPCR. Expression analysis demonstrated salinity effected expression levels of CNT0018772 and CNT0031477 on roots and shoots during germination. The expression levels of CNT0018772 for 150 mM salt applied groups were down-regulated raged between (log2 -0.52 and -35.65) compared controls on roots and shoot. The expression levels of CNT0031477 in 150 mM salt applied groups were also down-regulated ranged between (log2 -10.40 and 33.59) compared controls on roots and shoot except for Tarm 92 variety. On the contrary, expression levels of CNT0031477 were up-regulated on root and shoot of Tarm 92. Comparison of CNT0018772 and CNT0031477 expression levels on roots, there was no significant difference between barley varieties compared to controls (p>0.05). However, it was found there was statistically significant difference between 150 mM salt treatment and control groups for CNT0031477 expression levels (p
10.1134/S1022795418020096
INVESTIGATING DYSREGULATED PATHWAYS IN DILATED CARDIOMYOPATHY FROM PATHWAY INTERACTION NETWORK
R.-P. Shang1, W. Wang2,*
1 Department of Cardiology, Daqing Oilfield General Hospital, Daqing 163001, Heilongjiang, China
2 Department of Cardiology, Wangjing Hospital, China Academy of Chinese Medical Sciences, Beijing 100102, China; e-mail: [email protected]
The aim of this study was to identify dysregulated pathways for the diagnosis and treatment of dilated cardiomyopathy (DCM) using pathway interaction network analysis. Methods: Transcriptome data of DCM, protein-protein interaction (PPI) data, and pathway data were recruited and preprocessed. Then, the pathway interaction network was constructed based on the gene expression analysis and gene co-expression analysis. Meanwhile, pathway activity analysis was performed, and the pathway with the greatest activity change was defined as the seed pathway. Staring from the seed pathway, the dysregulated pathways that could serve as diagnostic biomarker was extracted from the pathway interaction network using support vector machines. Results: Combining gene expression and co-expression data, we constructed the pathway interaction network, covering 4175 pathway interactions. Via pathway activity analysis, cap-dependent translation initiation with the greatest activity change was defined as the seed pathway. Staring from cap-dependent translation initiation, a total of 21 dysregulated pathways were obtained, which could discriminate DCM samples from controls with the area under the curve value of 0.95. Conclusion: A pathway interaction network was implemented to identify dysrgulated pathways that can best discriminate DCM samples from controls. We identified a total of 21 dysregulated pathways in DCM, which can serve as diagnostic biomarkers for DCM.
10.1134/S1022795418020151
История кафедры
Курс лекций «Законы наследственности и методика отбора сельскохозяйственных растений» в Одесском (тогда Новороссийском) университете на естественном отделении физико-математического факультета первым начал читать приват-доцент Андрей Афанасьевич Сапегин в 1912 году. Это случилось после возвращения Андрея Афанасьевича с летней загранкомандировки в научные лаборатории Европы, где значительное влияние на его научные интересы оказали берлинский профессор генетик Е. Баур и пражский цитолог и генетик Б. Немец, автор многих работ по вопросам наследственности у растений. В 1912 году вышли в свет «Законы наследственности, как основа селекции сельскохозяйственных растений», которые Андрей Афанасьевич изложил по книге Э. Баура «Einführung in die experimentelle Vererbungslehre». Годом позже курс лекций, который читал А. А. Сапегин в университете, стал называться «Генетика и селекция», а его учебник «Основы теории и методики селекции сельскохозяйственных растений», напечатанный в 1913, был одним из первых отечественных пособий по селекции, основанный на генетических законах.
В этот же период А. А. Сапегин был назначен руководителем селекционного отдела Одесского опытного поля при Южнорусском обществе сельского хозяйства. С 1917 года Андрей Афанасьевич работает экстраординарным, а затем ординарным профессором по кафедре агрономии Новороссийского университета. Информации, какой была эта кафедра и кто на ней преподавал в тот период, нами не найдено. Однако известно, в Новороссийском университете в 1916-1918 годах работала агрономическая лаборатория, в которой А. А. Сапегин, предположительно, имел отношение. А. А. Сапегин продолжает преподавание генетики в Новороссийском университете до 1922 года и одновременно ведет занятия в Одесском сельскохозяйственном институте с 1918 по 1928. В мае 1920 года Новороссийский университет был реорганизован в Одесский институт народного образования, который объединил несколько высших учебных заведений и просуществовал целое десятилетие. Согласно исторических очерков, в рамках Одесского института народного образования в 1922-1923 годах функционировали факультет социального воспитания и факультет профессионального образования. Последний состоял из отделений: математического, агробиологического, исторического, отделения литературы и языка. Предполагаем, что в это время А. А. Сапегин преподавал на агробиологическо отделении. В 1923 г. Наркомпрос Украины поручил профессору Одесского сельскохозяйственного института А. А. Сапегину руководство новообразованной научно-исследовательской кафедрой растениеводства при этом институте. В эти же годы А. А. Сапегин выдает ряд методических работ и учебников по генетике и селекции, а именно: «Среднняя ошибка и ее значение для оценки средних арифметического при сравнительных испытаниях» (1914), «Гибридологический анализ сопряженных признаков пшеницы» (1916 ), «Определение точности полевого опыта с помощью элементов вариационной статистики» (1921), «Вариационная статистика» (1922, переиздавалась шесть раз в 1937), «Общая методика селекции сельскохозяйственных растений» (1925), редактирует сборники статей «Этапы менделизма» ( 1923) и «Вехи селекции» (1923).
Возглавляемый А. А. Сапегиным селекционный отдел Одесского опытного поля в 1918 году был преобразован в Одесскую сельскохозяйственную селекционную станцию, где под его руководством в научный процесс были внедрены новые методы исследования и аппаратура, среди которых цитологические методы, рентгеновская и холодильная установки, муко-хлебопекарная лаборатория, теплицы и др. Через 10 лет на базе станции был организован Украинский генетико-селекционный институт (УСГИ), директором которого А. А. Сапегин был до 1931 года. Отставке А. A.Сапегина с этой должности способствовало то, что в суровые зимы 1927-1928 и 1928-1929 годов выведенные им сорта пшеницы Кооператорка, Земка сильно пострадали или даже совсем погибли. Ученый был обвинен во вредительстве и саботаже и арестован по указанию наркома земледелия СССР Я.А. Яковлева. После ареста в 1931-1933 годах А. А. Сапегин работает заместителем директора УГСИ по научной работе.
Н. И. Вавилов лично знал и высоко ценил Андрея Афанасьевича как специалиста и настойчиво приглашал его на должность заместителя директора Института генетики АН СССР. В 1933 году А. А. Сапегин согласился на приглашение и покинул Одессу. С 1933 до 1946 года он работал заместителем директора Института генетики АН СССР и одновременно с 1936 гг. заведовал отделом генетики и селекции растений Института ботаники АН УССР.
На протяжении более 20 лет А. А. Сапегин оставался организатором различных мероприятий по созданию в Одессе научных учреждений генетико-селекционного направления и подготовку для них квалифицированных кадров.
В 1933 году был восстановлен Одесский государственный университет (ОГУ), в рамках которого создается биологический факультет. После отъезда А. А. Сапегина в Академию наук УССР генетику в университете читал с 1931 по 1937 гг. сотрудник Селекционно-генетического института Н. А. Ольшанский, а затем В. Ф. Хитринський – сотрудник того же института, который позже защитил докторскую диссертацию «Направленное изменение наследственности растений путем воспитания как метод селекции» (1959 г.). Оба ученых были сторонниками «мичуринской генетики» и ревностными сторонниками Т. Д. Лысенко.
По возвращении университета из эвакуации, где деканом биологического факультета был профессор А. Машталер (заведующий кафедрой дарвинизма), который критически относился к генетикам-морганистам, некоторое время лекции по генетике читал доцент сельскохозяйственного института Ю.П. Мирюта, учителями которого были Г.А. Левитский и Д. Карпеченко.
Позже о Юрии Петровиче Мирюте в биографической статье, будет написано – выдающийся генетик, ученый-селекционер, педагог, один из ярких представителей Вавиловской плеяды генетиков растений, который много сделал для возрождения генетики в стране и преодолении монополии Лысенковщины в советской биологии. А пока – в 1944 Ю.П. Мирюта – переезжает в Одессу из Горьковского государственного университета, где он руководил специализацией по генетике и селекции растений на кафедре генетики, которой заведовал в то время С.С. Четвериков. К 1948 Ю. П. Мирюта возглавляет кафедру селекции и семеноводства Одесского сельскохозяйственного института и работает доцентом ОДУ. В те годы Юрий Петрович подготовил докторскую диссертацию «Генетическая сущность гетерозиса» (1947), в которой была предложена новая теория гетерозиса. Однако в связи с печально известной для биологической науки в СССР сессией ВАСХНИЛ 1948 защита диссертации не состоялся.
Самостоятельная кафедра генетики в ОГУ была открыта в сентябре 1949 деканом биологического факультета кандидатом сельскохозяйственных наук Андреем Ивановичем Воробьевым, который был переведен в ОГУ за год до этого из Всесоюзного селекционно-генетического института (ВСГИ) для «укрепления мичуринщины» университета. В 1955 эта кафедра была переименована в кафедру генетики и дарвинизма, а в мае 1978 по инициативе нового заведующего и декана факультета Владлена Николаевича Тоцкого реорганизована в кафедру генетики и молекулярной биологии.
Как уже говорилось, А. И. Воробьев (1902-1991) в 1923 г. окончил Одесский сельскохозяйственный институт по специальности агроном-растениевод. Аспирантскую подготовку прошел в 1925-1929 гг. на кафедре генетики и селекции того же института под руководством профессора А. А. Сапегина. По инициативе которого А. И. Воробьев был командирован в Ленинград и Москву для ознакомления с методикой работ в лучших генетических лабораториях и изучения литературы. Командировки оказались плодотворными: были собраны литературные источники для фундаментального труда «кратные хромосомные числа у близкородственных форм». Успешной работе способствовало знание иностранных языков, а владение цитогенетическими методами позволило накопить собственные экспериментальные данные, по рекомендации Н. И. Вавилова и Г. А. Левитского рукопись была принята к печати.
После окончания аспирантуры А. И. Воробьев работал некоторое время в лаборатории Г. А. Левитского (Ленинград, ВИР). Вернувшись в Одессу, работал в украинском генетико-селекционном институте (УГСИ) специалистом отдела физиологии растений, затем старшим научным сотрудником. Следует заметить, что с октября 1929 в том же институте должность старшего специалиста лаборатории морфологии растений занимал Т. Д. Лысенко.
Ученую степень кандидата сельскохозяйственных наук А. И. Воробьеву было присвоено в 1938 году без защиты диссертации. Докторскую диссертацию защитил в 1951 г. в ОГУ имени И. И. Мечникова.
Заведующим кафедрой генетики ОГУ А. И. Воробьева назначили через год после августовской сессии ВАСХНИЛ 1948, на которой произошел разгром позиций менделизма-морганизма. А. И. Воробьев руководил кафедрой с 1949 по 1977 год. Он уделял внимание организации учебного процесса и научно-исследовательской работе преподавателей и студентов, но в направлении развития «Мичуринского учения». Возможно с целью распространения «передового Мичуринского учения», написанный А. И. Воробьевым учебник «Основы мичуринской генетики» (1950) был переведен на польский, чешский, румынский, японский и китайский языки. Для улучшения учебной и воспитательной работы А. И. Воробьев создал за собственные средства агробиологический участок (около биологического факультета) с садом, цветником, лекарственными растениями, моделью пришкольного участка. Таким образом, были созданы условия для получения студентами под руководством преподавателей навыков формирования кроны плодовых деревьев, ухода за растениями, создание опытных участков с целью выполнения студентами курсовых и дипломных работ. Все это повышало уровень практической подготовки студентов как будущих специалистов-биологов, так и учителей школ.
Но, поскольку кафедра генетики формировалась и развивалась в сложные для страны и ее науки времена в период диктатуры Т. Д. Лысенко, общий курс «Генетика с основами селекции» А. И. Воробьев читал по министерской программе. По данным, собранным Д. Урсу, осенью 1947 А. И. Воробьев поставил свою подпись под коллективным письмом руководящих должностных лиц ВСГИ к министру высшего образования, в котором есть требование убрать с преподавания в сельскохозяйственных и педагогических вузах «буржуазную лженауку» – генетику.
При руководстве А. И. Воробьева кафедра обеспечивала преподавание общих курсов «Введение в биологию» (доцент О. Н. Радченко), «Генетика с основами селекции» (профессор А. И. Воробьев), «Дарвинизм и история биологии» (доцент П. И. Дмитрашко), «Растениеводство» (доцент И. М. Сагайдак), «Цитология с основами эмбриологии» (старший преподаватель З. П. Коц) и спецкурсов «Биология развития растений», «Общая селекция», «Избранные главы генетики» (профессор А. И. Воробьев). На спецкурсах, лабораторных занятиях по генетике и цитологии, на большом спецпрактикуме значительное место занимали цитогенетические методы. В 1958-1965 гг. под руководством А. И. Воробьева проводились исследования по цитоэмбриологии перекрестно-опыляемых растений (кукуруза, рожь, подсолнечник) при их самоопылении после предварительной обработки рылец растворами некоторых веществ (З. П. Коц, К. М. Нассаль, Т. П. Бланковская).
В научно-исследовательской работе в конце 60-х-70-х годов преподаватели и сотрудники кафедры цитогенетические исследования сочетали с изучением мутагенного действия излучения Со60 на семена хлебных злаков (А. Н. Радченко, К. М. Шварцман). Установлена частота и спектр хромосомных перестроек в зависимости от дозы излучения. Осознавая необходимость использования методов цитоэмбриологии для решения проблем, которыми тогда занималась кафедра (принудительное самоопыление, гибридизация, влияние мутагенных факторов на растения), заведующий отправил молодых преподавателей (3. П. Коц и К. М. Нассаль) на стажировку в лабораторию эмбриологии Института ботаники АН УССР, которой в то время руководил ученик С. Г. Навашина – Я. С. Модилевський. Приобретенный опыт преподаватели в полной мере использовали при преподавании курса «Цитология с основами эмбриологии», при проведении отдельных разделов большого спецпрактикума, а также в научно-исследовательской работе.
Многие студенты кафедры, увлекшись при выполнении курсовых и дипломных работ цитоэмбриологичними исследованиями, продолжали их при выполнении диссертационных работ (Г. И. Белова, Т. Ф. Бланковская, В. К. Симоненко, Чан Ту Нга и др.).
В результате многолетних, комплексных исследований с использованием цитохимической, цитометрической и цитофизиологической методик были выявлены новые закономерности эмбрионального развития растений, определены признаки (в том числе и количественные), на основании которых можно делать выводы о нормальном или патологическом развитии эмбриональных структур у злаков и астровых.
Кандидат биологических наук, доцент И. М. Сагайдак изучал изменчивость и продуктивность однолетних сельскохозяйственных растений и многолетних плодовых при прививании одного или нескольких растений того же или другого вида. От Комитета по делам изобретений и открытий при Совете министров СССР он получил Удостоверение о приоритете в разработке нового метода получения гетерозисных семян (1963 г.).
Проводились исследования по акклиматизации и изучению биологических особенностей седы многолетней с целью внедрения этой прядильной культуры в сельскохозяйственное производство Украины (П. И. Дмитрашко), а также исследования онтогенеза кукурузы и ее гибридов (А. Н. Радченко).
С 1964 по 1992 годы на кафедре работала доцент Г. И. Белова. Ею в 1970 году на биологическом факультете ОГУ была защищена кандидатская диссертация на тему: «Цитоэмбриология некоторых межвидовых гибридов хлопчатника». Г. И. Белова долгие годы на кафедре преподавала «Дарвинизм и эволюционное учение», проводила лабораторные работы по генетике, цитологии, растениеводству, читала специальный курс «Генетика популяций». В 1984 году Г. И. Белова награждена грамотой одесского отдела народного образования за работу с учителями и учениками, которые выступали на олимпиадах. Научные интересы Г. И. Беловой были связаны с изучением отдаленной гибридизации хлопчатника и гороха, а также проблемами мутагенеза. По результатам исследований ею опубликовано около 20 научных работ.
В соответствии с научными направлениями кафедры были введены новые спецкурсы: «Мутагенез», (А. Н. Радченко), «Основы научных исследований» (А. И. Воробьев), «Генетика человека» (Г. И. Белова), «Микроскопическая техника» и «Эмбриология растений» (Т. Ф. Бланковская) и др.
Большой спецпрактикум был расширен новыми разделами – экспериментальное решение генетических задач, генетический анализ с использованием модельного объекта – дрозофилы. Вела эти разделы К. М. Нассаль. Она прошла курсы повышения квалификации при кафедре генетики Московского государственного университета (МГУ) и стажировку на кафедре Ленинградского государственного университета (ЛГУ), на которых овладела методиками разведения и скрещивания дрозофилы, анализа гибридных поколений, привезла впервые в 1968-1970 годах мутантные линии дрозофилы для обучения студентов гибридологическому анализу, исследованию частоты кроссинговера, построению генетических карт и др. К. М. Нассаль разработала необходимые для студентов методические указания. Соответствующие разделы были введены в содержание работы по общему курсу «Генетика с основами селекции».
Первые привезенные из МГУ мутантные линии дрозофилы положили начало созданию генетической коллекции видов и мутантных линий дрозофилы, которая в настоящее время насчитывает более 40 генотипов. Сохранность, чистоту и воспроизведение коллекции с 1976 года обеспечивают инженеры первой категории Н. А. Стрельцова и З. В. Мирось. С 1980-х годов на коллекционных образцах дрозофилы выполнялись исследования по мутагенезу. За более чем 30 лет проведения экспериментальных исследований с использованием коллекции дрозофилы на кафедре защищено более 250 квалификационных работ студентов, выполненные диссертационные работы А. М. Андриевским (1988), Н. Д. Хаустовой (1990), С. В. Джан (1995) (Корея), Н. М. Аль-Бордо (2003) (Иордания), Л. В. Левчук (2000), С. В. Белоконь (2007). Общее количество публикаций сотрудников кафедры по результатам исследований выполненных на дрозофиле в отечественных и зарубежных научных изданиях составляет более 300.
Дальнейшее развитие научных исследований кафедры, учебно-воспитательного процесса, подготовка квалифицированных кадров и обновление состава сотрудников кафедры были связаны с новыми требованиями, которые обусловлены прогрессом всех отраслей биологии, в частности молекулярной генетики, молекулярной биологии и др.
В 1977 г. кафедру возглавил доктор биологических наук, профессор, действительный член Академии наук Высшей школы Украины, лауреат премии имени А. В. Палладина Владлен Николаевич Тоцкий, который в 1964 году защитил кандидатскую диссертацию по теме «Содержание АТФ и АТФ-азная активность органов и тканей белых крыс при раздельно и совместном действии на организм рентгеновских лучей, хлорэтиламинов и этиленаминов». В 1965 В. Н. Тоцкий пришел на преподавательскую работу на кафедру биохимии ОГУ имени И. И. Мечникова и впервые на биологическом факультете начал читать спецкурсы «Молекулярная биология», «Антибиотики», «Механизмы сокращения мышц», «Структура и функции нуклеиновых кислот». В 1967-1969 гг. работал как консультант-преподаватель Улан-Баторского университета Монгольской Народной Республики. В 1973-1982 гг. и с 2000 по 2007 годы – декан биологического факультета ОГУ. С 1982 по 1988 год проректор ОГУ по учебно-методической работы. В 1982 году В. Н. Тоцкий защитил в Институте биохимии АН УССР докторскую диссертацию «Мембранный транспорт некоторых коферментных витаминов». В 1983 г. Ему было присвоено звание профессора кафедры генетики и молекулярной биологии.
Как декан и профессор кафедры В. Н. Тоцкий большое внимание уделяет организации учебной работы. С 1981 г. В. Н. Тоцкий читает студентам биологического факультета общий курс «Генетика с основами селекции». Он разработал программу этого курса, которая впоследствии стала основой утвержденной ВАК программы кандидатского минимума.
Профессором В. Н. Тоцким основана научная школа «Генетические механизмы адаптации и эволюции». Основные направления научных исследований – генетическая структура популяций и факторы среды; структура генотипов и приспособленность; генетическая детерминация признаков устойчивости бионт к факторам среды; внедрение новых генетико-биохимических и генетико-цитологических критериев адаптивности, взаимодействие и коадаптация генов и тому подобное.
В период с 1969 по 1987 гг. на кафедре под руководством В. Н. Тоцкого проводились исследования в области генетики и селекции микроорганизмов (И. И. Броуном, О. Б. Полодиенко и С. Г. Каракис), которые завершились созданием штаммов Psuedomonas putida, способных суперпродуцировать метионин. Эффективность одного из штаммов подтверждена получением авторского свидетельства на изобретение.
В. Н. Тоцкий – автор трех изданий украиноязычной книги «Генетика», утвержденной Министерством образования и науки Украины как учебник для студентов высших учебных заведений, и ряда учебно-методических изданий. Им опубликовано более 250 научных работ, среди которых две монографии и более 100 журнальных статей, в том числе в зарубежных и науковометрических журналах («Генетика», «Селекция и генетика», «Украинский биохимический журнал» и т.д.). В 2007 году В. Н. Тоцкому присвоено почетное звание «Заслуженный деятель науки и техники Украины». За достижения в педагогической, научной и организаторской работе на должностях декана факультета, проректора университета и заведующего кафедрой Владлен Николаевич награжден Почетной грамотой Верховной Рады Украины (2006), Кабинета Министров Украины (2012), Почетным знаком отличия Одесской областной государственной администрации (2011), Дипломом почетного члена Украинского биохимического общества (2010), рядом Почетных грамот ректората и профкома университета.
Профессор кафедры генетики и молекулярной биологии Бланковская Тамара Филипповна в 1958 г. закончила биологический факультет, кафедру генетики и дарвинизма ОГУ. В 1965 г. защитила кандидатскую диссертацию по теме «Цитохимические исследования эмбриогенеза у растений при различных сроков посева незрелыми и зрелыми семенами». В 1992 году защитила докторскую диссертацию по теме «Морфофункциональные аспекты развития генеративных структур хлебных злаков». Научные интересы Бланковской Т. Ф. лежали в области генетических аспектов эмбриогенеза растений. Она читала общие курсы «Цитология» и «Растениеводство», спецкурс «Генетические основы селекции». Автор более 200 научных и учебно-методических работ.
В 1979-1984 гг. на кафедре генетики и молекулярной биологии работал доктор биологических наук, лауреат Государственной премии СССР, академик НААН Украины профессор Б. С. Пристер – радиобиолог, агроном, эколог. Как человек творческий и энергичный он за этот короткий период работы на кафедре разработал курсы «Радиоэкология» и «Проблемы мутагенеза». Внедрил методику биологического мониторинга окружающей среды с использованием в качестве тест-объектов микроорганизмов, гидробионтов и других организмов. Разработал методику мониторинга водной среды в интересах водного и рыбного хозяйства.
В 1982-2000 гг. на кафедре работала кандидат биологических наук, доцент В. И. Максимова, которая в 1974 году защитила кандидатскую диссертацию «Генетическое и цито-эмбриологическое изучение полиплоидных форм кукурузы», которую выполнила в Украинском ордена Ленина научно-исследовательском институте растениеводства, селекции и генетики имени В. Я. Юрьева. В. И. Максимова внедрила в учебный процесс кафедры спецкурс «Культура растительных клеток и тканей» и разделы большого спецпрактикума по генетике кукурузы и кариотипированию растений. Она проводила практические занятия по цитологии и генетике, читала специальные курсы: «Селекция растений», «Генетика популяций», «Основы научных исследований», курс «Генетики» на вечернем отделении. Вместе с сотрудниками ВСГИ исследовала цитогенетическую стабильность (митоз и мейоз) аллополиплоидов злаков (тритикале), проводила цитологические и морфогенетические исследования сельскохозяйственных растений в культуре in vitro. Значительное внимание В. И. Максимова оказывала педагогической и организаторской работе – руководила студенческим кружком генетиков, готовила студентов к конкурсам, школьников к олимпиадам, долгие годы была ученым секретарем кафедры, активно участвовала в создании филиала кафедры в ВСГИ.
Кафедра поддерживала тесные связи с ВСГИ. В отделе цитологии и генетики, а также в селекционных отделах студенты кафедры проходили производственную практику, выполняли курсовые и дипломные работы. В период учебных практик студенты под руководством преподавателей выезжали в Москву, Ленинград, Киев для ознакомления с тематикой и методиками проведения исследований в генетических лабораториях МГУ, Ленинградского государственного университета им. М. В. Ломоносова, Института генетической инженерии и клеточной биологии (г. Киев) и др.
С 1984 по 2006 год на кафедре работала к.б.н., доцент Н. Г. Гандирук. В 1986 г. впервые в университете она начала читать новый общий курс «Биотехнология», ввела новые спецкурсы – «Биохимическая генетика», «Экология человека», получила авторское свидетельство на изобретение способа выделения орнитозного антигена. С 1992 года Н. Г. Гандирук наладила творческие связи биологического факультета с Ришельевским лицеем при Одесском национальном университете (ОНУ). Активно работала с одаренной молодежью, подготовила более 50 призеров III этапа, 15 призеров IV этапа Всеукраинской олимпиады по биологии. Ею подготовлено три серебряных призера Международных олимпиад по биологии в Таиланде (1995 г.), Швеции (1999) и Бельгии (2001 г.). За активную работу с одаренной молодежью и подготовку призеров международных олимпиад ей присвоено почетное звание «Заслуженный учитель Украины».
Доцент кафедры, старший научный сотрудник, кандидат биологических наук Сечняк Александр Львович работает на кафедре с 2000 года. Окончил кафедру генетики и молекулярной биологии ОГУ в 1982 году. В 1988 году защитил кандидатскую диссертацию на тему «Мейотическая стабильность тритикале в зависимости от способов их получения» в ВСГИ.
Научные интересы А. Л. Сечняка связанные с механизмами онтогенетической и филогенетической адаптации пшеницы после отдаленной гибридизации. Он активно ведет результативную научно-исследовательскую работу по проблемам формирования генетической коадаптации при создании синтетических генотипов злаков. В результате этих исследований были выяснены особенности влияния аллоплазмы на адаптивные свойства интрогрессивных форм пшеницы на устойчивость пшеницы к ряду абиотических (низкая температура, засоленность почвы) и биотических (бурая и стеблевая ржавчина, мучнистая роса) факторов. Выяснена роль отдельных ген-энзимных систем в формировании адаптивности, особенности стабилизации мейоза у пшенично-чужеродных гибридов. Кроме того А. Л. Сечняком на кафедре начаты работы по исследованию цитогенетических эффектов пестицидов на объекты защиты. По результатам исследований им опубликовано более 100 научных работ, среди которых 20 статей в международных журналах.
А. Л. Сечняк читает общие курсы «Генетика популяций и эволюция», «Медицинская генетика», специальные курсы «Цитогенетика», «Генетика и медицина», «Внехромосомная наследственность», «Популяционная генетика», «Популяционная биология». Им изданы конспекты лекций по специальным курсам «Внехромосомная наследственность», «Иммуногенетика», «Популяционная биология», а также методические пособия по «Генетики популяций» и «Растениеводство». Много внимания А. Л. Сечняк уделяет работе со студенческой и школьной молодежью, активно участвует в организации и проведении Всеукраинских школьных и студенческих олимпиад по биологии.
Доцент кафедры Хаустова Нина Дмитриевна окончила биологический факультет ОГУ, кафедру биохимии. В 1982 г. начала работать на кафедре генетики и молекулярной биологии. В 1989 году защитила кандидатскую диссертацию на тему «Адаптивный гетерозис и экспрессия гена Adh у дрозофилы» в Харьковском национальном университете имени В. Н. Каразина. Научные интересы Н. Д. Хаустовой связанные с изучением роли генного баланса в адаптации дрозофилы к условиям окружающей среды. Читает общий курс «Молекулярная биология», спецкурсы: «Основы генетического анализа» и «Генетика поведения». Автор более 100 научных и учебно-методических работ.
Доцент кафедры Андриевский Александр Михайлович в 1979 году окончил кафедру биохимии ОГУ. В 1988 году защитил кандидатскую диссертацию по теме «Щелочная пептидгидролаза кишечника и его ингибиторы в онтогенезе дрозофилы». В 1993 году был зачислен на должность доцента кафедры генетики и молекулярной биологии, после того, как поработал на биологическом факультете инженером и заведующим лабораторией физико-химических методов исследования.
Научные интересы А. М. Андриевского связаны с исследованием белкового полиморфизма в популяциях дрозофилы и роли отдельных ген-энзимных систем в онтогенезе дрозофилы и других бионтов. Он впервые на биологическом факультете разработал и внедрил в учебный процесс учебно-производственную практику по физико-химическим методам исследования для студентов, обучающихся по специальности «Микробиология и вирусология». Автор более 90 научных и научно-методических публикаций. Много лет сотрудничает с Одесским институтом усовершенствования учителей. Активно участвует в воспитательной работе студентов. C 2017 года перевелся на кафедру биохимии.
Доцент кафедры Мирось Светлана Леонидовна в 1997 году закончила ОГУ, кафедру генетики и молекулярной биологии. В 2003 году защитила кандидатскую диссертацию по теме: «Генетическая детерминация устойчивости озимой мягкой пшеницы к возбудителям фузариоза колоса на юге Украины» в Селекционно-генетическом институте Национальном центре семеноводства и сортоизучения (СГИ — НЦНС). В 2004 присоединилась к преподавательскому составу кафедры. Проводит научную работу в области исследования генетики макромицетов. Ею налажены творческие отношения с отделом фитопатологии СГИ НЦНС. Читает общие курсы «Цитология», «Биотехнология», а также спецкурсы «Генетика человека», «Иммуногенетика». На сегодня автор около 40 научных и научно-методических публикаций.
Доцент кафедры Белоконь Светлана Васильевна в 1994 году окончила биологический факультет ОГУ, кафедра генетики и молекулярной биологии. В 2006 году присоединилась к преподавательскому составу кафедры. В 2007 году защитила кандидатскую диссертацию на тему: «Мутации cn и vg и Приспособленность генотипов Drosophila melanogaster Meig» в СГИ ˗ НЦНС. Научные интересы связаны с изучением механизмов онтогенетической и филогенетической адаптации Drosophila melanogaster. Читает общий курс «Молекулярная биология», спецкурсы «Проблемы мутагенеза», «Биохимическая генетика», «Генетические основы адаптации». На сегодня автор более 30 научных и научно-методических публикаций.
С 2006 года на кафедре генетики и молекулярной биологии начала свою трудовую деятельность доцент Задерей Наталья Сергеевна. Она закончила кафедру в 1989 году и долгое время работала в лаборатории биотехнологии ВСГИ. В этот период Н. С. Задерей занималась разработкой условий культивирования тканей, клеток и органов бобовых растений на искусственных питательных средах в условиях in vitro. Н. С. Задерей овладела методами выделения протопластов из мезофилла листа и их культивированием с целью получения колоний и растений-регенерантов. В 1992 году Н. С. Задерей поступила на заочную аспирантуру на кафедру генетики и успешно закончила ее. В 1997 году Н.С. Задерей защитила диссертацию по специальности «Клеточная биология» по теме «Культивирование тканей и индукция морфогенеза in vitro у эспарцета (Onobrychis Sp.)» В Институте клеточной биологии и генетической инженерии НАН Украины (г. Киев). С 1999 по 2006 Н. С. Задерей работала учителем биологии в Ришельевском лицее где подготовила большое количество призеров областных и Всеукраинских олимпиад, за что получила государственную награду – «Отличник образования».
На сегодняшний день доцент Н. С. Задерей активно работает на кафедре генетики, разработала курсы лекций по биотехнологии, клеточной инженерии, фармакогенетике, молекулярным механизмам дифференциации клеток. Научные интересы Н. С. Задерей тесно связанные с технологиями in vitro. Задерей Н. С. является автором более 20 научных работ, в том числе учебно-методических пособий «Задачник по генетике и молекулярной биологии» (2007), «Биотехнология растений» (2015).
Доцент кафедры Алексеева (Трочинская) Татьяна Григорьевна окончила биологический факультет в 2002 году, в том же году была принята в аспирантуру по специальности «Генетика» под руководством доктора биологических наук, профессора Бланковской Т. Ф. После окончания аспирантуры в 2005 году осталась работать на кафедре сначала на должности старшего лаборанта, затем – специалистом I категории. С 2007 по 2011 год была ответственным секретарем научного журнала «Вестник ОНУ. Серия Биология». В 2009 году Алексеева Т. Г. защитила кандидатскую диссертацию по специальности «Генетика» на тему: «Генотипические особенности проявления цитометрических признаков клеток генеративных структур пшеницы, ржи и их гибридов». Направления научной деятельности Алексеевой Т. Г. сосредоточены на генетике количественных признаков, генетике развития культурных растений, цитогенетике, исследовании полиморфизма ген-энзимных систем растений и животных. Т. Г. Алексеева преподает специальные курсы «Генетика индивидуального развития», «Основы генетического анализа», выборочный курс «Растениеводство», проводит практические занятия по цитологии и генетике. Она является автором около 40 научных публикаций.
В 2001-2010 годах работал филиал кафедры генетики на базе Южного биотехнологического центра в растениеводстве НААН Украины, которым руководил академик НААН, д. б. н., профессор Ю. М. Сиволап, в составе преподавателей совместителей, которые работали на должностях доцентов: к. б. н. Максимовой В. И., к. б. н. Чеботарь С. В., д. б. н. Игнатовой С. А., к. б. н. Бальвинской М. С., к. б. н. Кожуховой Н. Е., к. б. н. Солоденко А. Е., к. б. н. Балашовой И. А. Студенты кафедры выполняли в филиале курсовые, бакалаврские, магистерские работы, учились молекулярно-генетическим и биотехнологическим методам исследования.
В 2011 году для преподавательской работы и внедрения молекулярно-генетических исследований на кафедру на постоянную должность доцента была приглашена д. б. н. Сабина Витальевна Чеботарь. Она в 1988 году закончила ОГУ, специализировалась на кафедре генетики и молекулярной биологии. Трудовую деятельность С. В. Чеботарь начала в ВСГИ в 1988 г. В должности старшего лаборанта отдела генной инженерии, там же в 1990-1993 гг. училась в аспирантуре, а с 1994 гг. работала научным сотрудником отдела генной инженерии. После защиты диссертации на соискание ученой степени кандидата биологических наук в Институте молекулярной биологии и генетики (ИМБиГ, г. Киев) по теме «Молекулярно-генетический анализ интрогрессии элементов генома эгилопса в геном мягкой пшеницы» в 1995 году, С. В. Чеботарь работала старшим научным сотрудником отдела генной инженерии СГИ — НЦНС (1996-1999 гг.). В 1998 году С. В. Чеботарь проходила стажировку в рамках немецкого академического обмена на кафедре генетики Института биохимии, генетики и микробиологии Университета города Регенсбург (Германия) под руководством профессора Р. Шмидта, в 2001-2002 гг в Генбанке и лаборатории генного и геномного картирования Института генетики зерновых культур м. Гатерслебен (Германия) под руководством приват-доцента А. Бёрнера и доктора М. Рёдер. В 2004-2007 годах С. В. Чеботарь участвовала в международной программе исследований, которая проводилась в лаборатории генетики и геномики злаковых культур Национального института агрономических исследований (INRA) и Университета имени Блеза Паскаля, г. Клермон-Ферран (Франция), где исполняла общие исследования с известными в мире учеными по молекулярной генетике злаков (М. Бёрнардом, П. Сурдиллем, К. Фьюилле, Дж. Cалса). В 2009 году С. В. Чеботарь защитила докторскую диссертацию по специальности «Молекулярная генетика» по теме: «Молекулярно-генетический анализ генофонда озимой мягкой пшеницы Украины» в ИМБиГ (г. Киев). В 2010 была избрана членом-корреспондентом Национальной академии аграрных наук Украины. С. В. Чеботарь – является автором более 200 научных работ, среди них более 80 вышло в зарубежных изданиях. На кафедре С.В. Чеботарь преподает дисциплины: «Общая цитология», «Геномика», «Генетическая инженерия», «Молекулярные маркеры», «Создание и детекция ГМО», «Регуляторные белки и системы клеток», проводит занятия по «Большоу спецпрактикуму» из раздела «Основы молекулярной генетики». В течение многих лет является научным руководителем дипломных работ студентов и аспирантов.
С 2013 года С. В. Чеботарь занимает должность заведующего кафедрой генетики и молекулярной биологии. Под руководством С. В. Чеботарь на кафедре развиваются работы по молекулярной генетике злаков, а также молекулярно-генетические исследования гидробионтов Черноморского бассейна. Ею в программу «Большого спецпрактикума», проводимого на кафедре, внедрено обучение студентов современным методам ДНК-технологий, основанным на полимеразной цепной реакции (ПЦР).
В 2016 году к.б.н. Чеботарь Г.А. приступила к работе на кафедре генетики и молекулярной биологии. (Защита кандидатской диссертации Чеботарь Г. А. на тему «Аллели генов короткостебельности Rht8, Rht-B1, Rht-D1, нечувствительности к фотопериоду Ppd-D1мягкой пшеницы и их эффекты на агрономические признаки» прошла в 2012 году). Преподает спецкурс «Эпигенетика», проводит практические занятия по «Цитологии», «БСП» для 3 и 4 курсов, а также семинарские занятия по «Молекулярной биологии». Сфера научных интересов: молекулярная генетика злаков, использование современных биотехнологических подходов для улучшения злаков, оценка генетического разнообразия, молекулярно-физиологические аспекты ростовых процессов растений, биоинформатика. Галина Александровна является автором 70 научных работ.
В 2017 году к преподавательскому коллективу присоединился доцент, к.б.н., Топтиков Валентин Анатольевич. В 1983 году В. А. Топтиков защитил кандидатскую диссертацию по специальности 03.00.03 — молекулярная биология под названием «Взаимодействие экзогенной гомологичной ДНК с изолированным клеточными ядрами из проростков кукурузы». С тех пор Топтиков В. А. более 25 лет плодотворно занимался научной деятельностью в составе Научно-исследовательской группы кафедры генетики и молекулярной биологии и Научно-исследовательской группы Биотехнологического научно-учебного центра ОНУ. На кафедре В. А. Топтиков преподает общие курсы «Теории эволюции», «Методы молекулярной генетики в генной инженерии», раздел ВСП «Использование изоферментного анализа в популяционной генетике». К кругу научных интересов В. А. Топтиков относятся генетико-биохимические механизмы адаптивности растений и животных. Всего по результатам исследований опубликовано более 70 научных публикаций, из них около 15 в научных международных изданиях.
Сейчас преподавательский состав кафедры насчитывает 2 доктора и 7 кандидатов наук. Кафедра обеспечивает общие курсы: «Генетика», «Общая цитология», «Молекулярная биология», «Медицинская генетика», «Генетика и медицина», «Теории эволюции», «Геномика», «Методы молекулярной биологии в биотехнологии», «Биотехнология», «Экологическая генетика и фармакогенетика», «Генетика популяций и эволюция», «Растениеводство», «Биоэтика и биобезопасность». Кроме того, кафедра обеспечивает чтение ряда специальных дисциплин: «Основы генетического анализа», «Молекулярные процессы эволюции», «Биохимическая генетика», «Проблемы мутагенеза», «Цитогенетика», «Молекулярные маркеры», «Генетическая инженерия», «Генетика человека», «Генетика вирусов и бактерий», «Генетические основы селекции», «Генетика поведения», «Иммуногенетика», «Внехромосомная наследственность», «Фармакогенетика», «Молекулярная генетика», «Создание и детекция ГМО», «Регуляторные белки и системы клеток». С середины 1990-х годов на кафедре под руководством В. М. Тоцкого работает госбюджетная научная группа в составе высококвалифицированных ученых – молекулярных биологов, биохимиков – к. б. н. В. А. Топтикова, к. б. н. Л. Ф. Дьяченко, к. б. н. А. М. Ершовой. За годы работы в составе госбюджетной научной группы сотрудники выполнили исследования почти из тридцати фундаментальных тем и прикладных разработок. Основные направления этих исследований связаны с изучением адаптивных комплексов генов у особей популяции в конкретных условиях существования, генетико-биохимических особенностей онтогенеза растений. Учеными группы обосновано использование систем изозимов клеточных ферментов для прогнозирования адаптивных возможностей сельскохозяйственных культур, разработаны и успешно внедрены в практику технологии оптимального культивирования in vitro тканевых эксплантов сортов картофеля, земляники садовой, алоэ и гвоздики.
В настоящее время научная группа изучает генетико-биохимические и морфометрические особенности черноморской рапаны Rapana venosa, как опасного инвазивного вида, с целью оценки степени адаптивности этого моллюска к условиям Черного моря и определения перспектив использования показателей состояния популяций этого животного для общей оценки состояния экосистемы. За время существования научной группы ее учеными опубликовано 80 работ, из них около 10 – за рубежом.
Таким образом, основные направления научных исследований кафедры посвящены таким проблемам:
- Приспособленность и состояние ген-энзимных систем Drosophila melanogaster экспериментальных и природных популяций;
- Динамика генетической структуры исследуемых популяций Drosophila melanogaster при длительном воздействии экологических факторов;
- Взаимодействие генов и их коадаптация по подбору у представителей естественных и экспериментальных популяций растений и животных;
- Анализ экспрессии структурных генов ферментов и других белков в условиях онтогенетической и филогенетической адаптации растений и животных;
- Экспрессивность структурных генов растений при естественной и искусственной полиплоидии;
- Цитогенетические и цитоэмбриологические проявления количественных признаков у растений;
- Мониторинг мутагенных эффектов пестицидов на модельных объектах и сельскохозяйственных культурах;
- Полиморфизм ген-энзимных систем в популяциях отдельных гидробионтов Черноморского бассейна;
- Состояние ген-энзимных систем и адаптационные свойства лекарственных базидиомицетов;
- Молекулярно-генетический анализ генофонда озимой мягкой пшеницы Украины и родственных злаков.
Следует отметить, что качественная подготовка специалистов, магистров и аспирантов, а также выполнение плановых научных исследований кафедры в значительной мере обеспечиваются качественной и квалифицированной работой учебно-вспомогательного персонала кафедры – Мирось З. В., Стрельцовой Н. А., Казур Т. В. и других. С целью обеспечения студентов базами практики для выполнения курсовых, бакалаврских и магистерских работ, а также для выполнения совместных исследований кафедра заключила соглашения с ведущими научно-исследовательскими учреждениями Национальной академии аграрных наук Украины — СГИ НЦНС, Национальным научным центром — «Институтом виноградарства и виноделия имени В. Е. Таирова».
Проблему изучения полиморфизма и адаптивного потенциала отдельных гидробионтов Черного моря кафедра решает в сотрудничестве с кафедрой гидробиологии.
Кроме того, ученые кафедры сотрудничают с учеными Одесского национального медицинского университета, Научно-исследовательского института молекулярно-генетической и клеточной медицины, отделом молекулярной генетики; кафедрой общей и молекулярной генетики биологического факультета Киевского национального университета имени Т. Г. Шевченко; с кафедрой генетики Харьковского национального университета имени В. Н. Каразина, с кафедрой генетики и биотехнологии Львовского национального университета имени Ивана Франко.
Что такое пониженная пенетрантность и переменная экспрессивность ?: MedlinePlus Genetics
Пониженная пенетрантность и переменная экспрессивность — это факторы, которые влияют на эффекты определенных генетических изменений. Эти факторы обычно влияют на расстройства с аутосомно-доминантным типом наследования, хотя иногда они наблюдаются при расстройствах с аутосомно-рецессивным типом наследования.
Пониженная пенетрантность
Пенетрантность — это доля людей с определенным генетическим вариантом (или генной мутацией), у которых проявляются признаки и симптомы генетического заболевания.Если у некоторых людей с этим вариантом не развиваются черты расстройства, считается, что состояние имеет пониженную (или неполную) пенетрантность. Пониженная пенетрантность часто возникает при семейных онкологических синдромах. Например, у многих людей с вариантом гена BRCA1 или BRCA2 , ассоциированного с повышенным риском рака, рак разовьется в течение жизни, а у некоторых — нет. Врачи не могут предсказать, у каких людей с этими вариантами разовьется рак или когда разовьются опухоли.
Пониженная пенетрантность, вероятно, является результатом сочетания генетических факторов, факторов окружающей среды и образа жизни, многие из которых неизвестны. Это явление может затруднить специалистам-генетикам интерпретацию семейной истории болезни человека и прогнозирование риска передачи генетического заболевания будущим поколениям.
Вариативная выразительность
Хотя некоторые генетические заболевания мало изменяются, большинство из них имеют признаки и симптомы, различающиеся у разных людей.Вариативная выразительность относится к ряду признаков и симптомов, которые могут встречаться у разных людей с одним и тем же генетическим заболеванием. Например, признаки синдрома Марфана сильно различаются: у некоторых людей симптомы легкие (например, высокий и худощавый, с длинными тонкими пальцами), у других также возникают опасные для жизни осложнения, затрагивающие сердце и кровеносные сосуды. Хотя признаки сильно различаются, у большинства людей с этим заболеванием есть вариант того же гена ( FBN1 ).
Как и в случае с пониженной пенетрантностью, переменная экспрессивность, вероятно, вызвана сочетанием генетических факторов, факторов окружающей среды и образа жизни, большинство из которых не были идентифицированы. Если генетическое заболевание имеет очень разные признаки и симптомы, его может быть сложно диагностировать.
Пенетрантность и экспрессивность — Введение в генетический анализ
В предыдущем примере генетическая основа зависимости одного гена от другого выводится из четких генетических соотношений.Однако лишь небольшая часть генов геном поддаются такому анализу. Одно важное свойство состоит в том, что мутации не проявляют снижения жизнеспособности или фертильности по сравнению с диким типом, так что частота восстановления классов мутантов и дикого типа не искажена.
Еще одним свойством является то, что разница в норме реакции (см. Главу 1) между мутантным и диким типом должен быть настолько драматичным, чтобы кривые реакции для мутанта и дикого типа, и, следовательно, мы можем надежно использовать фенотип для различения мутантных и генотипы дикого типа со 100% достоверностью.В таких случаях мы говорим, что эта мутация 100% пенетрант. Однако многие мутации показывают неполную пенетрантность. Таким образом, пенетрантность определяется как процент людей с данным генотипом, которые проявляют фенотип, связанный с этим генотип. Например, организм может иметь определенный генотип, но не может экспрессируют соответствующий фенотип из-за модификаторов, эпистатических генов или супрессоры в остальной части генома или из-за модифицирующего эффекта среда. В качестве альтернативы, отсутствие функции гена может по своей сути иметь очень сильные последствия. тонкие эффекты, которые трудно измерить в лабораторных условиях.
Еще одна мера для описания диапазона фенотипической экспрессии называется экспрессивностью. Выразительность измеряет степень, в которой данный генотип выражен на фенотипическом уровне. Другой степени выраженности у разных людей могут быть связаны с различиями в аллельная конституция остальной части генома или факторы окружающей среды. иллюстрирует различие между пенетрантность и выразительность. Как и пенетрантность, выразительность является неотъемлемой частью понятие нормы реакции.
Рисунок 4-23
Эффекты пенетрантности и выразительности через гипотетический характер «интенсивность пигмента». В каждой строке у всех людей есть тот же аллель, скажем, P , что дает им одинаковый «потенциал для производить пигмент ». (подробнее …)
Любой вид генетического анализа, такой как анализ родословной человека и прогнозы в генетическое консультирование, может быть значительно затруднено из-за явления неполной пенетрантности и переменной выразительности.Например, если вызывающий заболевание аллель не является полностью пенетрантным (как это часто бывает), он трудно дать чистый генетический счет здоровья любому человеку, страдающему болезнью родословная (например, особь R в). С другой стороны, анализ родословной может иногда выявляют людей, которые не выражают, но почти наверняка имеют генотип заболевания (например, особь Q в). Точно так же переменная выразительность может сбивать с толку диагноз. Конкретный пример переменной выразительности можно найти в.
СООБЩЕНИЕ
Термины пенетрантность и выразительность количественно оценить модификацию экспрессии генов в зависимости от окружающей среды и генетический фон; они измеряют соответственно процент случаев в какой ген экспрессируется, и уровень экспрессии.
Рисунок 4-24
Отсутствие пенетрантности, проиллюстрированное родословной доминантного аллеля. У особи Q должен быть аллель (потому что он передался ей потомство), но это не выражалось в ее фенотипе.Человек такой поскольку R не может быть уверена, что ее генотип отсутствует (подробнее …)
Рисунок 4-25
Переменная экспрессия, показанная 10 степенями пегой пятнистости у гончих. Каждая из этих собак имеет аллель S P отвечает за пегие пятна у собак. (После Кларенса К. Литтла Наследование окраса шерсти у собак. Корнелл University Press, 1957; и (подробнее …)
Экспрессия генов — обзор
3.3 Базы данных геномной экспрессии
Базы данных экспрессии генов на геномном уровне включают Атлас экспрессии генов мышей (Таблица 1.3; Сиддики и др. ., 2005). Этот атлас обеспечивает доступ к библиотекам последовательного анализа экспрессии генов (SAGE), полученным из эмбрионов мыши на всех стадиях развития, включая оплодотворенные яйца и эмбриональные стволовые (ES) клетки. Подход был разработан для идентификации дифференциально экспрессируемых генов на протяжении эмбриогенеза. Библиотеки SAGE и программное обеспечение DiscoverySpace для анализа общедоступны и содержат ссылки на другие общедоступные базы данных. Гены, представляющие интерес в Атласе экспрессии генов мышей, должны быть локализованы путем ссылки на базы данных экспрессии, которые включают анатомические аннотации.
Таблица 1.3. Геномные библиотеки экспрессии генов
| Мышиный атлас экспрессии генов |
| http://www.mouseatlas.org/data/mouse/devstages |
| GermSAGE: Транскриптом мужской зародышевой клетки |
| http: //germsage.nichd.nih.gov |
| GonadSAGE: Мужской эмбриональный транскриптом гонад |
| http://gonadsage.nichd.nih.gov |
| Атлас экспрессии генов ArrayExpress |
| http: // www.ebi.ac.uk/microarray-as/atlas |
| Омнибус экспрессии генов |
| http://www.ncbi.nlm.nih.gov/geo |
| База данных экспрессии генов в 4D |
| http://4dx.embl.de/4DXpress |
GermSAGE и GonadSAGE предназначены для транскриптома мужских половых клеток и развивающихся мужских гонад мыши, соответственно (Таблица 1.3; Lee et al. , 2009, 2010 ). Для GermSAGE библиотеки получали из сперматогоний типа А, пахитеновых сперматоцитов или круглых сперматид.Для GonadSage библиотеки были сконструированы из гонад самцов мышей, собранных на e10.5, e11.5, e12.5, e13.5, e15.5 и e17.5. База данных с возможностью поиска по названию гена доступна для каждой стадии развития. Локализация генов в зародышевых клетках доступна в GermSAGE, но специфическая для клеток экспрессия в гонадах не аннотирована.
Данные об экспрессии генов, основанные на экспериментах с микрочипами, быстро распространились, и к ним можно получить доступ через различные веб-интерфейсы. К ним относятся Атлас экспрессии генов ArrayExpress, поддерживаемый Европейским институтом биоинформатики, Омнибус экспрессии генов (GEO), поддерживаемый Национальным центром биотехнологической информации (NIH), и база данных экспрессии генов в 4D, поддерживаемая Европейской лабораторией молекулярной биологии (Таблица 1 .3; Barrett и др. ., 2009; Haudry и др. ., 2008; Капушески и др. ., 2010). Конкретные подмножества данных микрочипов, которые могут представлять интерес, включают данные из ряда линий ES-клеток мыши, депонированных в GEO. Исследователи могут загружать наборы данных генов, экспрессируемых в линиях ES-клеток мыши, включая R1, J1, V6.5, гомозиготные мутантные ES-клетки, дифференцированные ES-клетки и т. Д. Открытый доступ к данным об экспрессии генов имеет жизненно важное значение для исследований и может привести к важным открытиям.Например, цифровой дифференциальный дисплей был использован для анализа библиотек экспрессируемых последовательностей тегов в GEO для идентификации генов, специфически экспрессируемых в ES-клетках мыши (Tokuzawa et al. , 2003, 2006). Это исследование привело к созданию мыши с нокаутом Fbx15 , которая сыграла важную роль в идентификации четырех факторов транскрипции ( Pou5f1 , Sox2 , c-myc и Klf4 ), необходимых для создания индуцированных плюрипотентные стволовые клетки из фибробластов мыши (Takahashi and Yamanaka, 2006).
AQA | Биология | Тематическое содержание
Клетки могут контролировать свою метаболическую активность, регулируя транскрипция и трансляция их генома. Хотя клетки в организме несут одинаковые закодированные генетическая информация, они переводят только часть из этого. В многоклеточных организмах этот контроль трансляции позволяет клеткам выполнять специализированные функции, формируя ткани и органы.
Существует множество факторов, контролирующих экспрессию генов и, таким образом, фенотип организмов. Некоторые внешние, факторы окружающей среды, другие — внутренние факторы. Выражение генов не так просто как когда-то думали, с эпигенетической регуляцией транскрипция все чаще признается как важный.
Люди учатся контролировать экспрессию генов, изменяя эпигеном и как изменять геномы и протеомы организмов. Здесь много медицинских и технологические приложения.
Рассмотрение механизмов клеточного контроля подкрепляет содержание этого раздел. Студенты, которые его изучили, должны развить понимание способов какие организмы и клетки контролируют их деятельность.Это должно привести к признательности распространенных заболеваний, возникающих в результате выхода из строя этих механизмов контроля и использования ДНК-технология в диагностике и лечении заболеваний человека.
Изменение последовательности оснований в ДНК может изменить структуру белков (только A-уровень)
Содержание | Возможности повышения квалификации |
|---|---|
Генные мутации могут возникать во время репликации ДНК.Они включают добавление, делецию, замену, инверсию, дупликацию и транслокацию оснований. Мутации генов происходят спонтанно. Скорость мутации увеличивается за счет мутагенных агенты. Мутации могут привести к изменению аминокислотной последовательности в кодируемый полипептид.
Учащиеся должны уметь определять природу гена мутации для его воздействия на кодируемый полипептид. |
Экспрессия гена контролируется рядом функций (только A-level)
Большая часть ДНК клетки не транслируется (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
Тотипотентные клетки могут делиться и производить тела любого типа клетка. Во время развития тотипотентные клетки транслируют только часть своей ДНК, что приводит к специализации клеток. Тотипотентные клетки появляются только в течение ограниченного времени на ранней стадии эмбрионы млекопитающих. Плюрипотентные клетки обнаружены в эмбрионах; мультипотентные и унипотентные клетки встречаются в зрелые млекопитающие и могут делиться, образуя ограниченное количество различных типов клеток.
Студенты должны уметь оценить использование стволовых клеток в лечении заболеваний человека. | AT i Студенты могли производить тканевые культуры эксплантатов цветной капусты ( Brassica oleracea ). |
Регулирование транскрипции и трансляции (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
У эукариот транскрипция генов-мишеней может стимулироваться или подавляться, когда специфические факторы транскрипции перемещаются из цитоплазмы в ядро.Роль стероидного гормона эстрогена в инициации транскрипции. Эпигенетический контроль экспрессии генов у эукариот. Эпигенетика включает наследуемые изменения функции генов без изменений базовой последовательности ДНК. Эти изменения вызваны изменениями в окружающей среде, которые ингибируют транскрипцию:
Актуальность эпигенетики в развитии и лечении заболеваний, особенно рак. У эукариот и некоторых прокариот трансляция мРНК продуцируется от генов-мишеней может подавляться РНК-интерференцией (РНКи). Студенты должны уметь :
|
Экспрессия генов и рак (только уровень A)
Содержание | Возможности повышения квалификации |
|---|---|
Основные характеристики доброкачественных и злокачественных опухолей. Роль в развитии опухолей:
Студенты должны уметь:
|
Использование проектов генома (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
проектов по секвенированию прочитали геномы широкого ряд организмов, включая человека. Определение генома более простых организмов позволяет последовательности белков, которые происходят из генетического кода ( протеом) организма, подлежащего определению.У этого может быть много приложений, включая идентификацию потенциальных антигенов для использование в производстве вакцин. У более сложных организмов наличие некодирующих ДНК и регуляторные гены означают, что знание генома не может быть легко переведен в протеом. Методы секвенирования постоянно обновляются и имеют стать автоматизированным. |
Генные технологии позволяют изучать и изменять функцию генов, позволяя лучше понять функции организма и разработать новые производственные и медицинские процессы (только A-level)
Технология рекомбинантной ДНК (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
Технология рекомбинантной ДНК включает перенос фрагментов ДНК от одного организма или вида к другому.Поскольку генетический код универсален, как и механизмы транскрипции и трансляции, перенесенная ДНК может транслироваться внутри клеток организма-реципиента (трансгенного). Фрагменты ДНК могут быть получены несколькими способами, в том числе:
Фрагменты ДНК могут быть амплифицированы in vitro и in vivo техники. Принципы полимеразной цепной реакции (ПЦР) как метода in vitro для амплификации фрагментов ДНК. Культура трансформированных клеток-хозяев как метод in vivo для амплификации ДНК фрагменты.
Студенты должны уметь:
| AT g Студенты могут исследовать специфичность рестрикционных ферментов с использованием экстрагированной ДНК и электрофореза. |
Различия в ДНК между особями одного вида могут быть использованы для идентификации и диагностики наследственных состояний (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
Использование меченых ДНК-зондов и гибридизация ДНК для определения местоположения конкретных аллелей генов. Использование меченых ДНК-зондов, которые можно использовать для скрининга пациентов на наследственные состояния, реакции на лекарства или риски для здоровья. Использование этой информации в генетическом консультировании и персонализированной медицине. Учащиеся должны уметь оценивать информацию, относящуюся к скринингу людей на генетически обусловленные состояния и реакции на лекарства. |
Генетический отпечаток пальца (только A-level)
Содержание | Возможности повышения квалификации |
|---|---|
Геном организма содержит множество тандемных повторов с переменным числом (VNTR).В вероятность того, что у двух человек будут одинаковые VNTR, очень низкий. Метод генетического дактилоскопирования при анализе фрагментов ДНК, которые были клонирован с помощью ПЦР, и его использование для определения генетических отношений и в определении генетической изменчивости в популяции. Использование генетического дактилоскопирования в области судебной медицины, медицинская диагностика, животноводство и растениеводство. Студенты должны уметь:
| AT g Студенты могли использовать гель-электрофорез для получения «отпечатков пальцев» пищевых красителей. |
Методы экспрессии генов
Экспрессия гена — это строго регулируемый механизм, который контролирует функцию и адаптируемость всех живых клеток, включая прокариот и эукариот.Существует несколько методов изучения и количественной оценки экспрессии генов и ее регуляции. Некоторые из этих методов являются старыми и хорошо зарекомендовавшими себя, в то время как другие являются относительно новыми методами мультиплексирования.
Область анализа экспрессии генов претерпела значительные успехи в биомедицинских исследованиях. Традиционные методы сосредоточены на измерении экспрессии одного гена за раз, а не в каком-либо конкретном биологическом контексте. Однако сегодня методы экспрессии мРНК привели, например, к усовершенствованию идентификации генов и подклассификации болезней.
Методы экспрессии генов
Аналитические методы могут использоваться для изучения уровней экспрессии мРНК или дифференциальной экспрессии мРНК. Некоторые примеры этих методов перечислены ниже.
Методы низкого и среднего сплетения
Репортерный ген
Ген содержит два функциональных сегмента. Один из них — это кодирующая последовательность ДНК, которая содержит инструкции по созданию белка. Другой — это последовательность ДНК, называемая промотором, которая связана с этой кодирующей областью и регулирует транскрипцию гена путем активации или подавления его экспрессии.
Анализ репортерного гена используется для определения регуляторного потенциала неизвестной последовательности ДНК. Это включает в себя промоторную последовательность, связанную с детектируемым репортерным геном, таким как люцифераза, β-галактозидаза или β-глюкуронидаза. Примерами методов, используемых для определения экспрессированного белка репортерного гена, являются флуоресценция, оптическая плотность и люминесценция.
Нозерн-блоттинг
Это метод, используемый для обнаружения определенных молекул РНК, присутствующих в смеси РНК.Нозерн-блоттинг используется при анализе образца РНК из типа клеток или ткани, чтобы определить экспрессию РНК определенных генов.
Вестерн-блоттинг
Вестерн-блоттинг — это метод обнаружения определенных белковых молекул в белковой смеси. Эта смесь может включать все белки, которые связаны с определенным типом клеток или тканью. Этот метод может помочь определить размер белка и его экспрессию.
Флуоресцентная гибридизация in situ (FISH)
Это цитогенетический метод, который можно использовать для идентификации и определения местоположения определенных последовательностей генов.FISH можно использовать для визуализации аберраций числа копий, таких как делеция, транслокация или амплификация хромосом. Этот метод используется в пренатальной диагностике, а также является полезным инструментом для диагностики и прогнозирования различных сарком. Этот метод также используется в дерматологии для оценки атипичных родинок.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР)
Это наиболее чувствительный метод обнаружения и количественной оценки мРНК.С помощью ОТ-ПЦР для количественной оценки мРНК можно использовать очень маленькие размеры выборки, и этот метод фактически может сделать это, используя только одну клетку.
Техники высшего сплетения
Последовательный анализ экспрессии генов (SAGE)
SAGE — это метод, используемый для создания библиотеки коротких тегов последовательностей, каждый из которых может использоваться для обнаружения транскрипции. Уровень экспрессии транскрипта можно определить, оценив, сколько раз обнаруживается каждый тег. Эта технология позволяет проводить всесторонний анализ экспрессии в геноме.
ДНК-микрочип
Микроматрица ДНК, также известная как биочип или ДНК-чип, представляет собой твердую поверхность, к которой прикреплен набор микроскопических пятен ДНК. Микроматрицы используются для определения уровней экспрессии большого количества генов или для выполнения генотипирования в различных областях генома.
РНК Seq
Это относится к методам, используемым для измерения последовательности молекул РНК. Примеры включают дробное секвенирование молекул кДНК, полученных из РНК посредством обратной транскрипции, и технологии, используемые для секвенирования молекул РНК из биологического образца, чтобы можно было определить первичную последовательность и численность каждой молекулы РНК.
Массивы мозаики
Тайлинг-матрица — это тип микрочипа, на котором меченые ДНК или РНК-мишени гибридизуются с зондами, прикрепленными к твердой поверхности. Однако используемые зонды отличаются от зондов, используемых с традиционными микрочипами. Вместо того, чтобы исследовать известные последовательности или предсказанные гены, мозаичные массивы исследуют последовательности, о которых известно, что они присутствуют в прилегающей области. Это может предоставить информацию о регионах, которые секвенированы, но для которых локальные функции в значительной степени неизвестны.
Дополнительная литература
Обзор систем экспрессии белков | Thermo Fisher Scientific
Экспрессия белка относится к способу, которым белки синтезируются, модифицируются и регулируются в живых организмах. В исследованиях белков этот термин может применяться либо к объекту исследования, либо к лабораторным методам, необходимым для производства белков. В этой статье основное внимание уделяется последнему значению выражения белка. Однако с практической точки зрения производство рекомбинантного белка зависит от использования клеточного аппарата.
Просмотр и выбор продуктов
Введение в экспрессию белков
Белки синтезируются и регулируются в зависимости от функциональной потребности клетки. Чертежи белков хранятся в ДНК и декодируются с помощью строго регулируемых процессов транскрипции для производства информационной РНК (мРНК). Сообщение, закодированное мРНК, затем транслируется в белок. Транскрипция — это передача информации от ДНК к мРНК, а трансляция — это синтез белка на основе последовательности, указанной мРНК.
Простая схема транскрипции и перевода. Это описывает общий поток информации от последовательности пар оснований ДНК (гена) к последовательности аминокислотного полипептида (белка).
У прокариот процессы транскрипции и трансляции происходят одновременно. Трансляция мРНК начинается еще до полного синтеза зрелого транскрипта мРНК. Эта одновременная транскрипция и трансляция гена называется сопряженной транскрипцией и трансляцией.У эукариот процессы пространственно разделены и происходят последовательно: транскрипция происходит в ядре, а трансляция или синтез белка происходит в цитоплазме.
Сравнение транскрипции и трансляции у прокариот и эукариот.
Справочник по экспрессии белков
Это 118-страничное руководство содержит исчерпывающую информацию об экспрессии белков и поможет вам выбрать правильную систему экспрессии и технологии очистки для вашего конкретного применения и потребностей.Получите советы и рекомендации перед началом эксперимента и найдите ответы на повседневные проблемы, связанные с экспрессией белка.
Справочник по экспрессии белков ›
Транскрипция и перевод
Транскрипция происходит в три этапа как у прокариот, так и у эукариот: инициация, удлинение и завершение. Транскрипция начинается, когда двухцепочечная ДНК разматывается для связывания РНК-полимеразы. Как только транскрипция инициируется, РНК-полимераза высвобождается из ДНК.Транскрипция регулируется на различных уровнях активаторами и репрессорами, а также структурой хроматина у эукариот. У прокариот не требуется специальной модификации мРНК, и трансляция сообщения начинается еще до завершения транскрипции. Однако у эукариот мРНК подвергается дальнейшему процессингу для удаления интронов (сплайсинга), добавления кэпа на 5´ конце и множественных аденинов на 3´ конце мРНК с образованием полиА-хвоста. Затем модифицированная мРНК экспортируется в цитоплазму, где она транслируется.
Трансляция или синтез белка — это многоступенчатый процесс, для которого требуются макромолекулы, такие как рибосомы, транспортная РНК (тРНК), мРНК и белковые факторы, а также небольшие молекулы, такие как аминокислоты, АТФ, ГТФ и другие кофакторы. Для каждого шага трансляции существуют определенные белковые факторы (см. Таблицу ниже). Общий процесс похож как у прокариот, так и у эукариот, хотя существуют определенные различия.
Во время инициации малая субъединица рибосомы, связанная с инициаторной т-РНК, сканирует мРНК, начиная с 5’-конца, для идентификации и связывания инициирующего кодона (AUG).Большая субъединица рибосомы присоединяется к малой субъединице рибосомы, чтобы генерировать комплекс инициации в кодоне инициации. Белковые факторы, а также последовательности мРНК участвуют в распознавании кодона инициации и формировании комплекса инициации. Во время элонгации тРНК связываются со своими назначенными аминокислотами (так называемая зарядка тРНК) и доставляют их к рибосоме, где они полимеризуются с образованием пептида. Последовательность аминокислот, добавленных к растущему пептиду, зависит от последовательности мРНК транскрипта.Наконец, возникающий полипептид высвобождается на стадии терминации, когда рибосома достигает терминального кодона. В этот момент рибосома высвобождается из мРНК и готова начать следующий раунд трансляции.
Аппарат для синтеза белка
Краткое изложение основных компонентов и характеристик прокариотического и эукариотического трансляционного аппарата.
Компонент | Прокариоты | Эукариоты | |
Рибосомы 9002 40000 9002 9002 Субъединицы 9002 | Матрица или мРНК | Никакой дальнейшей обработки транскрипта мРНК после транскрипции не происходит. мРНК является полицистронной и содержит несколько сайтов инициации. | После транскрипции транскрипт мРНК сплайсируется для удаления некодирующих областей (интронов), и кэп-структура (M7метилгуанозин) и полиаденозиновая последовательность добавляются в 5 ‘и 3’ конце сообщения соответственно. Структура Cap и поли A важны для экспорта мРНК в цитоплазму, правильной инициации трансляции и стабильности мРНК среди других функций.МРНК обычно моноцистронная. |
Особенности трансляции | Последовательность Шайна-Дальгарно присутствует в транскрипте мРНК, а комплементарная последовательность присутствует в субъединице рибосомы. Это облегчает связывание и выравнивание рибосомы на мРНК в сайте инициации трансляции (AUG). Первая аминокислота возникающего полипептида — формилированный метионин. | Инициирование трансляции происходит двумя способами: Кэп-зависимая трансляция: структура кэпа и связывающие кэп белки отвечают за правильное связывание рибосомы с мРНК и распознавание правильного инициирующего кодона.Первый кодон AUG на 5’-конце мРНК функционирует как кодон инициации. Иногда последовательность Козака может присутствовать вокруг инициирующего кодона. Cap-независимая трансляция: Связывание рибосомы с мРНК происходит через «внутренний сайт входа в рибосому» (IRES) на мРНК. | |
Факторы инициации | Известны три фактора инициации, IF1, IF2 и IF3 | Более трех факторов инициации, которые регулируются фосфорилированием.Этап инициации — это этап, ограничивающий скорость трансляции эукариот. | |
Коэффициенты удлинения | EF-Tu и EF-Ts, EF-G | EF1 (α, β, γ) и EF2 | |
Факторы прерывания или разъединения | РФ1 и РФ-2 | ЭРФ-1 |
Посттрансляционная модификация
После трансляции полипептиды модифицируются различными способами для завершения своей структуры, определения их местоположения или регулирования их активности в клетке.Посттрансляционные модификации (ПТМ) представляют собой различные добавления или изменения химической структуры и являются критическими характеристиками общей биологии клетки.
Типы посттрансляционных модификаций включают:
- Сворачивание полипептида в глобулярный белок с помощью белков-шаперонов для достижения самого низкого энергетического состояния
- Модификации присутствующих аминокислот, такие как удаление первого остатка метионина
- Образование или восстановление дисульфидного мостика
- Модификации белков, которые облегчают функции связывания:
- Гликозилирование
- Пренилирование белков для локализации на мембране
- Ацетилирование гистонов для модификации взаимодействий ДНК-гистонов
- Добавление функциональных групп, регулирующих активность белка:
- Фосфорилирование
- Нитрозилирование
- Связывание GTP
Способы экспрессии рекомбинантных белков
В общем, протеомные исследования включают исследование любого аспекта белка, такого как структура, функция, модификации, локализация или взаимодействия белков.Чтобы изучить, как определенные белки регулируют биологию, исследователям обычно требуются средства производства (производства) представляющих интерес функциональных белков.
Учитывая размер и сложность белков, химический синтез не является жизнеспособным вариантом для этой цели. Вместо этого живые клетки и их клеточные механизмы обычно используются как фабрики для создания и конструирования белков на основе предоставленных генетических шаблонов.
В отличие от белков, ДНК просто построить синтетически или in vitro с использованием хорошо зарекомендовавших себя методов рекомбинантной ДНК.Следовательно, ДНК-матрицы конкретных генов с дополнительными репортерными последовательностями или последовательностями аффинных меток или без них могут быть сконструированы в качестве матриц для экспрессии белка. Белки, полученные из таких ДНК-матриц, называются рекомбинантными белками.
Традиционные стратегии экспрессии рекомбинантного белка включают трансфекцию клеток ДНК-вектором, который содержит матрицу, а затем культивирование клеток, чтобы они транскрибировали и транслировали желаемый белок. Обычно затем клетки лизируют, чтобы извлечь экспрессированный белок для последующей очистки.Как прокариотические, так и эукариотические системы экспрессии белка in vivo широко используются. Выбор системы зависит от типа белка, требований к функциональной активности и желаемого выхода. Эти системы экспрессии приведены в таблице ниже и включают в себя млекопитающих, насекомых, дрожжи, бактерии, водоросли и бесклеточные. Каждая система имеет свои преимущества и проблемы, и выбор правильной системы для конкретного применения важен для успешной экспрессии рекомбинантного белка.В следующей таблице представлен обзор систем экспрессии рекомбинантных белков.
Системы экспрессии рекомбинантных белков.
Экспрессия белков млекопитающих
Экспрессионные системы млекопитающих могут быть использованы для получения белков млекопитающих, которые имеют наиболее естественную структуру и активность благодаря физиологически релевантной окружающей среде. Это приводит к высокому уровню посттрансляционной обработки и функциональной активности. Системы экспрессии млекопитающих являются предпочтительной системой для экспрессии белков млекопитающих и могут использоваться для продукции антител, сложных белков и белков для использования в функциональных клеточных анализах.Однако эти преимущества сочетаются с более требовательными условиями выращивания.
Экспрессионные системы млекопитающих могут использоваться для временной продукции белков или через стабильные клеточные линии, где экспрессирующая конструкция интегрируется в геном хозяина. В то время как стабильные клеточные линии можно использовать в нескольких экспериментах, временная продукция может генерировать большое количество белка за одну-две недели. Эти временные высокопроизводительные экспрессионные системы млекопитающих используют суспензионные культуры и могут давать выход в граммах на литр.Кроме того, эти белки имеют больше нативных фолдинговых и посттрансляционных модификаций, таких как гликозилирование, по сравнению с другими системами экспрессии. В следующем примере для экспрессии рекомбинантных белков использовали 3 различных экспрессионных системы млекопитающих.
Выход рекомбинантного белка. Экспрессионные системы Gibco FreeStyle CHO, Expi293 и ExpiCHO использовали для временной экспрессии человеческого IgG, кроличьего IgG и EPO (эритропоэтина) с использованием pcDNA 3.4 вектор экспрессии. Протокол Max Titer использовался для ExpiCHO, и белки собирали на 10–12 день. Для FreeStyleCHO и Expi293 белки собирали на 6 или 7 день. Все белки количественно определяли с помощью ForteBio Octet или ELISA. Использование ExpiCHO приводит к более высоким титрам белка по сравнению с FreeStyle CHO и Expi293.
Посмотрите это видео о том, как производить рекомбинантные белки с помощью системы экспрессии ExpiCHO.
Экспрессия белка насекомых
Клетки насекомых можно использовать для экспрессии белка высокого уровня с модификациями, аналогичными системам млекопитающих.Существует несколько систем, которые можно использовать для получения рекомбинантного бакуловируса, который затем можно использовать для экспрессии представляющего интерес белка в клетках насекомых. Эти системы можно легко масштабировать и адаптировать к суспензионной культуре высокой плотности для крупномасштабной экспрессии белка, который более функционально подобен нативному белку млекопитающих. Хотя выходы могут достигать 500 мг / л, получение рекомбинантного бакуловируса может занимать много времени, а условия культивирования более сложны, чем прокариотические системы.
Сводка протокола системы экспрессии бакуловирусов. В системе экспрессии бакуловирусов Invitrogen BaculoDirect используется технология Invitrogen Gateway для клонирования. После 1-часовой реакции рекомбиназы и трансфекции клеток насекомых продуцируется бакуловирус, содержащий интересующий ген. Затем можно провести быстрый тест на экспрессию, прежде чем увеличивать вирусный запас и увеличивать экспрессию. Использование этой системы позволяет экспрессировать бакуловирус в клетках насекомых.
Экспрессия бактериального белка
Системы экспрессии бактериального белка популярны, потому что бактерии легко культивируются, быстро растут и производят высокие выходы рекомбинантного белка. Однако мультидоменные эукариотические белки, экспрессируемые в бактериях, часто нефункциональны, потому что клетки не оборудованы для выполнения необходимых посттрансляционных модификаций или молекулярного фолдинга. Кроме того, многие белки становятся нерастворимыми в виде телец включения, которые очень трудно восстановить без резких денатурирующих агентов и последующих громоздких процедур рефолдинга белков.В следующем примере систему на основе бактериальных клеток использовали для экспрессии 8 различных рекомбинантных белков.
Экспрессия белка в бактериальных клетках. Клонирование шлюза использовали для клонирования 8 белков человека в вектор Invitrogen Champion pET300 / NT-DEST. BL21 (DE3) E.coli использовали для экспрессии положительных клонов либо в LB + IPTG (1), либо в готовой к использованию среде Invitrogen MagicMedia (2), либо в среде MagicMedia, приготовленной из порошка (3). Образцы лизировали и анализировали на окрашенном красителем кумасси синим красителем Invitrogen NuPAGE 4-12% геле с белком бис-трис.M = стандарт протеина Invitrogen SeeBlue. Использование среды MagicMedia E. coli приводит к более высокому выходу белка для разных образцов.
Внеклеточная экспрессия белка
Внеклеточная экспрессия белка — это синтез белка in vitro и с использованием трансляционно-совместимых экстрактов целых клеток. В принципе, экстракты целых клеток содержат все макромолекулы и компоненты, необходимые для транскрипции, трансляции и даже посттрансляционной модификации.Эти компоненты включают РНК-полимеразу, регуляторные белковые факторы, факторы транскрипции, рибосомы и тРНК. При добавлении кофакторов, нуклеотидов и специфической генной матрицы эти экстракты могут синтезировать интересующие белки за несколько часов.
Несмотря на то, что бесклеточные системы экспрессии белка in vitro или трансляции in vitro (IVT) не являются устойчивыми для крупномасштабного производства, они имеют ряд преимуществ по сравнению с традиционными системами in vivo . Бесклеточная экспрессия позволяет быстро синтезировать рекомбинантные белки без хлопот с культивированием клеток.Бесклеточные системы позволяют маркировать белки модифицированными аминокислотами, а также экспрессировать белки, которые подвергаются быстрой протеолитической деградации внутриклеточными протеазами. Кроме того, бесклеточный метод упрощает одновременную экспрессию множества различных белков (например, тестирование мутаций белка путем экспрессии в небольшом масштабе из множества различных матриц рекомбинантной ДНК). В этом репрезентативном эксперименте использовали систему IVT для экспрессии белка каспазы 3 человека.
Экспрессия каспазы-3 в системе IVT человека. каспаза-3 была экспрессирована с использованием набора Thermo Scientific для одностадийной человеческой высокопроизводительной IVT (Human IVT) и в E. coli (рекомбинантный). Активность каспазы-3 определяли с использованием равных количеств белка. Белок каспазы-3, экспрессируемый с помощью системы IVT, был более активен по сравнению с белком, экспрессируемым в бактериях.
Химический синтез белка
Химический синтез белков может использоваться для приложений, требующих белков, меченных неприродными аминокислотами, белков, меченных в определенных местах, или белков, токсичных для биологических систем экспрессии.Химический синтез дает очень чистый белок, но работает только с небольшими белками и пептидами. При химическом синтезе выход часто бывает довольно низким, а для более длинных полипептидов этот метод непомерно дорог.
- Иматака Х., Миками С. (2009) Преимущества систем бесклеточного синтеза белков, полученных из клеток человека. Seikagaku 81 (4): 303–7.
- Mikami S et al. (2008) Полученная из клеток человека , сопряженная in vitro система транскрипции / трансляции, оптимизированная для продукции рекомбинантных белков. Protein Expr Purif 62 (2): 190–8.
- Кобаяши Т. и др. (2007) Улучшенная бесклеточная система синтеза пикорнавирусов. J Virol методы 142 (1-2): 182–8.
- Mikami S et al. (2006) Основанная на гибридоме система трансляции in vitro , которая эффективно синтезирует гликопротеины. J Biotechnol 127 (1): 65–78.
- Mikami S et al. (2006) Эффективная система бесклеточной трансляции млекопитающих, дополненная факторами трансляции. Protein Expr Purif 46 (2): 348–57.
Прорыв открывает область исследований, потенциальные возможности для медицины — ScienceDaily
Группа ученых Чикагского университета обнаружила ранее неизвестный способ воплощения наших генов в реальность.
Вместо односторонних указаний от ДНК к РНК и белкам, последнее исследование показывает, что сама РНК модулирует способ транскрибирования ДНК — используя химический процесс, который становится все более важным для биологии. Это открытие имеет важное значение для нашего понимания болезней человека и дизайна лекарств.
«Похоже, это фундаментальный путь, о котором мы не знали. Каждый раз, когда это происходит, он обещает открыть совершенно новые направления исследований и исследований», — сказал профессор Чуан Хе.
Человеческое тело — один из самых сложных механизмов из существующих. Каждый раз, когда вы даже почесываете нос, вы используете более сложную конструкцию, чем любой ракетный корабль или суперкомпьютер, когда-либо созданный. Нам потребовались столетия, чтобы разобраться в том, как это работает, и каждый раз, когда кто-то открывает новый механизм, появляется еще несколько загадок человеческого здоровья, и становятся доступными новые методы лечения.
Например, в 2011 году он открыл новое направление исследований, открыв особый процесс, называемый обратимым метилированием РНК, который играет решающую роль в экспрессии генов.
Картина, которую многие из нас помнят, обучение в школе представляет собой упорядоченное развитие: ДНК транскрибируется в РНК, которая затем производит белки, которые выполняют реальную работу живых клеток. Но оказывается, что морщин много.
Его команда обнаружила, что молекулы, называемые матричной РНК, ранее известные как простые курьеры, передающие инструкции от ДНК к белкам, на самом деле оказывают собственное влияние на производство белка.Это происходит с помощью обратимой химической реакции, называемой метилированием; Его главный прорыв показал, что это метилирование обратимо. Это не была одноразовая односторонняя транзакция; его можно было стереть и перевернуть.
«Это открытие открыло нам путь в современную эру исследований модификаций РНК, которая в последние несколько лет стала действительно бурной», — сказал Хе. «Вот как критически страдает экспрессия генов. Это влияет на широкий спектр биологических процессов — обучение и память, циркадные ритмы, даже на что-то столь фундаментальное, как то, как клетка дифференцируется, скажем, в клетку крови по сравнению с нейроном. .«
КомандаHe также идентифицировала и охарактеризовала ряд белков-«читателей», которые распознают метилированную мРНК и влияют на стабильность и трансляцию целевой мРНК.
Но когда лаборатория Хэ работала с мышами, чтобы понять механизмы, они начали понимать, что метилирование информационной РНК не может полностью объяснить все, что они наблюдали.
Это было отражено в других экспериментах. «Данные, поступающие от сообщества, говорят о том, что есть что-то еще, что-то чрезвычайно важное, чего мы упускаем — что критически влияет на многие ранние события развития, а также на такие человеческие заболевания, как рак», — сказал он.
Команда Хэ обнаружила, что группа РНК, называемая хромосомно-ассоциированными регуляторными РНК, или карРНК, использует один и тот же процесс метилирования, но эти РНК не кодируют белки и не участвуют напрямую в трансляции белков. Вместо этого они контролировали, как хранится и транскрибируется сама ДНК.
«Это имеет большое значение для фундаментальной биологии», — сказал он. «Он напрямую влияет на транскрипцию генов, а не только на некоторые из них. Он может вызвать глобальное изменение хроматина и влияет на транскрипцию 6000 генов в исследуемой нами клеточной линии.«
Он видит важные последствия для биологии, особенно для здоровья человека — от определения генетической основы болезни до лучшего лечения пациентов.
«Есть несколько биотехнологических компаний, активно разрабатывающих низкомолекулярные ингибиторы метилирования РНК, но прямо сейчас, даже если мы успешно разработаем методы лечения, у нас нет полной механической картины того, что происходит», — сказал он. «Это дает огромную возможность помочь в определении показаний к заболеваниям для тестирования ингибиторов и предложить новые возможности для фармацевтических препаратов.«
«Их прорыв — это только начало», — сказал Он. «Я считаю, что это представляет собой концептуальное изменение», — сказал он. «Подобные барьеры трудно преодолеть, но как только вы это сделаете, все вытекает отсюда».
История Источник:
Материалы предоставлены Чикагским университетом . Оригинал написан Луизой Лернер. Примечание. Содержимое можно редактировать по стилю и длине.

 выразительность Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011. экспрессивность сущ., кол во синонимов: 13 … Словарь синонимов
выразительность Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011. экспрессивность сущ., кол во синонимов: 13 … Словарь синонимов
 expressio выражение) совокупность семантико стилистических признаков единицы языка, которые обеспечивают её способность выступать в коммуникативном акте как средство субъективного выражения отношения говорящего к содержанию или… … Лингвистический энциклопедический словарь
expressio выражение) совокупность семантико стилистических признаков единицы языка, которые обеспечивают её способность выступать в коммуникативном акте как средство субъективного выражения отношения говорящего к содержанию или… … Лингвистический энциклопедический словарь