Характеристика предприятия — структура, требования, примеры
Зачем нужна характеристика предприятия
Характеристика предприятия составляется студентом после прохождения производственной или преддипломной практики. Она входит в обязательный пакет документов, сопровождающих отчет о прохождении практики вместе с дневником практики и характеристикой студента.
Характеристика предприятия позволяет получить общее представление об организации, оценку текущего положения дел, анализ перспектив и рекомендации по улучшению показателей.
Она составляется на основе официальных данных о работе предприятия. Эта информация находится на сайте и у руководства организации, необходимые цифры берутся из отчетов, устава, приказов и т.д.
Нужна помощь в написании отчета?
Мы — биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Поможем с характеристой и презентацией. Правки внесем бесплатно.
Подробнее
Виды характеристики предприятия
В зависимости от того, какому аспекту уделяется большее внимание, выделяются следующие виды характеристики предприятия:
- организационно-экономическая;
- технико-экономическая;
- экономическая;
- краткая финансовая;
- краткая экономическая.
Структура характеристики
Характеристика предприятия строится по установленному плану: от общих данных к конкретным показателям.
Общее описание предприятия
Здесь указывается общая информация о названии, виде организации, дате его основания. Также упоминается организационно-правовая форма предприятия, его цели, права, учредители, уставной капитал, внешняя и внутренняя структура. Описываются филиалы (если есть), дочерние предприятия.
Если в компании не говорят, какой у них уставной капитал, то это можно узнать онлайн на сайте налоговой (Скачать)
Специфика деятельности предприятия
В этом пункте анализируются товары или услуги, которые производит или оказывает предприятие. Обосновывается выбор направления деятельности и ассортимента.
Обосновывается выбор направления деятельности и ассортимента.
Список товаров или услуг и прайс компании можно вынести в приложение (Скачать)
Стратегия развития
Описывается стратегическая программа развития организации в современных условиях. При этом обязательно анализируется конкурентоспособность, рекламные кампании, насколько компания приспособлена к изменениям на рынке, маркетинговые исследования.
Информация в разделе подтверждается актуальными данными не старше 5 лет (Скачать)
Фаза жизненного цикла
На момент исследования предприятия студентом оно находится в определенной фазе экономического развития. Стадии жизненного цикла предприятия: зарождение, рост, зрелость и упадок.
Скорее всего, сами сотрудники не знают, в какой фазе находится их компания. Придется анализировать самостоятельно (Скачать)
Показатели, определяющие стадию жизненного цикла: финансовая политика, маркетинг, кадровая политика, функциональные приоритеты, используемые стандарты и методы контроля.
Организационная структура
Исследуется эффективность управления предприятием, его структурными подразделениями и связь между ними. Описывается соотношение числа работников всех категорий: управляющих, специалистов, служащих и т.д. Анализируется рациональность выбранного подхода и предлагаются пути совершенствования организационной структуры.
Если в компании используется управленческое ПО, опишите принципы его работы и его роль в оптимизации управленческих процессов (Скачать)
Анализ эффективности
Последний раздел характеристики предприятия фактически подводит итог изучения его деятельности. В этом пункте говорится об эффективности предприятия на рынке, его конкурентоспособности, перспективах развития. Также предлагаются способы изменений в работе и управлении, если это необходимо.
Сами руководители бизнеса не всегда в состоянии оценить эффективность своей компании. Еще реже они нанимают сторонних бизнес-консультантов и аудиторов, поэтому не ждите тут помощи, анализируйте сами (Скачать)
Рекомендации по составлению характеристики
Совет 1. Изучите общедоступную информацию о компании
Изучите общедоступную информацию о компании
Сюда входят: устав, годовые отчеты, приказы и иные официальные документы. Как правило, подобная информация носит открытый характер и размещается на сайте организации. Если текущая документация недоступна из-за коммерческой или иной тайны, можете обратиться к данным последних пяти лет. Данные старше 5 лет считаются неактуальными из-за изменения ситуации на рынке.
Совет 2. Сделайте план характеристики заранее
Составляйте план характеристики до того, как закончите проходить производственную практику (если она у вас есть). Возможно, вам потребуется уточнить некоторые детали у руководства или сотрудников, и это проще сделать без дополнительных поездок в организацию.
Совет 3. Изучите работу других организаций такого же масштаба и профиля
В сравнении можно будет корректно оценить конкурентоспособность и рентабельность организации, а также порекомендовать пути улучшения работы.
Примеры характеристик предприятия
Выводы
Характеристика предприятия — это описание и анализ его деятельности по итогам производственной практики или преддипломного исследования организации.
Характеристика включает общие сведения о предприятии, специфику деятельности, стратегию развития, фазу жизненного цикла и организационную структуру. По итогам полученной информации проводится анализ деятельности предприятия и рекомендуются дальнейшие пути развития.
Эссе: Характеристики деятельности педагога-новатора
Эссе
Характеристики деятельности педагога-новатора
При описании характеристики деятельности педагога-новатора, на глаза попалось высказывание К.МакОлифф, американской учительницы и астронавта: «Я прикасаюсь к будущему. Я учу». А кто он, педагог-новатор? Каковы его цели, задачи, формы работы?
На мой взгляд — это педагог, который воплощает в жизнь новые идеи в педагогической деятельности. Новатор-от латинского novator, обновитель. Значит, педагог-новатор, это педагог, осуществляющий новые, прогрессивные приёмы, идеи, принципы в педагогическую копилку. По мнению доктора педагогических наук, В.И.Андреева: личность педагога-новатора характеризуется «одержимостью, неутолимой любознательностью, умением мыслить системно и в то же время являться генератором идей».
Новатор-от латинского novator, обновитель. Значит, педагог-новатор, это педагог, осуществляющий новые, прогрессивные приёмы, идеи, принципы в педагогическую копилку. По мнению доктора педагогических наук, В.И.Андреева: личность педагога-новатора характеризуется «одержимостью, неутолимой любознательностью, умением мыслить системно и в то же время являться генератором идей».
Основная цель педагога-новатора, по моему мнению, состоит в следующем: создать, организовать и реализовать такую образовательную деятельность, которая бы позволила получать качественно новые продукты педагогической деятельности, результаты, которые на сегодняшний день востребованы государством. И конечно же были направлены на самостоятельное и креативное мышление детей. В ходе обсуждения правительством Российской Федерации проблемы дефицита и снижение престижа профессиональных компетенций была разработана «Стратегия развития системы подготовки рабочих кадров и формирования прикладных квалификаций» на период до 2020 года.
А значит задачами педагога-новатора является изменить энциклопедическую, заключенную в рамочки, образовательную ориентацию, на компетентную и ориентированную сферу. На IX Международной научной конференции в докладе «Российское образование 2020» были обозначены современные перспективы отечественного образования. А именно задачи, которые требуют у обучающихся развития мышления, коммуникативность, толерантность, способность самостоятельно принимать решения и нести ответственность, быстро ориентироваться в информационном потоке и др.
Из вышеперечисленного ясно, что формы работы педагога-новатора состоят в том, чтобы разработанные учебные программы, пособия, учебные материалы для организации образовательной деятельности, основанные на самостоятельности выбора решения, творческая реализация поставленных целей, соответствовали запросам времени и направлены на развитие креативности и лабильности мышления обучающихся.
«Будущего нет. Оно делается нами»- писал великий русский писатель и мыслитель Л.Н.Толстой. Какими бы новым технологиями и стандартами не обладал педагог, он должен помнить: добро идет от сердца. Поэтому настоящий, педагог с большой буквы, должен руководствоваться принципом: жить в гармонии с миром, согревая его своей добротой, любовью и заботой.
16. Основные виды деятельности, их характеристика » Шпоры для студентов
Различают три генетически сменяющих друг друга и сосуществующих на протяжении всего жизненного пути вида деятельности: игру, учение и труд. Они различаются по конечным результатам (продукту деятельности), по организации, по особенностям мотивации.
Игра не создает общественно значимого продукта. В игре начинается формирование человека как субъекта деятельности, и в этом ее огромное, непреходящее значение. Обучение является непосредственной подготовкой личности к труду, развивает ее умственно, физически, эстетически и лишь на конечном этапе освоения профессии связано с созданием материальных и культурных ценностей.
В психическом развитии ребенка игра выступает прежде всего как средство овладения миром взрослых. В ней на достигнутом ребенком уровне психического развития происходит освоение объективного мира взрослых. Игровая ситуация включает в себя замещения (вместо людей — кукла) , упрощения (обыгрывается, например, внешняя сторона приема гостей). В игре, таким образом, огрубленно имитируется действительность, что позволяет ребенку впервые самому стать субъектом деятельности.
Учение — это процесс систематического овладения знаниями, навыками, умениями, необходимыми в конечном счете для выполнения трудовой деятельности, для воспитания гражданской зрелости. В учебной деятельности участвуют непременно два лица: учитель и учащийся. Но это не просто передача знаний от одного к другому. Это прежде всего процесс активного овладения знаниями, умениями и навыками под руководством учителя. Учение должно быть развивающим. Сообщая учащимся знания, преподаватель учит их мыслить и наблюдать, выражать понятое в речи. Ученик овладевает не только знаниями, но и способом самостоятельно мыслить, добывать знания. Хорошо организованное обучение носит воспитывающий характер. В процессе обучения формируется личность ученика: ее направленность, волевые черты характера, способность и т. д.
В учебной деятельности участвуют непременно два лица: учитель и учащийся. Но это не просто передача знаний от одного к другому. Это прежде всего процесс активного овладения знаниями, умениями и навыками под руководством учителя. Учение должно быть развивающим. Сообщая учащимся знания, преподаватель учит их мыслить и наблюдать, выражать понятое в речи. Ученик овладевает не только знаниями, но и способом самостоятельно мыслить, добывать знания. Хорошо организованное обучение носит воспитывающий характер. В процессе обучения формируется личность ученика: ее направленность, волевые черты характера, способность и т. д.
Труд — деятельность, направленная на создание общественно полезного продукта, удовлетворяющего материальные или духовные потребности людей. В трудовой деятельности раскрываются, по словам Маркса, “человеческие сущностные силы”. Участвуя в создании продуктов труда, человек вступает в существующую систему производственных отношений, у него формируются отношение к трудовой деятельности, мотивы труда.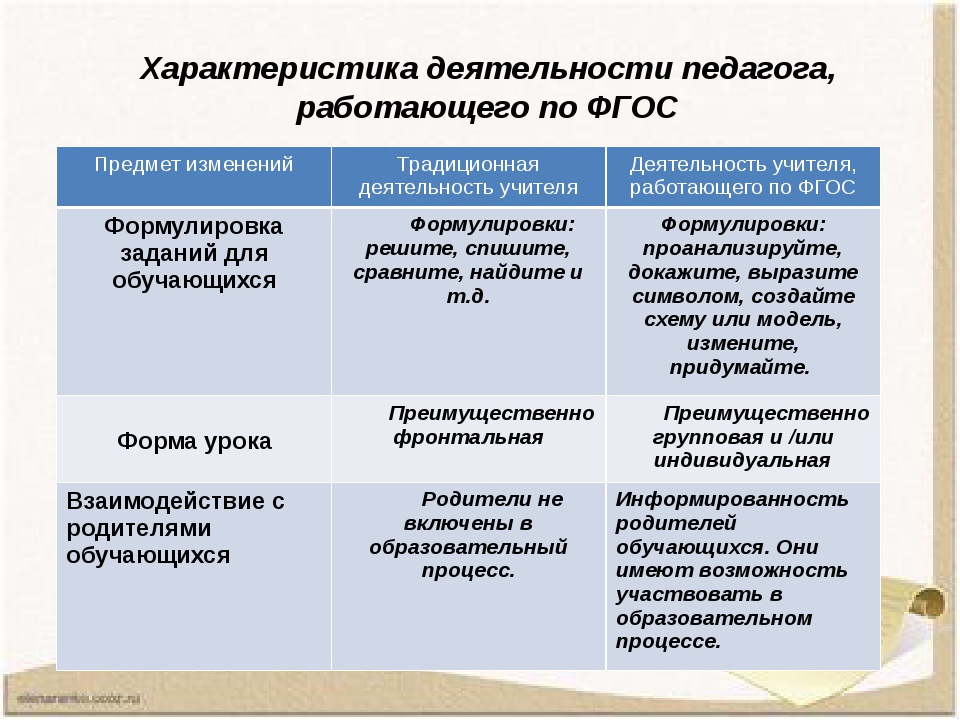
Долгосрочные изменения в структуре собственности крупнейших российских компаний и их влияние на характеристики деятельности
Структурное подразделение: Лаборатория анализа институтов и финансовых рынков (Абрамов А.Е.)
Руководитель работ: Абрамов Александр Евгеньевич — к.э.н., заведующий лабораторией анализа институтов и финансовых рынков ИПЭИ
Сроки выполнения: 2018 год
Актуальность исследования: Несмотря на то, что проблемы влияния структуры собственности на показатели деятельности компаний изучены весьма обстоятельно, в российской академической литературе имеет место явный дефицит исследований данной проблемы с учетом современных тенденций. При этом проблемы эффективности влияния концентрации собственности и ее структуры на показатели деятельности компаний, особенно, что касается влияния государственной собственности, имеют первоочередное значение с точки зрения мер в области государственной политики приватизации и экономической политики в целом. С учетом ранее проведенных исследований планируется существенно расширить изучаемую выборку российских компаний, усовершенствовать методологии оценки характеристик их деятельности с учетом использования производственной функции, более подробно изучить проблемы концентрации собственности российских компаний, ее оправданности и причин ее роста.
С учетом ранее проведенных исследований планируется существенно расширить изучаемую выборку российских компаний, усовершенствовать методологии оценки характеристик их деятельности с учетом использования производственной функции, более подробно изучить проблемы концентрации собственности российских компаний, ее оправданности и причин ее роста.
Основная цель исследования: Оценить масштаб концентрации структуры собственности и присутствия различных групп собственников в структуре капитала компаний и влияние данных факторов на различные характеристики деятельности российских компаний.
Основные фундаментальные и прикладные задачи, решаемые в рамках исследования:
- Формирование методологии расчета недооценки акций и облигаций российских эмитентов
- Формирование методологии анализа премии за риск при вложениях в акции и облигации национальных эмитентов;
- Выявление основных факторов, влияющих на недостаточную привлекательность вложений в акции и облигации российских эмитентов со стороны разных групп инвесторов;
- формулировка предложений по повышению инвестиционной привлекательности вложений в российские ценные бумаги.

Наставничество как особый вид педагогической деятельности: сущностные характеристики и структура
Вестник Новосибирского государственного педагогического университета, 2017, Т. 7, № 5, С. 25–36
© Дудина Е. А., 2017
Наставничество как особый вид педагогической деятельности: сущностные характеристики и структура
1 Новосибирский государственный педагогический университет
Аннотация:
Проблема и цель. В статье рассматривается наставничество как особый вид педагогической деятельности. Целью исследования является определение сущностных характеристик наставничества применительно для большинства контекстов его практической реализации через раскрытие структуры наставнической деятельности.
Методология. Методология исследования включает анализ зарубежной и отечественной психолого-педагогической научной литературы по проблематике наставничества, контент-анализ, обобщение и систематизацию полученных данных.
Результаты. Проведённый анализ научной литературы позволил определить наставничество как особый вид педагогической деятельности, характеризующейся интегративностью, основанной на поддержке и сотрудничестве, и направленной на удовлетворение индивидуальных потребностей её участников. Выявлены сущностные характеристики наставничества вне зависимости от контекстов его практической реализации: целенаправленность, субъектность, ориентация на индивидуальные потребности и самореализацию, взаимонаправленность, добровольность, принятие своей роли наставником и подопечным, развивающий и взаимообогащающий потенциал, аутентичность обучающей и развивающей среды в совместной деятельности, единство трёх укрупнённых функций (психосоциальной, инструментальной и эталонной), долговременность. Эти сущностные характеристики раскрываются в рамках следующих компонентов структуры наставнической деятельности: субъекты наставнической деятельности, их характеристики, роли, мотивы, факторы и принципы успешного взаимодействия; цели и результаты наставнической деятельности; основные контексты реализации; этапы; методы. Автором уточнено определение понятия «наставничество» применительно к большинству контекстов его практической реализации.
Автором уточнено определение понятия «наставничество» применительно к большинству контекстов его практической реализации.
Заключение. Обобщаются существенные характеристики феномена наставничества, определение понятия «наставничество», структурные компоненты наставнической деятельности.
Ключевые слова:
наставничество; наставническая деятельность; наставник; сущностные характеристики наставничества; структура наставнической деятельности; цели наставнической деятельности; методы наставничества; роль наставника
https://www.scopus.com/record/display.uri?src=s&origin=cto&ctoId=CTODS_1…
Библиографическая ссылка:
Дудина Е. А. Наставничество как особый вид педагогической деятельности: сущностные характеристики и структура // Вестник Новосибирского государственного педагогического университета. – 2017. – № 5. – С. 25–36. DOI: http://dx.doi.org/10.15293/2226-3365.1705.02Список литературы:
- Allen T. D. Mentoring others: A dispositional and motivational approach // Journal of Vocational Behavior.
 – 2003. – Vol. 62, Issue 1. – P. 134–154. DOI: https://dx.doi.org/10.1016/S0001-8791(02)00046-5
– 2003. – Vol. 62, Issue 1. – P. 134–154. DOI: https://dx.doi.org/10.1016/S0001-8791(02)00046-5 - Anderson E. M., Shannon A. L. Towards a conceptualization of mentoring // Journal of Teacher Education. – 1988. – Vol. 39, № 1. – P. 38–42. DOI: http://dx.doi.org/10.1177/002248718803900109
- Carmin C. N. Issues on research on mentoring: definitional and methodological // International Journal of Mentoring. – 1988. – Vol. 2 (2). – P. 9–13. https://eric.ed.gov/?id=EJ384929
- Eby L. T., Allen T. D., Evans S. C., Ng T., DuBois D. L. Does mentoring matter? A multidisciplinary meta-analysis comparing mentored and non-mentored individuals // Journal of Vocational Behavior. – 2008. – Vol. 72, Issue 2. – P. 254–267. DOI: https://dx.doi.org/10.1016/j.jvb.2007.04.005
- Gehrke N. Toward a definition of mentoring // Theory into practice. – 1988. – Vol. 27 (3). – P. 190–194. DOI: http://dx.doi.org/10.1080/00405848809543350
- Goldner L.
 , Mayseless O. Juggling the roles of parents, therapists, friends and teachers – a working model for an integrative conception of mentoring // Mentoring and Tutoring: Partnership in Learning. – 2008. – Vol. 16 (4). – P. 412–428. DOI: https://dx.doi.org/10.1080/13611260802433783
, Mayseless O. Juggling the roles of parents, therapists, friends and teachers – a working model for an integrative conception of mentoring // Mentoring and Tutoring: Partnership in Learning. – 2008. – Vol. 16 (4). – P. 412–428. DOI: https://dx.doi.org/10.1080/13611260802433783 - Ghosh R. Antecedents of mentoring support: a meta-analysis of individual, relational, and structural or organizational factors // Journal of Vocational Behavior. – 2014. – Vol. 84 (3). – P. 367–384. DOI: https://dx.doi.org/10.1016/j.jvb.2014.02.009
- Grassinger P., Porath M., Ziegler A. Mentoring the gifted: a conceptual analysis // High Ability Studies. – 2010. – Vol. 21 (1). – P. 27–46. DOI: https://dx.doi.org/10.1080/13598139.2010.488087
- Haensly P. A., Parsons J. L. Creative, intellectual, and psychosocial development through mentorship: Relationships and stages // Youth and Society. – 1993. – Vol. 25 (2).
 – P. 202–221. DOI: https://dx.doi.org/10.1177/0044118X93025002002
– P. 202–221. DOI: https://dx.doi.org/10.1177/0044118X93025002002 - Jacobi M. Mentoring and undergraduate academic success: a literature review // Review of Educational Research. – 1991. – Vol. 61 (4). – P. 505–532. DOI: https://dx.doi.org/10.3102/00346543061004505
- James J. M., Rayner A., Bruno J. Are You My Mentor? New Perspectives and Research on Informal Mentorship // The Journal of Academic Librarianship. – 2015. – Vol. 41 (5). – P. 532–539. DOI: https://dx.doi.org/10.1016/j.acalib.2015.07.009
- Kram K. E. Phases of the mentor relationship // Academy of Management Journal. – 1983. – Vol. 26, № 4. – P. 608–625. DOI: https://dx.doi.org/10.2307/255910
- Kroll J. Requisite participant characteristics for effective peer group mentoring // Mentoring and Tutoring: Partnership in learning. – 2017. – Vol. 25 (1). – P. 78–96. DOI: http://dx.doi.org/10.1080/13611267.2017.1308096
- Larsson M.
 , Pettersson C., Eriksson Ch., Skoog Th. Initial motives and organizational context enabling female mentors’ engagement in formal mentoring – A qualitative study from the mentors’ perspective // Children and Youth Services Review. – 2016. – Vol. 71. – P. 17–26. DOI: https://dx.doi.org/10.1016/j.childyouth.2016.10.026
, Pettersson C., Eriksson Ch., Skoog Th. Initial motives and organizational context enabling female mentors’ engagement in formal mentoring – A qualitative study from the mentors’ perspective // Children and Youth Services Review. – 2016. – Vol. 71. – P. 17–26. DOI: https://dx.doi.org/10.1016/j.childyouth.2016.10.026 - McBride A. B., Campbell J., Woods N. F., Manson S. M. Building a mentoring network // Nursing Outlook. – 2017. – Vol. 65 (3). – P. 305–314. DOI: https://dx.doi.org/10.1016/j.outlook.2016.12.001
- Mena J., Hennissen P., Loughran J. Developing pre-service teachers’ professional knowledge of teaching: The influence of mentoring // Teaching and Teacher Education. – 2017. – Vol. 66. – P. 47–59. DOI: https://dx.doi.org/10.1016/j.tate.2017.03.024
- Merriam S. Mentors and protégés // Adult Education Quarterly. – 1983. – Vol. 33 (3). – P. 161–173. DOI: https://dx.doi.org/10.1177/074171368303300304
- Rhodes J.
 , Spencer R. Structuring mentoring relationships for competence, character, and purpose // New Directions for Youth Development. – 2010. – Vol. 2010, Issue 126. – P. 149–152. DOI: http://dx.doi.org/10.1002/yd.356
, Spencer R. Structuring mentoring relationships for competence, character, and purpose // New Directions for Youth Development. – 2010. – Vol. 2010, Issue 126. – P. 149–152. DOI: http://dx.doi.org/10.1002/yd.356 - Roberts A. Mentoring revisited: a phenomenological reading of the literature // Mentoring and Tutoring. – 2000. – Vol. 8 (2). – P. 145–170. DOI: http://dx.doi.org/10.1080/713685524
- Sander M. The effects of high-quality student mentoring // Economics Letters. – 2015. – Vol. 136. – P. 227–232. DOI: https://dx.doi.org/10.1016/j.econlet.2015.09.043
- Schunk D. H., Mullen C. A. Toward a Conceptual Model of Mentoring Research: Integration with Self-Regulated Learning // Educational Psychology Review. – 2013. – Vol. 25, Issue 3. – P. 361–389. DOI: https://dx.doi.org/10.1007/s10648-013-9233-3
- Ruggiero D., Boehm J. D. Project-based learning in a virtual internship programme: A study of the interrelated roles between intern, mentor and client // Computers and Education.
 – 2017. – Vol. 110. – P. 116–126. DOI: https://dx.doi.org/10.1016/j.compedu.2017.03.011
– 2017. – Vol. 110. – P. 116–126. DOI: https://dx.doi.org/10.1016/j.compedu.2017.03.011 - Yamamoto K. To See Life Grow: The Meaning of Mentorship // Theory Into Practice. – 1988. – Vol. 27 (3). – P. 183–189. URL: http://www.jstor.org/stable/1477189
- Круглова И. В. Наставничество в повышении профессиональной компетентности молодого учителя // Педагогическое образование и наука. – 2007. – № 1. – С. 25–27.
- Чарина Е. В. Руководство научной работой студентов как наставническая деятельность // Проблемы высшего образования. – 2004. – Т. 1, № 1. – С. 95–98.
Дата публикации 31.10.2017
1. Основные характеристики деятельности предприятия. Характеристика информационной, рекламной и PR деятельности предприятия ЗАО «МеталлСервис»
Похожие главы из других работ:
Анализ и совершенствование товарной политики предприятия на примере ООО «ОМНИ»
1.2.
 Основные виды деятельности предприятия
Основные виды деятельности предприятияООО «ОМНИ» является оптовой организацией реализующей в розничную торговую сеть рыбную продукцию. Схематично основные виды деятельности предприятия представлены на рисунке 1…
Анализ маркетинговой среды предприятия
1.1 Маркетинговая среда предприятия, её сущность и основные характеристики
Как метко заметил один ученый, «среда организации — это вселенная элементов». «Вселенная элементов» означает не только огромное их количество, но и их единство в сложной системе, частью которой является организация. Очевидно…
Анализ рекламной деятельности кафе «Изюм» ООО «Мартос» в условиях конкуренции
1.2 Конкурентоспособность предприятия общественного питания: основные характеристики
В условиях рынка нереально добиться стабильного успеха в бизнесе, если не планировать его эффективное развитие, не аккумулировать постоянно информацию о собственных перспективах и возможностях, о состоянии целевых рынков. ..
..
Анализ финансового состояния торгового предприятия ИП «Одежда»
3.1 Основные показатели деятельности предприятия
Финансовое положение предприятия обуславливается в немалой степени его деловой активностью. В критерии деловой активности включаются показатели, отражающие качественные и количественные стороны развития деятельности предприятия…
Маркетинговая деятельность типографии ООО «ЕК-Принт»
1. Основные характеристики предприятия
…
Маркетинговая среда организации
1.3 Внешняя среда предприятия. Понятие, классификация и основные характеристики. Влияние внешней среды на предприятие
Макросреда — это совокупность факторов, оказывающих влияние микросреду. В настоящее время на принципах маркетинга строит свои системы управления подавляющее большинство компаний США, Японии, Западной Европы…
Маркетинговая среда предприятия
1.1 Внешняя среда предприятия.
 Понятие, классификация и основные характеристики. Влияние внешней среды на предприятие
Понятие, классификация и основные характеристики. Влияние внешней среды на предприятиеВ настоящее время на принципах маркетинга строит свои системы управления подавляющее большинство компаний США, Японии, Западной Европы. Модифицируются организационные структуры…
Маркетинговое исследование компании Franke
1. Описание и основные характеристики
…
Психология рекламы
2.2 Основные характеристики восприятия
Восприятие человека заключено в своей психологии. По природе своей оно избирательно. И определяется личными (индивидуальными) факторами, которые являются стимулами. Среди факторов личных выделяют потребности и мотивы…
Психология цвета в рекламе
1.2 Основные характеристики цвета
Светлота (яркость) — обуславливается примесью белого, серого тонов. Насыщенность — обуславливается примесью черного, серого тонов. Попытки понять принципы цветового воздействия на человека предпринимались с древних времен. ..
..
Разработка маркетинговой и рекламной стратегий для фитнес-центра «Тонус-Холл»
2.1.1 Основные задачи, виды деятельности (услуги) предприятия Структура и система управления предприятия
Основными задачами предприятия являются предоставление и оказание велнес-услуг населению и получение максимально возможной прибыли. Услуги, которые предоставляет фитнес-центр «Тонус Холл»: · Тонусные столы…
Совершенствование планирования реализации продукции на ФГУП «Комбинат питания» г. Москва
2.2 Основные направления деятельности предприятия
…
Управление маркетинговой деятельностью компании на основе ее стоимости
1. Основные характеристики
…
Управление торговым предприятиям
1.3 Основные цели деятельности предприятия
Основной целью работы ООО «Алсу» является получение прибыли. Прибыль — это ключевой показатель организации. Основной целью коммерческих организаций является извлечение прибыли. ..
..
Характеристика деятельности рекламного агентства «WIZARD»
4. Основные направления деятельности предприятия
Основные направления деятельности рекламного агентства «WIZARD»: · Широкоформатная печать. Сопутствующие работы — установка люверсов диаметром от 10, 11, 12 и 16 мм, склейка полотна баннера, проклейка карманов, монтаж рекламных конструкций…
Структура деятельности менеджера и ее характеристики
Структура деятельности менеджера и ее характеристики [c.17]Важнейшая задача, стоящая перед методологией и методикой использования понятийного аппарата теории и практики менеджмента для анализа структуры менеджмента, заключается в том, чтобы найти пути усиления взаимодействия, интеграции элементов управленческой деятельности. Основные факторы, характеризующие деятельность менеджера как организатора и специалиста, как уже отмечалось, можно представить (разумеется, с определенными допущениями) с двух точек зрения — удельной значимости основных компонентов (признаков), определяющих структуру и содержание деятельности менеджеров, а также характеристик удельных затрат времени на реализацию отдельных компонентов. В целом можно отметить три группы факторов.
[c.181]
В целом можно отметить три группы факторов.
[c.181]
Традиционно менеджеры по кадрам оценивали персонал прежде всего с точки зрения его соответствия определенным требованиям. Однако в настоящее время структура и качественные характеристики персонала успешно анализируются в аспекте влияния на финансовые, операционные и рыночные результаты деятельности компании. В этом разделе мы рассмотрим уже опробованные и некоторые новые возможности использования информации о персонале для улучшения практических результатов деятельности компании. [c.39]
В этой связи разрабатываются общие характеристики менеджера будущего, обосновывается роль профессионального обучения в его формировании. Зарубежные эксперты отмечают, что в перспективе основная задача менеджера будет состоять в интегрировании неопределенности в систему прогнозирования, принятия решений и в организационную структуру, что потребует от руководителя «нового профессионализма» способности к адаптации, инновациям и постоянным изменениям. Наиболее важные характеристики деятельности менеджеров умение реалистически оценивать сильные и слабые стороны подчиненных способность мыслить стратегически умение вести переговоры с вышестоящими руководителями обеспечение благоприятного характера взаимоотношений в руководимых коллективах и заинтересованности у подчиненных в качественном выполнении служебных обязанностей [142].
[c.392]
Наиболее важные характеристики деятельности менеджеров умение реалистически оценивать сильные и слабые стороны подчиненных способность мыслить стратегически умение вести переговоры с вышестоящими руководителями обеспечение благоприятного характера взаимоотношений в руководимых коллективах и заинтересованности у подчиненных в качественном выполнении служебных обязанностей [142].
[c.392]
Реорганизация — мероприятия по изменению целей, стратегии и способов внутреннего функционирования организации. Руководители линейных подразделений (линейный менеджмент) — менеджеры-практики, реализующие конкретные функции работы с персоналом в ходе выполнения собственных управленческих функций. Руководитель — одна из ролей менеджера в рамках системного подхода, связанная с ответственностью за расстановку кадров, правильное понимание и выполнение подчиненными поставленных задач. Рычаг управления — способы, с помощью которых реализуются управленческие решения, средства, воздействующие на исполнителей. Сила корпоративной культуры — характеристика, описывающая ее устойчивость и эффективность в противостоянии иным тенденциям. Системный подход (в менеджменте) — развивается с 50-х гг. XX в. и связан с проникновением идей системного подхода в менеджмент. В системном менеджменте управляемая деятельность анализируется по четырем основным категориям процессы деятельности, функциональные структуры, ресурсы, способы деятельности. Взаимосвязь этих элементов и организационная целостность систем управляемой деятельности обеспечиваются системной организацией самого менеджмента и его ролевой специализацией.
[c.548]
Сила корпоративной культуры — характеристика, описывающая ее устойчивость и эффективность в противостоянии иным тенденциям. Системный подход (в менеджменте) — развивается с 50-х гг. XX в. и связан с проникновением идей системного подхода в менеджмент. В системном менеджменте управляемая деятельность анализируется по четырем основным категориям процессы деятельности, функциональные структуры, ресурсы, способы деятельности. Взаимосвязь этих элементов и организационная целостность систем управляемой деятельности обеспечиваются системной организацией самого менеджмента и его ролевой специализацией.
[c.548]
Модуль Организационно-производственные характеристики проекта является вторым крупным разделом инвестиционного бизнес-проекта. С позиций оценки и планируемых корректировок организационных аспектов деятельности предприятия-реципиента здесь описывается организационная структура управления предприятием, распределение ролей и полномочий между основными членами команды менеджеров и процесс их взаимодействия. Организационная схема, которая может быть представлена либо в самом проекте, либо в приложениях к нему, указывает место каждого менеджера в организационной иерархии и круг его обязанностей.
[c.251]
Организационная схема, которая может быть представлена либо в самом проекте, либо в приложениях к нему, указывает место каждого менеджера в организационной иерархии и круг его обязанностей.
[c.251]
Личностно-деловые качества менеджера — это обобщенные, наиболее устойчивые характеристики, которые оказывают решающее влияние на управленческую деятельность. Это весьма сложные е психологическом плане образования, зависящие от многих факторов особенностей характера, структуры личности, ее направленности, опыта, способностей, условий деятельности. Например, дисциплинированность менеджера может зависеть от присущего ему самоконтроля, внутренней организованности, осознания своей социальной роли, но может зависеть и от боязни неожиданного контроля вышестоящего руководителя или от действия всех перечисленных причин вместе. [c.160]
Как уже отмечалось, успех стратегии в значительной степени зависит от того, насколько хорошо менеджеры, отвечающие за эту стратегию, руководят изменениями, осуществляемыми в организации. Поскольку стратегия со временем претерпевает изменения, это требует дополнительных активов капитала, персонала с новыми знаниями и умениями, новых типов знаний, а также расширения, совершенствования старых, а во многих случаях и приобретения новых ТОП-характеристик и компетенций. Так, многие компании, занятые в электронном бизнесе, в настоящее время корректируют свои ТОП-характеристики. В частности, из-за перемен в стратегическом ландшафте менеджеры все чаще сталкиваются с тем, что компаниям приходится выполнять какие-то одни функции или заниматься конкретным видом деятельности, передавая другие заказы внешним структурам или заключая союз с компанией, специализирующейся на какой-то конкретной деятельности. В основе задач, связанных с определением организационного масштаба, лежит именно такой аутсорсинг и принятие решений типа изготовить или купить . В связи с этим при выборе стратегии всегда необходимо рассмотреть ключевые аспекты и вопросы, связанные с организационным масштабом
[c.
Поскольку стратегия со временем претерпевает изменения, это требует дополнительных активов капитала, персонала с новыми знаниями и умениями, новых типов знаний, а также расширения, совершенствования старых, а во многих случаях и приобретения новых ТОП-характеристик и компетенций. Так, многие компании, занятые в электронном бизнесе, в настоящее время корректируют свои ТОП-характеристики. В частности, из-за перемен в стратегическом ландшафте менеджеры все чаще сталкиваются с тем, что компаниям приходится выполнять какие-то одни функции или заниматься конкретным видом деятельности, передавая другие заказы внешним структурам или заключая союз с компанией, специализирующейся на какой-то конкретной деятельности. В основе задач, связанных с определением организационного масштаба, лежит именно такой аутсорсинг и принятие решений типа изготовить или купить . В связи с этим при выборе стратегии всегда необходимо рассмотреть ключевые аспекты и вопросы, связанные с организационным масштабом
[c. 40]
40]
Выполнение стратегии направлено на решение следующих трех задач. Во-первых, это установление приоритетности среди административных задач с тем, чтобы их относительная значимость соответствовала той стратегии, которую будет реализовывать организация. Это касается в первую очередь таких задач, как распределение ресурсов, установление организационных отношений, создание вспомогательных систем и т.п. Во-вторых, это установление соответствия между выбранной стратегией и внутриорганизационными процессами с тем, чтобы сориентировать деятельность организации на осуществление выбранной стратегии. Соответствие должно быть достигнуто по таким характеристикам организации, как ее структура, система мотивирования и стимулирования, нормы и правила поведения, разделяемые ценности и верования, квалификация работников и менеджеров и т.п. В-третьих, это выбор и приведение в соответствие с осуществляемой стратегией стиля лидерства и подхода к управлению организацией. Все три задачи решаются посредством проведения изменений. Поэтому именно изменение является сердцевиной выполнения стратегии. И именно поэтому изменения, которые проводятся в процессе выполнения стратегии, называются стратегическими изменениями.
[c.251]
Поэтому именно изменение является сердцевиной выполнения стратегии. И именно поэтому изменения, которые проводятся в процессе выполнения стратегии, называются стратегическими изменениями.
[c.251]
В деятельности функциональных и линейных менеджеров любого уровня есть специфические особенности. Функциональный руководитель действует в условиях жесткой нормативно регулируемой деятельности. В качестве регуляторов могут служить должностные лица и технологические нормативы деятельности, а также специальные знания, необходимые для их реализации. Линейный руководитель из-за отсутствия полного стандартного перечня задач в своей деятельности использует личностные качества как основное средство. Иными словами, функциональный менеджер работает, как правило, в рамках технологического типа деятельности, а линейный чаще действует в нестандартных ситуациях. Целевая установка в профессиональной деятельности также различается если линейный руководитель изменяет организационные ситуации, то функциональный закрепляет имеющиеся нормативные характеристики любого типа деятельности [70]. Имеет особенности и карьера этих двух типов менеджеров. Отмечено, что движение специалистов в рамках линейной структуры производства (мастер — начальник участка — начальник цеха — директор предприятия) формирует более решительных и ответственных руководителей, а в рамках функциональной структуры (инженер — руководитель группы — начальник отдела — главный специалист) — более осторожных руководителей, но при этом знающих, высококвалифицированных специалистов.
[c.402]
Имеет особенности и карьера этих двух типов менеджеров. Отмечено, что движение специалистов в рамках линейной структуры производства (мастер — начальник участка — начальник цеха — директор предприятия) формирует более решительных и ответственных руководителей, а в рамках функциональной структуры (инженер — руководитель группы — начальник отдела — главный специалист) — более осторожных руководителей, но при этом знающих, высококвалифицированных специалистов.
[c.402]
Предлагаемый экспресс-курс предназначен для предпринимателей и менеджеров, открывающих свое дело или уже работающих в бизнесе, а также для преподавателей и студентов экономических и управленческих специальностей. Структура курса включает 12 глав, последовательно раскрывающих основы науки и искусства управления бизнесом, основные характеристики нового управленческого мышления, особенности деятельности предприятий в рыночной экономике, механизм регистрации и лицензирования предпринимательской деятельности, методы планирования бизнеса, основные принципы генерального, финансового, кадрового и маркетингового менеджмента, ведения бухгалтерского учета, организации международного бизнеса, а также формы и методы подготовки и повышения квалификации предпринимателей и менеджеров.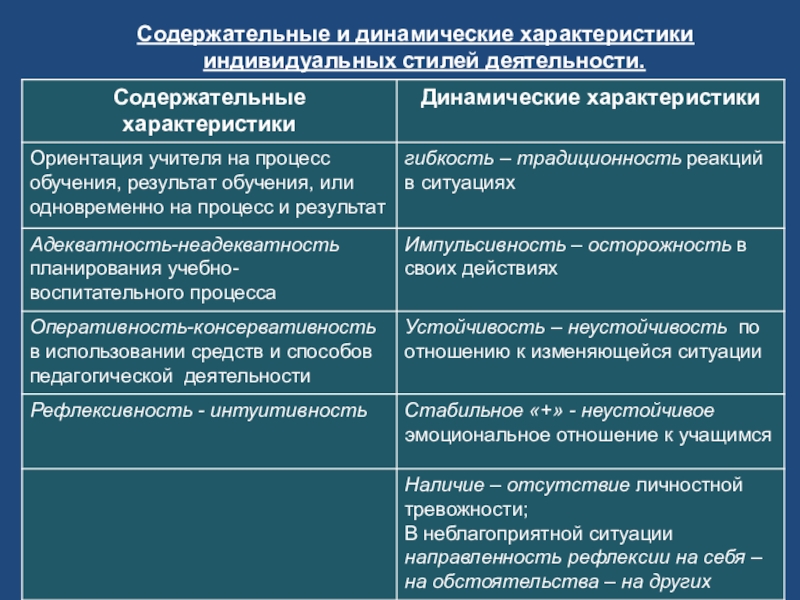 [c.3]
[c.3]
Измерительные инструменты и их рабочие характеристики
Введение
Измерительные инструменты используются для измерения количества. При выборе прибора необходимо учитывать статическую калибровку и статические характеристики прибора. Наш обзорный курс по электротехническому экзамену PE подробно описывает, что следует учитывать при выборе инструментов для конкретной работы.Характеристики средств измерений можно разделить на следующие категории:
1) Статические рабочие характеристики
Статическая калибровка
Статическая калибровка относится к процедуре, при которой входной сигнал является постоянным или переменным. применяется к инструменту.Инструменты производятся на основе свойства необратимости или направленности. Это означает, что изменение количества на входе вызовет соответствующее изменение на выходе. Калибровочный стандарт должен быть как минимум в десять раз точнее калибруемого прибора.
Статические рабочие характеристики включают линейность прибора, статическую чувствительность прибора, повторяемость одних и тех же результатов, разрешение гистерезиса и читаемость результатов.
Статические рабочие характеристики влияют на сбор данных, если инструменты не откалиброваны должным образом перед измерением. Понимание процедур контроля и обеспечения качества работы с оборудованием имеет важное значение для экзамена PE.
Линейность
Если взаимосвязь между выходом и входом может быть выражена уравнением Q0 = P + RQ1, где P и R — константы, то прибор считается линейным. Линейность никогда не достигается полностью в реальных ситуациях, и отклонения от идеала называются допусками линейности.Например, независимая линейность 3% означает, что выходной сигнал останется в пределах значений, установленных двумя параллельными линиями, разнесенными на ± 3% от полной шкалы выходного сигнала от идеализированной линии. Если отношение ввода-вывода не является линейным для инструмента, оно все равно может быть приближено к линейной форме, когда оно используется в очень ограниченном диапазоне.
Статическая чувствительность
Статическая чувствительность может быть определена как наклон калибровочной кривой.
Чувствительность = Q0 / Q1
Чувствительность влияет на входные параметры прибора.Коэффициент чувствительности также может называться дрейфом чувствительности или дрейфом масштабного коэффициента.
Ошибка повторяемости
Когда прибор используется для измерения одного и того же или идентичного входного сигнала много раз и в разные интервалы времени, выходной сигнал никогда не бывает одинаковым; он отклоняется от записанных значений. Это отклонение от идеального значения называется ошибкой повторяемости.
Гистерезис-пороговое разрешение
При тестировании прибора на повторяемость часто отмечается, что входное значение не совпадает с входными значениями, которые непрерывно возрастают и убывают.Это происходит из-за гистерезиса, который вызывается механизмами внутреннего трения, скольжения, внешнего трения и свободного хода. Гистерезис можно устранить, сняв показания, соответствующие возрастающим и убывающим значениям входа, и вычислив их среднее арифметическое.
Гистерезис можно устранить, сняв показания, соответствующие возрастающим и убывающим значениям входа, и вычислив их среднее арифметическое.
Профессиональные инженеры, работающие с измерениями и приборами, должны понимать процедуры калибровки различных приборов для правильного сбора данных.
Тактико-технические характеристики | Коллекции (Scala 2.8 — 2,12)
Из предыдущих пояснений было ясно, что разные типы коллекций имеют разные характеристики производительности. Часто это основная причина выбора одного типа коллекции вместо другого. В следующих двух таблицах можно увидеть характеристики производительности некоторых общих операций с коллекциями.
Тактико-технические характеристики последовательных типов:
| голова | хвост | применить | обновление | начало | добавить | вставка | |
|---|---|---|---|---|---|---|---|
| неизменный | |||||||
Список | С | С | л | л | С | л | – |
Поток | С | С | л | л | С | л | – |
Вектор | eC | eC | eC | eC | eC | eC | – |
Стек | С | С | л | л | С | л | л |
Очередь | AC | AC | л | л | С | С | – |
Диапазон | С | С | С | – | – | – | – |
Строка | С | л | С | л | л | л | – |
| изменяемый | |||||||
ArrayBuffer | С | л | С | С | л | AC | л |
ListBuffer | С | л | л | л | С | С | л |
StringBuilder | С | л | С | С | л | AC | л |
MutableList | С | л | л | л | С | С | л |
Очередь | С | л | л | л | С | С | л |
ArraySeq | С | л | С | С | – | – | – |
Стек | С | л | л | л | С | л | л |
ArrayStack | С | л | С | С | AC | л | л |
Массив | С | л | С | С | – | – | – |
Тактико-технические характеристики наборов и типов карт:
| поиск | добавить | удалить | мин. | |
|---|---|---|---|---|
| неизменный | ||||
HashSet / HashMap | eC | eC | eC | л |
TreeSet / TreeMap | Журнал | Журнал | Журнал | Журнал |
BitSet | С | л | л | eC 1 |
Карта списка | л | л | л | л |
| изменяемый | ||||
HashSet / HashMap | eC | eC | eC | л |
WeakHashMap | eC | eC | eC | л |
BitSet | С | AC | С | eC 1 |
TreeSet | Журнал | Журнал | Журнал | Журнал |
Сноска: 1 Предполагается, что биты плотно упакованы.
Записи в этих двух таблицах объясняются следующим образом:
| С | Операция занимает (быстрое) постоянное время. |
| eC | Операция занимает практически постоянное время, но это может зависеть от некоторых предположений, таких как максимальная длина вектора или распределение хеш-ключей. |
| переменного тока | Операция занимает амортизированное постоянное время.Некоторые вызовы операции могут занять больше времени, но если в среднем выполняется много операций, для каждой операции требуется постоянное время. |
| Бревно | Операция занимает время, пропорциональное логарифму размера коллекции. |
| л | Операция линейная, то есть требует времени, пропорционального размеру коллекции. |
| — | Операция не поддерживается. |
Первая таблица обрабатывает типы последовательностей — неизменные и изменяемые — с помощью следующих операций:
| головка | Выбор первого элемента последовательности. |
| хвост | Создание новой последовательности, состоящей из всех элементов, кроме первого. |
| применить | Индексирование. |
| обновить | Функциональное обновление (с обновлением до ) для неизменяемых последовательностей, обновление с побочными эффектами (с обновлением , для изменяемых последовательностей). |
| начало | Добавление элемента в начало последовательности. Для неизменяемых последовательностей это создает новую последовательность. Для изменяемых последовательностей он изменяет существующую последовательность. Для неизменяемых последовательностей это создает новую последовательность. Для изменяемых последовательностей он изменяет существующую последовательность. |
| добавить | Добавление элемента и конец последовательности.Для неизменяемых последовательностей это создает новую последовательность. Для изменяемых последовательностей он изменяет существующую последовательность. |
| вставка | Вставка элемента в произвольную позицию в последовательности. Это поддерживается напрямую только для изменяемых последовательностей. |
Вторая таблица обрабатывает изменяемые и неизменяемые наборы и отображения со следующими операциями:
| поиск | Проверка, содержится ли элемент в наборе, или выбор значения, связанного с ключом. |
| добавить | Добавление нового элемента в набор или пары ключ / значение на карту. |
| удалить | Удаление элемента из набора или ключа с карты. |
| мин | Наименьший элемент набора или наименьший ключ карты. |
Эксплуатационные характеристики теста на обнаружение антигена коронавируса 2 для быстрого тяжелого острого респираторного синдрома в тестовом центре Public Plaza в Сан-Франциско | Журнал инфекционных болезней
Абстрактные
Мы оценили эффективность экспресс-теста на антиген Abbott BinaxNOW для коронавирусной болезни 2019 (Binax-CoV2) для выявления вируса среди людей, независимо от симптомов, на общественной площадке, где происходит постоянная передача вируса в сообществе.Титрование культивированным коронавирусом 2 тяжелого острого респираторного синдрома дало наблюдаемый для человека порог между 1,6 × 10 4 -4,3 × 10 4 копий вирусной РНК (порог цикла [Ct], 30,3–28,8). Среди 878 протестированных субъектов 3% (26 из 878) были положительными по результатам полимеразной цепной реакции с обратной транскрипцией, из которых 15 из 26 имели Ct <30, что указывает на высокую вирусную нагрузку; из них 40% (6 из 15) не имели симптомов. Используя этот порог Ct (<30) для оценки Binax-CoV2, чувствительность Binax-CoV2 составила 93.3% (95% доверительный интервал, 68,1–99,8%) (14 из 15), а специфичность составила 99,9% (99,4–99,9%) (855 из 856).
Среди 878 протестированных субъектов 3% (26 из 878) были положительными по результатам полимеразной цепной реакции с обратной транскрипцией, из которых 15 из 26 имели Ct <30, что указывает на высокую вирусную нагрузку; из них 40% (6 из 15) не имели симптомов. Используя этот порог Ct (<30) для оценки Binax-CoV2, чувствительность Binax-CoV2 составила 93.3% (95% доверительный интервал, 68,1–99,8%) (14 из 15), а специфичность составила 99,9% (99,4–99,9%) (855 из 856).
Глобальная пандемия инфекции коронавируса 2 (SARS-CoV-2), вызванная тяжелым острым респираторным синдромом, распространяется беспрецедентными темпами [1], чему способствует эффективная передача инфекции респираторным путем, в том числе бессимптомными и бессимптомными людьми. В случаях успешного контроля используются маскировка, социальное дистанцирование и агрессивное тестирование, отслеживание и карантин [2].
На сегодняшний день краеугольным камнем тестирования является исследование респираторного секрета с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), которое имеет превосходную чувствительность и специфичность, но является дорогостоящим и требует сложного оборудования и высококвалифицированного персонала [3]. На практике эти функции часто вызывают задержки при тестировании, ставящие под угрозу их полезность [4]. В результате возникает интерес к быстрым и экономичным методам, позволяющим обойти эти ограничения [5]. Однако методы, которые не включают стадию амплификации, по своей природе менее чувствительны; поэтому их правильное развертывание потребует тщательной оценки характеристик эффективности в различных эпидемиологических условиях.
На практике эти функции часто вызывают задержки при тестировании, ставящие под угрозу их полезность [4]. В результате возникает интерес к быстрым и экономичным методам, позволяющим обойти эти ограничения [5]. Однако методы, которые не включают стадию амплификации, по своей природе менее чувствительны; поэтому их правильное развертывание потребует тщательной оценки характеристик эффективности в различных эпидемиологических условиях.
Диагностика антигена бокового потока была развернута для различных инфекционных заболеваний, включая малярию, RSV и грипп. Карта Ag от Abbott BinaxNOW COVID-19 (далее именуемая Binax-CoV2) — это один из таких тестов, позволяющий выявлять вирусный нуклеокапсидный (N) белок непосредственно в образцах мазков из носа. Тест не требует никаких инструментов; результаты оцениваются визуально и возвращаются в течение 15 минут. В августе 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов выдало разрешение на экстренное использование для диагностики инфекции SARS-CoV-2 у пациентов с симптомами в течение 7 дней с момента появления симптомов [6]. Министерство здравоохранения и социальных служб США распространило 150 миллионов наборов для тестирования. Учитывая ценность быстрой оценки заразности, ожидается ее использование у широкого круга субъектов, в том числе у бессимптомных. Здесь мы представляем систематическое исследование рабочих характеристик теста Binax-CoV2 в условиях скрининга сообщества, где тестирование предлагалось для субъектов с симптомами и бессимптомных.
Министерство здравоохранения и социальных служб США распространило 150 миллионов наборов для тестирования. Учитывая ценность быстрой оценки заразности, ожидается ее использование у широкого круга субъектов, в том числе у бессимптомных. Здесь мы представляем систематическое исследование рабочих характеристик теста Binax-CoV2 в условиях скрининга сообщества, где тестирование предлагалось для субъектов с симптомами и бессимптомных.
МЕТОДЫ
Исследуемая популяция и сбор образцов
В течение трех дней в сентябре 2020 года мы предложили пройти тестирование в районе Mission District, районе с преобладанием латиноамериканцев, который, согласно предыдущим опросам, имеет повышенную распространенность инфекции SARS-CoV-2 [7, 8].Бесплатное тестирование пешеходов проводилось на площади, расположенной на пересечении системы метро Bay Area (BART) и городской автобусной / трамвайной системы Сан-Франциско (MUNI). В день тестирования участники сообщали о симптомах и дате появления, демографические данные и контактную информацию, как того требуют правила штата и федеральные правила отчетности. Лаборант выполнил последовательный передний мазок (обе ноздри) для анализа Binax-CoV2, а затем второй мазок (обе ноздри) для ОТ-ПЦР. Участники были уведомлены о результатах теста ОТ-ПЦР.Для этого исследования результаты Binax-CoV2 не сообщались участникам исследования.
В день тестирования участники сообщали о симптомах и дате появления, демографические данные и контактную информацию, как того требуют правила штата и федеральные правила отчетности. Лаборант выполнил последовательный передний мазок (обе ноздри) для анализа Binax-CoV2, а затем второй мазок (обе ноздри) для ОТ-ПЦР. Участники были уведомлены о результатах теста ОТ-ПЦР.Для этого исследования результаты Binax-CoV2 не сообщались участникам исследования.
Лабораторные испытания на SARS-CoV-2
Обнаружение SARS-CoV-2 с помощью ОТ-ПЦР было выполнено в сертифицированной лабораторией Clinical Laboratory Improvement Amendments лаборатории Калифорнийского университета в Сан-Франциско (UCSF) и Chan Zuckerberg Biohub, как описано в другом месте [9, 10].
Полевые испытания с использованием анализа Binax-CoV2
Анализ Binax-CoV2 был проведен техническими специалистами на месте, как описано производителем, с использованием прилагаемых тампонов. Каждый анализ был прочитан 2 независимыми наблюдателями, и супервайзер участка служил в качестве разрешения конфликтов. Начиная со 2-го дня исследования, каждую карту анализа Binax-CoV2 сканировали на месте с помощью сканера цветных документов (CanoScan LIDE 400; Canon). Образцы полос были ретроспективно определены количественно по данным изображений. Области образца и фона были локализованы путем смещения от контрольной полосы, и относительное уменьшение средней интенсивности пикселей рассчитывалось по синему и зеленому каналам, усредненным по отношению к фону.
Каждый анализ был прочитан 2 независимыми наблюдателями, и супервайзер участка служил в качестве разрешения конфликтов. Начиная со 2-го дня исследования, каждую карту анализа Binax-CoV2 сканировали на месте с помощью сканера цветных документов (CanoScan LIDE 400; Canon). Образцы полос были ретроспективно определены количественно по данным изображений. Области образца и фона были локализованы путем смещения от контрольной полосы, и относительное уменьшение средней интенсивности пикселей рассчитывалось по синему и зеленому каналам, усредненным по отношению к фону.
Титрование культивированного in vitro SARS-CoV-2 на картах Binax-CoV2
SARS-CoV-2 из клинического образца UCSF был выделен, размножен и нанесен на Huh7.5.1 клетки сверхэкспрессируют ангиотензинпревращающий фермент 2 и трансмембранную сериновую протеазу 2 (TMPRSS2) [11]. Титры вирусов определяли с помощью стандартных анализов бляшек [12]. Для экспериментов по титрованию SARS-CoV-2 разводили в забуференном фосфатом физиологическом растворе Дульбекко, и 40 мкл каждого разведения абсорбировались предоставленными образцами мазков. Изображения карт Binax-CoV2 были получены с помощью Apple iPhone 6. Все эксперименты с использованием культивированного SARS-CoV-2 проводились в лаборатории с уровнем биобезопасности 3.
Изображения карт Binax-CoV2 были получены с помощью Apple iPhone 6. Все эксперименты с использованием культивированного SARS-CoV-2 проводились в лаборатории с уровнем биобезопасности 3.
Анализ титрования белка N
Белок SARS-CoV-2 N (1–419) был экспрессирован в BL21 (DE3) Escherichia coli и очищен никель-нитрилотриуксусной кислотой, включая промывку хлорида натрия 1 моль / л, имидазола 50 ммоль / л. удалить связанную РНК.Шесть концентраций N-белка были протестированы на 10 партиях наборов Binax-CoV2, и 40 мкл N-белка было абсорбировано предоставленным образцом мазка.
Заявление об этике
Комитет UCSF по исследованиям на людях определил, что исследование соответствует критериям наблюдения за общественным здоровьем. Все участники дали информированное согласие на двойное тестирование.
РЕЗУЛЬТАТЫ
Характеристики Binax-CoV2 с использованием титрования культивированного in vitro SARS-CoV-2
Для изучения взаимосвязи порога цикла ОТ-ПЦР (Ct), вирусной нагрузки и соответствующего визуального результата Binax-CoV2 была проанализирована серия разведений культивированного в лаборатории SARS-CoV-2 с известными титрами с помощью как ОТ-ПЦР, так и Binax-CoV2 (рисунок 1). Для этого запаса вируса порог обнаруживаемости человеческим глазом в анализе Binax-CoV2 составлял от 1,6 до 4,3 × 10 4 вирусных копий (100–250 бляшкообразующих единиц), что соответствует значениям t (среднее значение N и E гены) 30,3 и 28,8, соответственно, в этом анализе.
Для этого запаса вируса порог обнаруживаемости человеческим глазом в анализе Binax-CoV2 составлял от 1,6 до 4,3 × 10 4 вирусных копий (100–250 бляшкообразующих единиц), что соответствует значениям t (среднее значение N и E гены) 30,3 и 28,8, соответственно, в этом анализе.
Рисунок 1.
Титрование коронавируса 2 тяжелого острого респираторного синдрома, выращенного in vitro, и обнаружение с помощью анализа Binax-CoV2. Top , Нормализованная интенсивность полосы образца Binax-CoV2 (сине-зеленая средняя) для карт, загруженных известным количеством вируса.Планки погрешностей представляют собой стандартное отклонение интенсивности полосы образца в технических репликах. Тестирование полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) проводили в консорциуме CLIAHUB [10]. Соответствующие пороговые значения цикла ОТ-ПЦР (Ct) (среднее для проб N и E генов) показаны черным, а соответствующие номера копий РНК — синим. Обратите внимание, что корреляция Ct и числа копий генома зависит от платформы RT-PCR.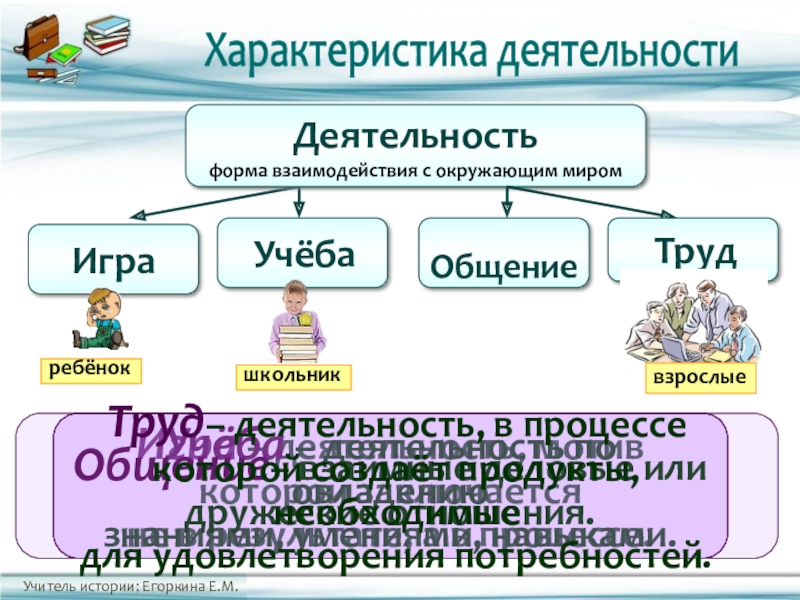 Внизу, Типичные изображения карточек из каждой точки данных. Аббревиатура: PFUs, бляшкообразующие единицы.
Внизу, Типичные изображения карточек из каждой точки данных. Аббревиатура: PFUs, бляшкообразующие единицы.
Рисунок 1.
Титрование коронавируса 2 тяжелого острого респираторного синдрома, выращенного in vitro, и обнаружение с помощью анализа Binax-CoV2. Top , Нормализованная интенсивность полосы образца Binax-CoV2 (сине-зеленая средняя) для карт, загруженных известным количеством вируса. Планки погрешностей представляют собой стандартное отклонение интенсивности полосы образца в технических репликах. Тестирование полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) проводили в консорциуме CLIAHUB [10]. Соответствующие пороговые значения цикла ОТ-ПЦР (Ct) (среднее для проб N и E генов) показаны черным, а соответствующие номера копий РНК — синим.Обратите внимание, что корреляция Ct и числа копий генома зависит от платформы RT-PCR. Внизу, Типичные изображения карточек из каждой точки данных. Аббревиатура: PFUs, бляшкообразующие единицы.
Результаты тестирования ОТ-ПЦР сообщества
Из 878 протестированных субъектов 54% были мужчинами, 77% были в возрасте от 18 до 50 лет, 81% идентифицировали себя как латиноамериканцы и 84% не сообщили об отсутствии симптомов в течение 14 дней до тестирования. Двадцать шесть человек (3%) дали положительный результат ОТ-ПЦР; из них 15 (58%) имели Ct <30, а 6 из 15 (40%) не имели симптомов.Среди бессимптомных лиц с Ct <30 у 4 из 6 симптомы развились в течение 2 дней после тестирования. Из 11 человек, положительных по ОТ-ПЦР с Ct> 30, 4 сообщили о появлении симптомов за ≥7 дней до тестирования, 1 сообщил о появлении симптомов за 3 дня до тестирования, а остальные не сообщили о симптомах.
Сравнение результатов тестирования ОТ-ПЦР и Binax-CoV2 по результатам тестирования сообщества
Поскольку показания анализа Binax-CoV2 производятся путем визуального осмотра, результаты могут быть субъективными, особенно когда полосы слабые или частичные. В инструкциях производителя рекомендуется оценивать любую видимую полосу как положительную. В первый день тестирования были использованы эти инструкции по чтению и протестировано 217 образцов, из которых 214 дали достоверные результаты Binax-CoV2: 7 из 214 (3,3%) были положительными при ОТ-ПЦР; Согласно критериям, предложенным производителем, 5 из этих 7 были положительными на Binax-CoV2. Из 214 в общей сложности 207 были отрицательными при ОТ-ПЦР, 9 (4,3%) из которых были положительными на Binax-CoV2. Таким образом, согласно критериям производителя, 9 из 14 тестов на Binax-CoV2 (64%) в этой популяции из 217 тестов дали ложноположительные результаты (положительный результат на Binax-CoV2 / отрицательный результат ОТ-ПЦР).Мы думали, что эти исходные критерии, использованные в первый день тестирования, были недостаточными для классификации слабых полос анализа Binax-CoV2, что приводило к чрезмерному количеству ложноположительных вызовов.
В инструкциях производителя рекомендуется оценивать любую видимую полосу как положительную. В первый день тестирования были использованы эти инструкции по чтению и протестировано 217 образцов, из которых 214 дали достоверные результаты Binax-CoV2: 7 из 214 (3,3%) были положительными при ОТ-ПЦР; Согласно критериям, предложенным производителем, 5 из этих 7 были положительными на Binax-CoV2. Из 214 в общей сложности 207 были отрицательными при ОТ-ПЦР, 9 (4,3%) из которых были положительными на Binax-CoV2. Таким образом, согласно критериям производителя, 9 из 14 тестов на Binax-CoV2 (64%) в этой популяции из 217 тестов дали ложноположительные результаты (положительный результат на Binax-CoV2 / отрицательный результат ОТ-ПЦР).Мы думали, что эти исходные критерии, использованные в первый день тестирования, были недостаточными для классификации слабых полос анализа Binax-CoV2, что приводило к чрезмерному количеству ложноположительных вызовов.
В последующие дни тестирования мы оценили дополнительные критерии для классификации полосы как положительной, проконсультировавшись с экспертами из исследовательского персонала производителя. Оптимальные характеристики достигаются, когда полосы оцениваются как положительные, если они проходят по всей ширине полосы, независимо от интенсивности полосы.Обновленные критерии оценки были внедрены к третьему дню тестирования, когда было проведено 292 теста. Из этого общего числа 283 были отрицательными при ОТ-ПЦР, все из которых дали отрицательный результат на Binax-CoV2, что свидетельствует о том, что эти обновленные критерии считывания заметно снижают ложноположительные результаты. Из 292 тестов на 3-й день 9 были положительными при ОТ-ПЦР, из которых 5 были положительными на антиген Binax-CoV2 с этими обновленными критериями оценки. Из 9 образцов, положительных по результатам ОТ-ПЦР, 4 образца, отрицательные по Binax-CoV2, имели Ct> 30, что согласуется с нашим лабораторно наблюдаемым пределом обнаружения для Binax-CoV2.Мы обнаружили, что оценка теста как положительного, если полосы проходят по всей ширине полосы, независимо от интенсивности полосы, является наименее субъективным и самым простым методом для реализации в полевых условиях, и мы разработали обучающий инструмент (https: // unitedinhealth .
Оптимальные характеристики достигаются, когда полосы оцениваются как положительные, если они проходят по всей ширине полосы, независимо от интенсивности полосы.Обновленные критерии оценки были внедрены к третьему дню тестирования, когда было проведено 292 теста. Из этого общего числа 283 были отрицательными при ОТ-ПЦР, все из которых дали отрицательный результат на Binax-CoV2, что свидетельствует о том, что эти обновленные критерии считывания заметно снижают ложноположительные результаты. Из 292 тестов на 3-й день 9 были положительными при ОТ-ПЦР, из которых 5 были положительными на антиген Binax-CoV2 с этими обновленными критериями оценки. Из 9 образцов, положительных по результатам ОТ-ПЦР, 4 образца, отрицательные по Binax-CoV2, имели Ct> 30, что согласуется с нашим лабораторно наблюдаемым пределом обнаружения для Binax-CoV2.Мы обнаружили, что оценка теста как положительного, если полосы проходят по всей ширине полосы, независимо от интенсивности полосы, является наименее субъективным и самым простым методом для реализации в полевых условиях, и мы разработали обучающий инструмент (https: // unitedinhealth . org / binax-training).
org / binax-training).
Результаты 26 ОТ-ПЦР-положительных лиц, идентифицированных в течение 3-дневного исследования, были стратифицированы по значению Ct теста ОТ-ПЦР и классифицированы в соответствии с результатом Binax-CoV2 (рис. 2). Тест на быстрое обнаружение антигена хорошо показал себя в образцах с более высокой вирусной нагрузкой: 15 из 16 образцов с Ct <32 были положительными на Binax-CoV2 (рис. 2А).Напротив, ни один из 10 образцов с Ct ≥34 не был положительным при обнаружении антигена Binax-CoV2. Количественная оценка ретроспективного изображения интенсивности полосы образца Binax-CoV2 коррелирует со значениями Ct ОТ-ПЦР для этих людей (рис. 2В). В каждом случае показано соответствующее изображение, чтобы продемонстрировать соответствие между ОТ-ПЦР и визуальным результатом (рис. 2С).
Рисунок 2.
Сравнение теста Binax-CoV2 с тестом количественной полимеразной цепной реакции с обратной транскрипцией (RT-PCR). A, Средние значения порога вирусного цикла (Ct) у всех 26 ОТ-ПЦР-положительных индивидуумов из исследования сообщества, нанесенные на график в порядке возрастания. Синие кружки указывают на Binax-CoV2-положительные образцы; желтые квадраты, Binax-CoV2 – отрицательные образцы. Открытые символы обозначают лиц, у которых не было симптомов в день теста, а закрашенные символы — тех, кто сообщил о симптомах в этот день. B, Нормализованный сигнал полосы образца из ретроспективного анализа изображений карт Binax-CoV2 был нанесен на график как функция значения Ct для всех доступных изображений сканера (19 из 26 образцов с положительной ОТ-ПЦР и случайная подгруппа образцов с отрицательной ОТ-ПЦР. образцы).Истинно-положительные результаты по Binax-CoV2 показаны синим цветом и помечены как TP; ложноотрицательные, выделенные желтым цветом и помеченные буквой FN; и истинно-отрицательные, показанные красным и помеченные TN. C, Соответствующие изображения карт Binax-CoV2 из данных в B .
Синие кружки указывают на Binax-CoV2-положительные образцы; желтые квадраты, Binax-CoV2 – отрицательные образцы. Открытые символы обозначают лиц, у которых не было симптомов в день теста, а закрашенные символы — тех, кто сообщил о симптомах в этот день. B, Нормализованный сигнал полосы образца из ретроспективного анализа изображений карт Binax-CoV2 был нанесен на график как функция значения Ct для всех доступных изображений сканера (19 из 26 образцов с положительной ОТ-ПЦР и случайная подгруппа образцов с отрицательной ОТ-ПЦР. образцы).Истинно-положительные результаты по Binax-CoV2 показаны синим цветом и помечены как TP; ложноотрицательные, выделенные желтым цветом и помеченные буквой FN; и истинно-отрицательные, показанные красным и помеченные TN. C, Соответствующие изображения карт Binax-CoV2 из данных в B .
Рисунок 2.
Сравнение теста Binax-CoV2 с тестом количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). A, Средние значения порога вирусного цикла (Ct) у всех 26 ОТ-ПЦР-положительных индивидуумов из исследования сообщества, нанесенные на график в порядке возрастания. Синие кружки указывают на Binax-CoV2-положительные образцы; желтые квадраты, Binax-CoV2 – отрицательные образцы. Открытые символы обозначают лиц, у которых не было симптомов в день теста, а закрашенные символы — тех, кто сообщил о симптомах в этот день. B, Нормализованный сигнал полосы образца из ретроспективного анализа изображений карт Binax-CoV2 был нанесен на график как функция значения Ct для всех доступных изображений сканера (19 из 26 образцов с положительной ОТ-ПЦР и случайная подгруппа образцов с отрицательной ОТ-ПЦР. образцы). Истинно-положительные результаты по Binax-CoV2 показаны синим цветом и помечены как TP; ложноотрицательные, выделенные желтым цветом и помеченные буквой FN; и истинно-отрицательные, показанные красным и помеченные TN. C, Соответствующие изображения карт Binax-CoV2 из данных в B .
Синие кружки указывают на Binax-CoV2-положительные образцы; желтые квадраты, Binax-CoV2 – отрицательные образцы. Открытые символы обозначают лиц, у которых не было симптомов в день теста, а закрашенные символы — тех, кто сообщил о симптомах в этот день. B, Нормализованный сигнал полосы образца из ретроспективного анализа изображений карт Binax-CoV2 был нанесен на график как функция значения Ct для всех доступных изображений сканера (19 из 26 образцов с положительной ОТ-ПЦР и случайная подгруппа образцов с отрицательной ОТ-ПЦР. образцы). Истинно-положительные результаты по Binax-CoV2 показаны синим цветом и помечены как TP; ложноотрицательные, выделенные желтым цветом и помеченные буквой FN; и истинно-отрицательные, показанные красным и помеченные TN. C, Соответствующие изображения карт Binax-CoV2 из данных в B .
Чувствительность и специфичность
ОТ-ПЦР считается эталонным стандартом [3] и в анализе ОТ-ПЦР, используемом в этом исследовании, имеет предел обнаружения 100 копий вирусной РНК / мл. Прямой анализ антигена по своей природе не такой чувствительный, как ОТ-ПЦР. В контексте тестирования на уровне сообщества мы определили порог для высоких уровней вируса, соответствующий диапазону наивысшей вероятности передачи: Ct 30, что соответствует числу копий вирусной РНК примерно 1.9 × 10 4 в этом анализе [10, 13]. Используя это определение случая Ct <30 и 95% доверительные интервалы (ДИ), чувствительность Binax-CoV2 составила 93,3% (95% ДИ, 68,1–99,8%) (14 из 15), а специфичность составила 99,9% ( 99,4–99,9%) (855 из 856). При корректировке порога до более консервативного значения Ct 33 (2,6 × 10 3 копий вирусной РНК) чувствительность составила 93,8% (95% ДИ, 69,8–99,8%) (15 из 16), а специфичность — 100 % (99,6–100%) (855 из 855). Без порога Ct чувствительность анализа Binax-CoV2 была (57.7%; 95% ДИ, 36,9–76,6%) (15 из 26), а специфичность была (100%; 99,6–100%) (845 из 845). Учитывая, что анализ Binax-CoV2 выявляет инфицированных лиц с высоким уровнем вируса (> 10 4 ), чувствительность анализа при отсутствии порогового значения будет во многом зависеть от кинетики вируса в тестируемой популяции.
Прямой анализ антигена по своей природе не такой чувствительный, как ОТ-ПЦР. В контексте тестирования на уровне сообщества мы определили порог для высоких уровней вируса, соответствующий диапазону наивысшей вероятности передачи: Ct 30, что соответствует числу копий вирусной РНК примерно 1.9 × 10 4 в этом анализе [10, 13]. Используя это определение случая Ct <30 и 95% доверительные интервалы (ДИ), чувствительность Binax-CoV2 составила 93,3% (95% ДИ, 68,1–99,8%) (14 из 15), а специфичность составила 99,9% ( 99,4–99,9%) (855 из 856). При корректировке порога до более консервативного значения Ct 33 (2,6 × 10 3 копий вирусной РНК) чувствительность составила 93,8% (95% ДИ, 69,8–99,8%) (15 из 16), а специфичность — 100 % (99,6–100%) (855 из 855). Без порога Ct чувствительность анализа Binax-CoV2 была (57.7%; 95% ДИ, 36,9–76,6%) (15 из 26), а специфичность была (100%; 99,6–100%) (845 из 845). Учитывая, что анализ Binax-CoV2 выявляет инфицированных лиц с высоким уровнем вируса (> 10 4 ), чувствительность анализа при отсутствии порогового значения будет во многом зависеть от кинетики вируса в тестируемой популяции. Расчеты чувствительности и специфичности были выполнены с использованием окончательных критериев оценки с использованием ретроактивных оценок Binax-CoV2 из изображений, охватывающих все 3 дня исследования.
Расчеты чувствительности и специфичности были выполнены с использованием окончательных критериев оценки с использованием ретроактивных оценок Binax-CoV2 из изображений, охватывающих все 3 дня исследования.
Оценка вариации от партии к партии Binax-CoV2
Мы количественно определили вариабельность от партии к партии в 10 различных сериях карточных тестов Binax-CoV2, используя серию разведений N-белка. (Дополнительный рисунок 1). При концентрациях белка ≥17,2 нг / мл полоса образца была обнаружена во всех партиях и, таким образом, не повлияла на результат этого бинарного анализа (дополнительный рисунок 1A).
ОБСУЖДЕНИЕ
Приведенные здесь данные описывают рабочие характеристики набора для обнаружения антигена Binax-CoV2 в контексте тестирования в сообществе, включая бессимптомных субъектов.Эти результаты указывают на четкую взаимосвязь между относительной вирусной нагрузкой и положительностью теста и предоставляют практический, реальный критерий, помогающий получить результаты в этих условиях. Мы обнаружили, что небольшие изменения в обучении снижают количество ложных срабатываний, что является законным поводом для беспокойства по поводу развертывания этих тестов.
В утвержденном в настоящее время разрешении на использование в экстренных случаях для анализа Binax-CoV2 указано использование только у лиц с симптомами. Представленные здесь результаты показывают, что тест Binax-CoV2 не должен ограничиваться только симптоматическим тестированием.Многие бессимптомные люди имеют высокую вирусную нагрузку (соответствующую низким значениям Ct) и, следовательно, имеют высокую вероятность заразить и передать вирус, что является признаком и вероятной причиной пандемии, которую мы и другие наблюдатели наблюдали ранее [7, 14] . Ограничение использования Binax-CoV2 лицами с симптомами позволило бы пропустить почти половину инфекций SARS-CoV-2 в текущем исследовании.
Кроме того, влияние тестирования на прямую передачу затрудняется длительным временем ожидания.Наша группа ранее сообщала, что в условиях сообщества к тому времени, когда человек проходит тестирование, консультируется и помещается в условия изоляции, эффективный период изоляции часто почти заканчивается [8]. Это особенно верно для многих цветных сообществ, где сообщения о задержках доступа к тестам и результатам еще больше [4, 15]. Экспресс-тесты могут сократить эти задержки и максимально увеличить время эффективной изоляции. Ограничения нашего исследования включают его поперечный дизайн и общее небольшое количество положительных случаев ОТ-ПЦР.Необходимы дополнительные полевые характеристики этого анализа, которые помогут разработать оптимальные стратегии использования. Мы рекомендуем оценивать анализ Binax-CoV2 одновременно с ОТ-ПЦР в каждом контексте, в котором он будет использоваться, перед использованием Binax-CoV2 без ОТ-ПЦР.
На ранних стадиях инфекции вирусная нагрузка может быть слишком низкой, чтобы ее можно было обнаружить с помощью прямых анализов на антигены, таких как Binax-CoV2. Эта присущая более низкая чувствительность может быть компенсирована более быстрым оборотом и более высокой частотой тестирования при общей более низкой стоимости по сравнению с методами ОТ-ПЦР.Тем не менее, для лиц с высоким индексом подозрения на коронавирусную болезнь 2019 и отрицательным результатом Binax-CoV2 тест следует дополнить RT-PCR или повторным тестом Binax-CoV2 в более позднее время, чтобы убедиться, что случаи заболевания не пропустил.
Таким образом, в полевых условиях с дополнительным обучением технических специалистов анализ Binax-CoV2 точно выявил инфекцию SARS-CoV-2 с высокой вирусной нагрузкой как у бессимптомных, так и у лиц с симптомами. Тест Binax-CoV2 может быть ценным активом в арсенале инструментов тестирования для смягчения распространения SARS-CoV-2, поскольку быстрое выявление высокоинфекционных людей имеет решающее значение.
Дополнительные данные
Дополнительные материалы доступны по адресу The Journal of Infectious Diseases онлайн. Состоящие из данных, предоставленных авторами для удобства читателя, размещенные материалы не копируются и являются исключительной ответственностью авторов, поэтому вопросы или комментарии следует адресовать соответствующему автору.
Банкноты
Благодарности. Мы благодарим Бевана Дафти и команду BART, Джеффа Тумлина и MUNI Сан-Франциско, супервайзера Хиллари Ронен, мэра Лондона Брида, Гранта Колфакса, доктора медицины, и Департамент общественного здравоохранения, Салу Рибейро, MS, а также услуги лаборатории по флеботомии и лаборатории Bay Area. платформа для тестирования PrimaryBio на коронавирусную болезнь 2019, а также послы и волонтеры нашего сообщества.Мы также благодарим Дона Ганема, доктора медицины за помощь в написании и критическую дискуссию, Андреаса Пущника, доктора философии по клеткам со сверхэкспрессией Huh7.5.1, используемых для роста коронавирусной болезни 2 с тяжелым острым респираторным синдромом, и Терри Робинса, доктора философии, Стивена Ковача и Джона Хакетта-младшего, доктора философии от Abbott Laboratories за их поддержку. Наконец, мы благодарим Abbott Laboratories и Департамент общественного здравоохранения Калифорнии за их щедрые пожертвования карт BinaxNOW COVID-19 Ag.
Финансовая поддержка. Это исследование было поддержано Калифорнийским университетом в Сан-Франциско, Chan Zuckerberg Biohub, Chan Zuckerberg Initiative, Целевой группой латиноамериканцев Сан-Франциско, Национальным институтом аллергии и инфекционных заболеваний (гранты T32 AI060530 для LR и F31AI150007 для SS. ) и частный донор.
Возможный конфликт интересов. Все авторы: о конфликтах не сообщалось. Все авторы подали форму ICMJE для раскрытия информации о потенциальном конфликте интересов.Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
2.Baker
MG
,Wilson
N
,Anglemyer
A
.Успешное устранение передачи Covid-19 в Новой Зеландии
.N Engl J Med
2020
;383
:e56
.3.Эсбин
MN
,Whitney
ON
,Chong
S
,Maurer
A
,Darzacq
X
,Tjian 9000
Преодоление узкого места в широкомасштабном тестировании: быстрый обзор подходов к тестированию нуклеиновых кислот для обнаружения COVID-19
.РНК
2020
;26
:771
—83
.5.Mina
MJ
,Parker
R
,Larremore
DB
.Переосмысление чувствительности теста на Covid-19 — стратегия сдерживания
.N Engl J Med
2020
;383
:e120
.7.Chamie
G
,Marquez
C
,Crawford
E
и др.Передача SARS-CoV-2 в сообществе непропорционально поражает латинское население во время приюта в Сан-Франциско [опубликовано в Интернете перед печатью 21 августа 2020 г.]
.Clin Infect Dis
2020
; DOI: 10,1093 / cid / ciaa12348.Kerkhoff
AD
,Sachdev
D
,Mizany
S
и др.Оценка новой модели «Test-to-Care» на уровне сообществ COVID-19 для групп населения с низкими доходами
.PLoS One
2020
;15
:e0239400
.9.Crawford
ED
,Acosta
I
,Ahyong
V
и др.Быстрое развертывание тестирования SARS-CoV-2: CLIAHUB
.PLoS Pathog
2020
;16
:e1008966
.10.Vanaerschot
M
,Mann
SA
,Webber
JT
и др.Идентификация полиморфизма гена N SARS-CoV-2, который отрицательно влияет на обнаружение с помощью ОТ-ПЦР
.J Clin Microbiol
2020
;59
:e02369-20
. 13.Wölfel
R
,Corman
VM
,Guggemos
W
и др.Вирусологическая оценка госпитализированных пациентов с COVID-2019
.Природа
2020
;581
:465
—9
. 14.Оран
ДП
,Тополь
EJ
.Распространенность бессимптомной инфекции SARS-CoV-2: повествовательный обзор
.Ann Intern Med
2020
:362
—7
. 15.Kim
HN
,Lan
KF
,Nkyekyer
E
и др.Оценка различий в тестировании и заражении COVID-19 среди языковых групп в Сиэтле, Вашингтон
.JAMA Netw Open
2020
;3
:e2021213
.© Автор (ы) 2021. Опубликовано Oxford University Press для Общества инфекционных болезней Америки.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivs (http://creativecommons.org/licenses/by-nc-nd/4.0/), которая разрешает некоммерческое воспроизведение и распространение. произведения на любом носителе при условии, что оригинальное произведение не было изменено или преобразовано каким-либо образом, и что произведение правильно процитировано.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].Рабочие характеристики экспресс-теста на обнаружение антигена SARS-CoV-2 в общественном центре тестирования в Сан-Франциско
РЕФЕРАТ
Мы оценили эффективность экспресс-теста Abbott BinaxNOW ™ Covid-19 на обнаружение вируса среди людей независимо от симптомов на общественной площади, где происходит постоянная передача инфекции. Титрование с культивированием клинического SARS-CoV-2 дало наблюдаемый для человека порог между 1.6 × 10 4 -4,3 × 10 4 копий вирусной РНК (порог цикла (Ct) 30,3–28,8 в этом анализе). Среди 878 протестированных субъектов 3% (26/878) были положительными с помощью ОТ-ПЦР, из которых 15/26 имели Ct <30, что указывает на высокую вирусную нагрузку. 40% (6/15) Ct <30 не имели симптомов. Используя этот порог Ct <30 для оценки Binax-CoV2, чувствительность Binax-CoV2 составила 93,3% (14/15), 95% ДИ: 68,1-99,8%, а специфичность составила 99,9% (855/856), 95 % ДИ: 99,4-99,9%.
Заявление о конкурирующем интересе
Авторы заявили об отсутствии конкурирующего интереса.
Заявление о финансировании
Это исследование было поддержано UCSF, Chan Zuckerberg Biohub, Chan Zuckerberg Initiative, Целевой группой San Francisco Latino Task Force и частным спонсором. LR финансировался T32 AI060530, а SS финансировался F31AI150007.
Заявления авторов
Я подтверждаю, что были соблюдены все соответствующие этические принципы и получены все необходимые разрешения IRB и / или комитета по этике.
Да
Подробная информация об IRB / надзорном органе, предоставившем одобрение или исключение для описанного исследования, приводится ниже:
Комитет UCSF по исследованиям на людях определил, что исследование соответствует критериям наблюдения за общественным здоровьем.Все участники дали информированное согласие на двойное тестирование.
Получено все необходимое согласие пациента / участника, и соответствующие институциональные формы заархивированы.
Да
Я понимаю, что все клинические испытания и любые другие проспективные интервенционные исследования должны быть зарегистрированы в одобренном ICMJE реестре, таком как ClinicalTrials.gov. Я подтверждаю, что любое такое исследование, указанное в рукописи, было зарегистрировано и предоставлен идентификатор регистрации испытания (примечание: при публикации проспективного исследования, зарегистрированного ретроспективно, просьба предоставить заявление в поле идентификатора испытания, объясняющее, почему исследование не было зарегистрировано заранее) .
Да
Я выполнил все соответствующие инструкции по составлению отчетов об исследованиях и загрузил соответствующие контрольные списки отчетов по исследованиям сети EQUATOR и другие соответствующие материалы в качестве дополнительных файлов, если применимо.
Да
Сноски
Необработанные числа, используемые для расчета специфичности Binax-CoV2, были обновлены. Ранее: 862/863 (99,9%) ошибочно включали 7 тестов Binax-CoV2, которые оказались недействительными. Обновлено: 855/856 (99,9%) правильно представляет количество действительных тестов, использованных в этом расчете.Рисунок 2 был изменен, чтобы указать лиц, не имеющих симптомов, и лиц с симптомами.
Доступность данных
Все данные, упомянутые в рукописи, включены в рисунки рукописи. Дополнительные материалы (руководство по обучению читателей Binax-CoV2) включены в ссылку.
https://unitedinhealth.org/binax-training
8 Характеристики высокоэффективных команд (и как их создать)
Почему одни команды работают лучше, чем другие? Что отличает эти команды от остальных?
Высокопроизводительные команды состоят из людей, обладающих специальными знаниями и дополнительными навыками, которые ориентированы на достижение цели и чрезмерно ориентированы на достижение четких, выдающихся результатов.Вместе они сотрудничают и вводят новшества, чтобы производить работу на самом высоком уровне.
Но создание высокопроизводительной команды требует большего, чем просто сплочение группы талантливых людей с нужными навыками. Это требует тщательной разработки и воспитания ключевых характеристик, моделей поведения и передовых практик.
Мы расскажем о 8 характеристиках высокопроизводительных команд и о том, как развивать их в своих собственных командах. Высокоэффективные команды:
- Иметь четкие цели, тесно связанные с приоритетами команды и организации
- Понять, как их работа соответствует миссии организации
- Определили роли и обязанности
- Общайтесь четко и уважительно
- Управляйте работой и сроками на основе приоритетов
- Доверяйте и уважайте друг друга
- Отмечать успех вместе и признавать вклад
- Практика непрерывного обучения
Характеристика высокопроизводительного коллектива
Несмотря на то, что каждая команда уникальна, у высокопроизводительных команд есть общие характеристики.
1. У них есть четкие цели, тесно связанные с приоритетами команды и организации.
Высокопроизводительные команды согласованы по своим целям, целям и приоритетам. Они устанавливают командные и индивидуальные цели, которые поддерживают это общее видение, так что их работа способствует достижению. Цели не только согласованы, но и четко определены, поэтому каждый точно знает, что ему нужно делать и как этого добиться.
2. Они понимают, как их работа вписывается в миссию организации.
Когда сотрудники понимают, как их работа вписывается в контекст общих целей и миссии организации, они становятся более заинтересованными и продуктивными. Высокопроизводительные команды знают свое «почему» и работают вместе, чтобы поддержать общее видение.
3. Они определили роли и обязанности.
Конфликт может быстро расстроить талантливую и продуктивную команду. Высокопроизводительные команды сводят к минимуму ненужные конфликты, четко определяя роль и обязанности каждого человека.Это предотвращает путаницу в отношении прав собственности на проект, поддерживает порядок рабочих процессов и сроков, а также обеспечивает подотчетность по всем направлениям.
4. Они общаются четко и уважительно.
Когда связь прерывается, возникает конфликт и ухудшается производительность. Высокопроизводительные команды устанавливают четкие ожидания и каналы для общения, чтобы все знали, когда и где общаться и с кем им нужно связаться. Конфликт — это нормально, но высокопроизводительные команды знают, как разрешить его здоровым образом, не создавая дополнительных препятствий.
5. Они управляют работой и сроками на основе приоритетов.
Высокопроизводительные команды сосредотачиваются на самом важном и соответственно тратят время. Они понимают, что не вся работа имеет одинаковую важность или срочность, и управляют проектами в зависимости от того, какие задачи имеют наивысший приоритет и наибольшую отдачу. Это позволяет согласовывать работу с целями организации и гарантирует, что каждый будет сосредоточен на работе, которая способствует росту.
6. Они доверяют и уважают друг друга.
Уровень сотрудничества и командной работы, необходимый для достижения высоких результатов, зависит от доверия и взаимного уважения. Сотрудники высокоэффективных команд ценят друг друга и доверяют каждому выполнение своей работы. Они уважают разнообразие мыслей и опыта и признают, что различия делают их сильнее. Эта культура доверия помогает всем:
- Принять участие в работе
- Рисковать
- Поделиться идеями
- Создавайте инновации вместе
7.Они вместе празднуют успех и признают вклад.
Высокопроизводительные команды понимают, что успех является результатом командных усилий. Они вместе празднуют победы и используют возможности, чтобы признать и выразить признательность за вклад каждого сотрудника. Это создает прочную культуру сотрудничества и помогает каждому почувствовать себя ценным и связанным.
8. Они практикуют непрерывное обучение.
Даже лучшим командам есть куда расти. Высокопроизводительные команды ценят обратную связь и учатся на своих ошибках.Они ищут возможности для роста, взращивая культуру обратной связи и инвестируя в постоянное развитие сотрудников. Непрерывное обучение способствует росту и заставляет команды стремиться к более высоким достижениям.
Создание высокопроизводительной команды
Создание высокоэффективной команды не происходит в одночасье. Это требует приверженности и инвестиций в постоянный рост и развитие. Для начала воспользуйтесь следующими советами:
Создайте общее чувство цели.
Чтобы сотрудники чувствовали себя связанными с командой, им нужна единая цель. Здесь в игру вступают четкие цели и сплоченность команды.
Менеджеры высокоэффективных команд всегда оценивают приоритеты и командные цели, чтобы гарантировать их эффективность и согласованность. Помните о целях организации, регулярно сообщая об этих целях и связывая их с работой команды.
Воспользуйтесь возможностью индивидуальной встречи, чтобы узнать с членами команды об их успехах, определить ключевые приоритеты и убедиться, что их работа соответствует общим целям команды.Это помогает создать общее чувство цели и гарантирует, что команда будет работать в одном направлении для повышения производительности.
Оптимизация общения.
Высокопроизводительные команды должны быть гибкими и целеустремленными, поэтому четкое и упорядоченное общение имеет важное значение. Держите всех на одной странице, установив четкие процессы и ожидания в отношении общения.
Например, команды могут использовать каналы Slack для чатов с водяным охлаждением и обновлений команд, но полагаться на инструменты управления проектами, такие как Asana, для хранения данных проекта, определения обязанностей и отслеживания прогресса и назначений.
Установление коммуникационных процессов помогает предотвратить конфликты и обеспечивает передачу ключевой информации нужным людям, четкие задания и обязанности, и ничто не проходит незамеченным.
Инвестируйте в развитие сотрудников.
Если вы хотите стабильно выдающихся результатов, создайте культуру постоянного обучения и совершенствования. Любопытны высокопроизводительные команды. Они задают вопросы, исследуют возможности и адаптируются на основе того, что узнают.Когда команды постоянно наращивают свои знания и учатся на прошлых ошибках, они становятся более эффективными, действенными и новаторскими.
Повышайте эффективность команды, инвестируя в рост и развитие своих сотрудников. Определите соответствующие возможности развития, которые сосредоточены на потребностях и приоритетах команды, а также на индивидуальных целях. Возможности развития сотрудников помогают сотрудникам чувствовать себя мотивированными, уполномоченными и лучше подготовленными для выполнения своей работы.
Создание высокопроизводительной команды — это марафон, а не спринт.Но когда вы соберете правильное сочетание навыков и опыта и воспользуетесь этими фундаментальными характеристиками высокопроизводительной команды, результат того стоит.
Высокопроизводительные команды состоят из высококвалифицированных сотрудников, которые чувствуют поддержку со стороны своих менеджеров и преследуют единую цель — способствовать успеху команды и бизнеса. Из этой электронной книги вы узнаете, как сделать так, чтобы ваши менеджеры были коучингом сотрудников для достижения высокой производительности.
Установление рабочих характеристик устройств для диагностики in vitro для обнаружения или выявления и дифференциации вирусов гриппа — Руководство для промышленности и персонала FDA
- Номер дела:
- FDA-2008-D-0095
- Выдал:
Отдел выдачи инструкций
Центр приборов и радиологического здоровья
Версия принтера PDF
(339 КБ)
Документ выдан: 15 июля 2011 г.
Проект данного документа выдан 15 февраля 2008 г.
С вопросами относительно этого документа обращайтесь к Тамаре Фельдблюм по телефону 301-796-6195 или по электронной почте тамара[email protected].
Министерство здравоохранения и социальных служб США |
Предисловие
Общественный комментарий
Вы можете в любое время направить письменные комментарии и предложения на рассмотрение Агентства в Отдел по ведению документации, Управления по контролю за продуктами и лекарствами, 5630 Fishers Lane, rm.1061, (HFA-305), Rockville, MD, 20852. Отправляйте электронные комментарии по адресу http://www.regulations.gov. Идентифицируйте все комментарии с номером в реестре FDA-2008-D-0095. Агентство не может предпринимать никаких действий по комментариям до тех пор, пока документ не будет в следующий раз пересмотрен или обновлен.
Дополнительные копии
Дополнительные копии доступны в Интернете. Вы также можете отправить запрос по электронной почте на адрес [email protected], чтобы получить электронную копию руководства, или отправить запрос по факсу на номер 301-847-8149, чтобы получить бумажную копию.Используйте номер документа 1638, чтобы определить запрашиваемое вами руководство.
Содержание
- Введение
- Фон
- Объем
- Риск для здоровья
- Описание устройства
- Использование по назначению
- Методика испытаний
- Инструменты — оборудование и программное обеспечение
- Вспомогательные реагенты
- Ограничения
- Элементы управления
- Интерпретация и отчет о результатах испытаний
- Установление рабочих характеристик
- Аналитические характеристики
- Аналитическая чувствительность
- Аналитическая специфичность
- Зона отсечки и эквивалентная зона
- точность
- Исследования переноса и перекрестного загрязнения (для анализов с несколькими пробами и устройств, требующих инструментов.)
- Условия хранения и транспортировки образцов
- Исследования клинической эффективности
- Протокол исследования
- Исследуемая группа
- Образцы
- Свежие и замороженные образцы
- Учебные площадки
- Справочные методы
- Проверка эффективности после выхода на рынок
- Отказ от CLIA
- Устройства против гриппа на основе нуклеиновых кислот
- Экстракция нуклеиновой кислоты
- Контроли для анализов гриппа на основе нуклеиновых кислот
- Аналитические характеристики
- Список литературы
Руководство для промышленности и персонала FDA
Установление характеристик производительности
In vitro Диагностические устройства для обнаружения или обнаружения и дифференциации вирусов гриппаЭто руководство отражает текущие взгляды Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по этой теме.Он не создает и не предоставляет каких-либо прав для какого-либо лица и не связывает FDA или общественность. Вы можете использовать альтернативный подход, если он удовлетворяет требованиям применимых законодательных и нормативных актов. Если вы хотите обсудить альтернативный подход, свяжитесь с персоналом FDA, ответственным за выполнение этого руководства. Если вы не можете определить соответствующий персонал FDA, позвоните по соответствующему номеру, указанному на титульной странице данного руководства.
1. Введение
FDA выпускает это руководство, чтобы предоставить персоналу отрасли и агентств рекомендации по исследованиям для определения аналитических и клинических характеристик диагностических устройств (IVD) in vitro, предназначенных для обнаружения или обнаружения и дифференциации вирусов гриппа.Эти устройства используются для диагностики гриппа. К ним относятся устройства, которые обнаруживают один конкретный тип или подтип, а также устройства, которые обнаруживают более одного типа или подтипа вируса гриппа и дополнительно дифференцируют их. 1
В этом руководстве содержится подробная информация о типах данных, которые FDA рекомендует предоставлять в поддержку предпродажной подачи данных устройств класса I и класса II. Руководство включает список штаммов вируса гриппа, рекомендованных для аналитических исследований чувствительности, список микроорганизмов, рекомендуемых для аналитических исследований специфичности, и пример предлагаемого формата для представления данных исследований перекрестной реактивности.
Область применения этого документа ограничена типами данных, предназначенных для определения рабочих характеристик устройств, которые обнаруживают либо вирусный антиген (ы) гриппа, либо сегмент (ы) вируса гриппа. Он включает устройства для обнаружения белков или нуклеиновых кислот-мишеней вируса гриппа, как в формате единичных тестов, так и в форматах нескольких тестов. Он не касается производительности для анализов, определяющих серологический ответ хозяина на вирусный антиген, и не касается установления производительности не связанных с гриппом компонентов мультианализируемых или мультиплексных устройств.
Руководящие документы FDA, включая это руководство, не устанавливают юридически обязательных обязательств. Вместо этого руководящие документы описывают текущее мышление Агентства по теме и должны рассматриваться только как рекомендации, если не указаны конкретные нормативные или законодательные требования. Использование слова следует в руководящих документах Агентства означает, что что-то предлагается или рекомендуется, но не требуется.
2. Справочная информация
В этом документе рекомендуются исследования для определения рабочих характеристик диагностических устройств in vitro для обнаружения или обнаружения и дифференциации вирусов гриппа непосредственно из образцов человека или из культуральных изолятов.FDA считает, что эти рекомендуемые исследования будут актуальны для предпродажных работ (например, 510 (k)), которые могут потребоваться для конкретного устройства.
Производитель, который намеревается продавать диагностическое устройство in vitro для обнаружения или обнаружения и дифференциации вирусов гриппа, должен соблюдать общие меры контроля Федерального закона о пищевых продуктах, лекарствах и косметических средствах (Закон) и, если не исключено, получить предпродажное разрешение или одобрение перед продажей устройства (разделы 510 (k), 513, 515 Закона; 21 U.С.С. 360 (k), 360c, 360e)).
Этот документ предназначен для дополнения 21 CFR 807.87 (информация, требуемая в предварительном уведомлении) и других ресурсов FDA, таких как «Предварительное уведомление: 510 (k)» и «Руководство для сотрудников отрасли и FDA: формат для традиционного и сокращенного 510 ( k) s. »
Кроме того, этот документ дополняет два руководящих документа FDA, которые конкретно касаются IVD гриппа: « In Vitro, диагностических устройств для обнаружения вирусов гриппа A: маркировка и нормативный путь» и «Руководящий документ по специальным мерам контроля класса II: реагенты для обнаружения специфических вирусов. Новые вирусы гриппа А.”
В руководящем документе под названием « In vitro, диагностические устройства для обнаружения вирусов гриппа A: маркировка и нормативный путь» рассматриваются рекомендации по выполнению требований к маркировке, применимых ко всем диагностическим устройствам in vitro , предназначенным для обнаружения вирусов гриппа A (или A / B). ) вируса непосредственно из образцов человека, с особым упором на обеспечение соответствующей маркировки продаваемых на законных основаниях тестовых устройств гриппа A (или A / B), разрешение которых не основано на данных, касающихся эффективности в отношении новых вирусов гриппа A, инфицирующих людей (включая H5N1). .В нем также обсуждается мнение FDA о премаркетинговых путях для новых или модифицированных продуктов, предназначенных для обнаружения вирусов гриппа A, включая новый вирус гриппа A, или для обнаружения и дифференциации конкретного вируса гриппа A.
Руководящий документ, озаглавленный «Руководящий документ по особым мерам контроля класса II: Реагенты для обнаружения конкретных новых вирусов гриппа A», является одним из двух специальных средств контроля для реагентов для обнаружения конкретных новых вирусов гриппа A, отнесенных к классу II в соответствии с 21 CFR 866.3332. Этот специальный руководящий документ по контролю включает рекомендации по установлению характеристик устройства, а также рекомендации по маркировке и мерам послепродажного обслуживания. Устройства, классифицированные в соответствии с 21 CFR 866.3332, подлежат дополнительному специальному контролю, ограничивающему распространение этих устройств среди лабораторий с опытным персоналом, прошедшим подготовку по стандартизированным процедурам молекулярного тестирования и имеющим опыт вирусной диагностики и соответствующего оборудования для обеспечения биобезопасности и защиты.
Это руководство предназначено для дополнения двух предыдущих руководящих документов, описывая типы исследований, которые FDA рекомендует для определения аналитических и клинических характеристик in vitro, диагностических устройств (IVD), предназначенных для обнаружения или обнаружения и дифференциации вирусов гриппа. .FDA рекомендует спонсорам устройств для диагностики гриппа использовать это руководство в сочетании с двумя существующими руководствами по диагностике гриппа для получения информации о текущих взглядах FDA на регулирование этих устройств.
3. Сфера применения
Как описано ранее, в этом документе рекомендуются исследования для определения рабочих характеристик диагностических устройств in vitro, для обнаружения или обнаружения и дифференциации вирусов гриппа, в том числе для обнаружения новых вирусов гриппа в образцах человека или культуральных изолятах.Этот документ ограничен исследованиями, предназначенными для определения рабочих характеристик устройств, которые либо обнаруживают антигены вируса гриппа, либо сегменты гена вируса гриппа (белок или нуклеиновая кислота). Это руководство ссылается на серологические реагенты, но не касается выявления серологического ответа хозяина на вирусный антиген, а также не касается установления характеристик не связанных с гриппом компонентов мультианализируемых или мультиплексных устройств.
В объем данного документа входят устройства, описанные в существующих классификациях, как указано ниже, а также могут быть применимы к будущим устройствам для диагностики гриппа, которые могут не подпадать под эти существующие классификации.Эти будущие устройства могут включать устройства, которые будут подлежать запросам на первоначальную классификацию в соответствии с разделом 513 (f) (2) закона (« de novo классификация»), а также последующие устройства, которые будут искать определения существенной эквивалентности будущим de novo классифицированных устройств.
Существуют следующие правила классификации IVD гриппа:
21 CFR 866.3330 Серологические реактивы вируса гриппа:
(а) Идентификация.Серологические реагенты вируса гриппа — это устройства, состоящие из антигенов и антисывороток, используемые в серологических тестах для выявления антител к гриппу в сыворотке крови. Идентификация помогает в диагностике гриппа (гриппа) и предоставляет эпидемиологическую информацию о гриппе. Грипп — острое заболевание дыхательных путей, которое часто носит эпидемический характер.
(б) Классификация. Класс I (общий контроль). На устройство не распространяются процедуры предварительного уведомления, описанные в подразделе E части 807 данной главы, с учетом ограничений в § 866.9.
Хотя устройства, входящие в классификацию, описанную в 21 CFR 866.3330, являются устройствами Класса I, которые, как правило, не подлежат предварительному уведомлению (21 USC 360 (l)) в соответствии с правилами FDA, предварительное уведомление может потребоваться для некоторых тестов, которые якобы подпадают под этот тип. устройства. В частности, IVD для выявления гриппа не освобождается от подачи 510 (k) в той степени, в которой он соответствует ограничениям на освобождение, определенным в 21 CFR 866.9:
.- В соответствии с 21 CFR 866.9 (c) (6), IVD, которое предназначено для использования в для идентификации или определения идентичности микроорганизма непосредственно из клинического материала , не освобождается от требований к предварительному уведомлению. IVD, предназначенное для обнаружения вируса гриппа непосредственно в образце человека, подпадает под это положение.
- Кроме того, IVD для выявления гриппа может нарушить ограничения 21 CFR 866.9 (a), если новое устройство предназначено для использования, отличного от предполагаемого использования официально продаваемого устройства , классифицированного в соответствии с 21 CFR 866.3330; или может нарушить ограничения 21 CFR 866.9 (b), если он работает с использованием другой фундаментальной научной технологии из существующих тестов на грипп в этой классификации.
Ниже приведены коды продуктов для устройств, сертифицированных в соответствии с 21 CFR 866.3330:
GNS — Антисыворотка, HAI, вирус гриппа A, B, C
GNT — Антигены, HA (включая контроль HA), вирус гриппа A, B, C
GNX — Антигены, CF, включая контроль CF, вирус гриппа A, B, C
GNW — Антисыворотка, CF, вирус гриппа A, B, C
NIA — Амплификация нуклеиновой кислоты, вирус гриппа
21 CFR 866.3332 Реагенты для обнаружения специфических новых вирусов гриппа A
(а) Идентификация. Реагенты для обнаружения специфических новых вирусов гриппа A — это устройства, которые предназначены для использования в тесте амплификации нуклеиновых кислот для непосредственного обнаружения специфической вирусной РНК в образцах из дыхательных путей человека или вирусных культурах. Обнаружение специфической вирусной РНК помогает в диагностике гриппа, вызванного специфическими новыми вирусами гриппа A, у пациентов с клиническим риском заражения этими вирусами, а также помогает в предположительной лабораторной идентификации специфических новых вирусов гриппа A для получения эпидемиологической информации о гриппе.Эти реагенты включают праймеры, зонды и специфические средства контроля вируса гриппа А.
(б) Классификация. Класс II (специальные контроли). Специальные элементы управления:
(1) Руководящий документ FDA, озаглавленный «Руководящий документ по специальным мерам контроля класса II: Реагенты для обнаружения конкретных новых вирусов гриппа А.». См. § 866.1 (e) для получения информации о получении этого документа.
(2) Распространение этих устройств ограничено лабораториями с опытным персоналом, прошедшим подготовку по стандартизированным процедурам молекулярного тестирования и имеющим опыт вирусной диагностики, а также соответствующим оборудованием для обеспечения биобезопасности и защитой.
Ниже приведены коды продуктов для устройств, сертифицированных в соответствии с 21 CFR 866.3332:
. NXD — Амплификация нуклеиновой кислоты, вирус нового гриппа A, РНК A / H5 (азиатская линия)
OMS — вирус нового гриппа A, белок NS1 A / H5
4. Риски для здоровья
Грипп человека — очень заразное острое заболевание дыхательных путей. Существует три рода вирусов гриппа человека: A, B и C. Инфекция вирусом гриппа A является наиболее серьезной, за последнее столетие произошло несколько заметных пандемий.Вирусы гриппа A классифицируются на подтипы в соответствии с антигенным составом их гликопротеинов гемагглютинина (HA) и нейраминидазы (NA) на вирусной оболочке.
Заболевания, вызываемые широко циркулирующими вирусами гриппа, могут вызывать высокие показатели заболеваемости и смертности, особенно среди особых групп населения, таких как пожилые и очень молодые. Развитие приобретенного иммунитета к вирусам сезонного гриппа ограничено, поскольку вирусы гриппа из года в год мутируют небольшими, но важными способами (процесс, известный как антигенный дрейф).Более драматические изменения или серьезные антигенные сдвиги могут привести к появлению нового подтипа вируса гриппа А или нового вируса, который никогда не циркулировал или не циркулировал среди людей в течение нескольких десятилетий. Новые вирусы гриппа могут вызывать широко распространенное заболевание и / или заболевание необычно высокой степени тяжести, потому что лишь немногие люди, если таковые вообще имеются, ранее подвергались воздействию этих вирусов. Это отсутствие иммунитета, а также дополнительные патогенные факторы, которые также могут увеличивать вирулентность, приводят к большей вероятности заболеваемости и смертности среди инфицированных.
In vitro диагностические устройства для обнаружения или обнаружения и дифференциации вирусов гриппа важны для постановки диагноза гриппа, для дифференциации сезонных штаммов вирусов гриппа от новых и для получения эпидемиологической информации о вспышках гриппа. Должностные лица общественного здравоохранения подчеркнули необходимость в надежных устройствах для диагностики гриппа, которые могут отличать сезонные штаммы вирусов от новых и обеспечивать результаты быстрых тестов.
Неспособность устройств для обнаружения вирусов гриппа работать должным образом или неспособность правильно интерпретировать результаты могут привести к неправильным решениям по ведению пациентов и неадекватным ответам со стороны общественного здравоохранения. В контексте индивидуального ведения пациентов ложноотрицательный отчет может привести к задержкам в предоставлении (или непредоставлении) окончательного диагноза и соответствующего лечения, а также мер инфекционного контроля и профилактики. Ложноположительный отчет может привести к ненужному или несоответствующему лечению или ненужным действиям по контролю и профилактике.Следовательно, определение характеристик этих устройств и понимание рисков, которые могут быть связаны с использованием этих устройств, имеют решающее значение для их безопасного и эффективного использования.
Исследования по установлению характеристик устройств для обнаружения гриппа, как описано в этом руководящем документе, рекомендуется для подтверждения предпродажных работ и вывода FDA о существенной эквивалентности этих устройств.
5. Описание устройства
Вы должны идентифицировать легально продаваемое предикатное устройство в своем 510 (k).21 CFR 807.92 (а) (3). Вы также должны указать правила и код продукта для вашего устройства. Мы рекомендуем включить таблицу, в которой описаны сходства и различия между предикатом и новым устройством. Вы должны включить следующую описательную информацию, чтобы адекватно охарактеризовать новое устройство, которое предназначено для обнаружения или обнаружения и дифференциации вирусов гриппа.
5.A Использование по назначению
В заявлении о предполагаемом использовании должны быть указаны типы и подтипы вируса гриппа, которые устройство обнаруживает и идентифицирует, природу анализируемого вещества (например,g., антиген или РНК), тестовая платформа, типы образцов, для которых будет показано тестирование, клинические показания, для которых тест будет использоваться, и конкретная популяция (группы), для которых тест предназначен. В заявлении о предполагаемом использовании должно быть указано, является ли тест качественным, является ли обнаружение аналита предположительным, а также какие-либо особые условия использования.
5.B Методика испытаний
Вы должны подробно описать методологию, используемую вашим устройством. Например, должны быть включены следующие элементы применительно к устройству:
- Описание технологии (эл.g., иммуноанализ, RT-PCR, набор гранул), а также то, является ли устройство ручным тестом или запускается на приборе.
- Информация и обоснование для выбора конкретных мишеней и методов, используемых для конструирования антител или праймеров и зондов.
- Специфичность реагентов для захвата и обнаружения интересующих антигенов гриппа или последовательностей нуклеиновых кислот.
- Типы образцов и методы сбора (например, мазки, аспираты, вирусные культуральные среды и т. Д.).
- Компоненты анализа, предоставленные или рекомендованные для использования, и их функции в системе (например,g., буферы, ферменты, флуоресцентные красители, приборы и программное обеспечение).
- Внутренний контроль и описание их конкретной функции в системе.
- Внешние элементы управления, рекомендуемые или предоставляемые пользователям.
- Типы выходных данных, генерируемых устройством и параметрами системы (например, диапазоны измерения, единицы измерения, если применимо).
- Вычислительный путь от исходных данных к сообщаемому результату (подробности см. В Разделе 5.C ниже «Приборы — Аппаратное и программное обеспечение»).
- Иллюстрации или фотографии нестандартного оборудования или методов.
Ваш 510 (k) должен содержать информацию о характеристиках, подтверждающую вывод о том, что требования к контролю конструкции для вашего устройства были выполнены, как описано в 21 CFR 820.30.
5.C Инструменты — Аппаратное и программное обеспечение
Для приборов и систем, которые измеряют множественные сигналы, а также для других сложных лабораторных приборов, которые ранее не прошли аттестацию, обратитесь к руководящему документу «Руководящий документ по специальным средствам контроля класса II: приборы для клинических мультиплексных тестовых систем» [1] для получения подробной информации о типы данных по приборам, которые вы должны предоставить для подтверждения допуска.
Если ваше устройство включает программное обеспечение, вы должны предоставить информацию о программном обеспечении в соответствии с уровнем беспокойства, описанным в руководящем документе FDA «Руководство по содержанию предпродажных заявок на программное обеспечение, содержащееся в медицинских устройствах» [2]. Вы должны определить уровень беспокойства до устранения опасностей. In vitro диагностические устройства этого типа обычно вызывают умеренное беспокойство; недостатки программного обеспечения могут косвенно повлиять на пациента и потенциально привести к травмам, поскольку неточная информация может быть предоставлена поставщику медицинских услуг и пациенту.
Вы должны четко описать, как необработанные сигналы преобразуются в результат, включая корректировку фонового сигнала для нормализации, если применимо. Мы также рекомендуем вам включить в заявку следующую информацию для разработки и внедрения программного обеспечения:
- Системные и программные требования
- Анализ опасностей
- Схема архитектурного проектирования
- Спецификация разработки программного обеспечения
- Описание среды разработки программного обеспечения
- Проверка и подтверждение
- Анализ прослеживаемости
- Неразрешенные аномалии
Перед началом клинических исследований конфигурация аппаратных и программных компонентов должна быть очень похожа или идентична окончательной версии устройства.Оценка риска должна проводиться, если в аппаратное или программное обеспечение вносятся какие-либо существенные изменения после завершения клинических исследований, но до разрешения и распространения устройства.
Ниже приведены дополнительные ссылки, которые помогут вам разрабатывать и поддерживать устройство в соответствии с надлежащими практиками жизненного цикла программного обеспечения в соответствии с правилами FDA.
5.D Дополнительные реагенты
Вспомогательные реагенты — это те реагенты, которые указаны в маркировке устройства как «требуемые, но не поставляемые» для проведения анализа, как указано в инструкциях по применению.Вспомогательные агенты, вызывающие озабоченность в этом контексте, — это те, которые указаны, например, по названию производителя и / или номеру продукта. Например, если на этикетке вашего устройства указано использование фермента амплификации ДНК марки X, а использование любого другого фермента амплификации ДНК может изменить рабочие характеристики устройства по сравнению с теми, которые указаны в маркировке, то фермент амплификации ДНК марки X является вспомогательным реагентом. беспокойства. Напротив, если ваше устройство требует использования 95% этанола, а 95% этанол любой марки позволит устройству достичь рабочих характеристик, указанных в маркировке, 95% этанол не является дополнительным реагентом, вызывающим озабоченность.
Если в инструкциях по эксплуатации вашего устройства указаны вспомогательные реагенты, вызывающие озабоченность, вы должны указать, как вы обеспечите, чтобы результаты тестирования с вашим устройством и этими вспомогательными реагентами в соответствии с инструкциями соответствовали характеристикам, установленным в предмаркетная подача. Необходимо приложить все усилия, чтобы включить вспомогательные реагенты в систему качества вашей компании, рекомендуя использовать только те вспомогательные реагенты, которые, как вы определили, соответствуют стандартам качества для вашего теста.План может включать применение подходов к системе качества, маркировку продукции и другие меры. Вы должны включить в свою заявку элементы, описанные ниже.
- Оценка риска, связанная с использованием вспомогательных реагентов, включая риски, связанные с управлением качеством и изменчивостью реагентов, риски, связанные с любым несоответствием между инструкциями по применению, прилагаемыми непосредственно к вспомогательному реагенту, и инструкциями, предоставленными производителем вместе с устройством, и любые другие проблемы, которые могут представлять риск получения неверных результатов с вашим устройством.
- Используя вашу оценку риска в качестве основы, вы должны описать, как вы намереваетесь снизить риски посредством реализации любых необходимых мер контроля за вспомогательными реагентами. Они могут включать, где это применимо:
- Планы оценки соблюдения пользователем инструкций по маркировке вспомогательных реагентов.
- Характеристики материалов для вспомогательных реагентов в маркировке.
- Идентификация партий реагентов, обеспечивающих надлежащую производительность вашего устройства.
- Тестирование стабильности.
- Рассмотрение жалоб.
- Корректирующие и предупреждающие действия.
- Планы по предупреждению пользователей в случае проблем, связанных с дополнительными реагентами, которые могут повлиять на производительность вашего устройства.
- Любые другие проблемы, которые необходимо решить для обеспечения безопасного и эффективного использования вашего теста при использовании в сочетании с названными вспомогательными реагентами в соответствии с инструкциями по применению устройства.
Кроме того, вы должны предоставить данные тестирования, чтобы установить, что предоставленные или рекомендуемые средства контроля качества подходят для обнаружения проблем с производительностью или стабильностью вспомогательных реагентов.
6. Ограничения
Вы должны включить заявление об ограничениях процедуры в маркировку, сопровождающую продукт (21 CFR 809.10 (b) (10)). Это должно включать потенциальные проблемы, которые могут повлиять на производительность вашего устройства и не были учтены в ваших аналитических или клинических исследованиях. Вы должны указать любые потенциальные риски, связанные с использованием устройства, в разделах «Предупреждение» и «Ограничения» на этикетке устройства. Мы рекомендуем включать такие утверждения, как перечисленные ниже, которые относятся к вашему устройству:
- Обнаружение вирусной нуклеиновой кислоты [или вирусного антигена] зависит от надлежащего сбора образцов, обращения с ними, транспортировки, хранения и подготовки, включая экстракцию.Несоблюдение надлежащих процедур на любом из этих шагов может привести к неверным результатам.
- Отрицательные результаты не исключают заражения вирусом гриппа и не должны использоваться в качестве единственной основы для лечения или других решений по ведению пациента.
- Результаты для [ имя устройства ] должны быть соотнесены с историей болезни, эпидемиологическими данными и другими данными, доступными для клинициста, оценивающего пациента.
- Вирусные нуклеиновые кислоты могут сохраняться in vivo независимо от жизнеспособности вируса.Обнаружение цели (ей) аналита не означает, что соответствующий вирус (ы) является инфекционным или является возбудителем клинических симптомов.
- Это устройство было протестировано для использования только с материалами, взятыми у человека.
- Ложноотрицательные результаты могут быть получены, если количество организмов в клиническом образце ниже пределов обнаружения устройства.
- Если вирус мутирует в целевой области, вирус гриппа может быть не обнаружен или может быть обнаружен менее предсказуемо.
- Это устройство является качественным тестом и не дает информации о вирусной нагрузке в образце.
- Эффективность этого устройства не оценивалась на пациентах без признаков и симптомов гриппа.
- Эффективность этого устройства не оценивалась для мониторинга лечения гриппозной инфекции.
- Эффективность этого устройства не оценивалась при проверке крови или продуктов крови на наличие гриппа.
- Этот тест не может исключить заболевания, вызванные другими бактериальными или вирусными патогенами.
- Действие мешающих веществ оценивалось только для тех, которые указаны на этикетке. Вмешательство других веществ, кроме описанных ниже, может привести к ошибочным результатам.
- Перекрестная реактивность с микроорганизмами дыхательных путей, кроме перечисленных ниже [в маркировке], может привести к ошибочным результатам.
- Эффективность этого устройства не оценивалась для пациентов, получавших интраназально вводимую вакцину против гриппа.
- Эффективность этого устройства не оценивалась для людей с ослабленным иммунитетом.
- Распространенность инфекции влияет на прогностическую ценность теста.
7. Органы управления
При проведении исследований производительности, описанных ниже, мы рекомендуем запускать соответствующие внешние средства контроля каждый день тестирования на протяжении аналитических и клинических исследований. Примеры подходящего внешнего контроля включают вакцины или прототипные вакцинные штаммы, низкопатогенные вирусы и инактивированные вирусы.Конкретная информация о средствах контроля для устройств на основе нуклеиновых кислот представлена в Разделе 9.E «Контроли для анализов на грипп на основе нуклеиновых кислот» данного руководящего документа. Вы можете связаться с отделом микробиологических устройств в офисе In Vitro, Диагностическое устройство оценки и безопасности (OIVD) в FDA для получения дополнительной информации о мерах контроля.
8. Интерпретация и сообщение результатов тестирования
Мы рекомендуем вам описать в своей заявке, как определяются положительные, отрицательные, двусмысленные (если применимо) или недействительные результаты и как их следует интерпретировать.Мы рекомендуем вам указать пороговые значения для всех результатов анализа, включая пороговое значение для определения отрицательного (или отрицательного / положительного) результата анализа. Если в анализе есть сомнительная зона, также должны быть определены пороговые значения (пределы) для сомнительной зоны. Если ваша интерпретация первоначальных сомнительных результатов требует повторного тестирования, вы должны предоставить (1) рекомендацию о том, следует ли проводить повторное тестирование того же препарата нуклеиновой кислоты, нового экстракта или нового образца пациента и (2) алгоритм для определения окончательного результата путем объединения первоначального сомнительного результата и результатов после повторного тестирования.Обратите внимание, что этот алгоритм должен быть разработан до основного клинического исследования, которое подтвердит значимость пороговых значений анализов, и алгоритм должен точно соблюдаться (например, выполнить повторное тестирование, новую экстракцию или сбор нового образца пациента) во время клинического исследования. исследование для оценки производительности устройства.
Если результат анализа можно считать или сообщить как «недействительный», вы должны описать, как определяются недействительные результаты. Если элементы управления являются частью определения недействительных результатов, вы должны описать каждую возможную комбинацию результатов управления для определения недопустимого результата.Вы должны дать рекомендации о том, как действовать в соответствии с любым недействительным результатом, т.е. следует ли сообщать о результате как недействительный или образец следует повторно протестировать. Если рекомендуется повторное тестирование, предоставьте информацию, аналогичную информации для повторного тестирования неоднозначных результатов (следует ли проводить повторное тестирование того же препарата нуклеиновой кислоты, новой экстракции или нового образца пациента). Вы должны указать в заявке и на этикетке количество первоначальных недействительных результатов и количество повторных тестов, которые потребовались для определения окончательного результата во время учебы.Дополнительную информацию об оценке результатов и составлении отчетов можно найти в документе CLSI ILA 18-A2 [3].
9. Установление тактико-технических характеристик
9.A Аналитическая работа
Мы рекомендуем вам установить следующие аналитические характеристики для вашего анализа:
9.A.i Аналитическая чувствительность
Предел обнаруженияПредел обнаружения (LoD) определяется как самая низкая концентрация аналита, которая может быть постоянно обнаружена (обычно в ≥95% проб, тестируемых в обычных клинических лабораторных условиях) в образце определенного типа.Вы должны определить LoD для каждого типа образца и каждого аналита, который будет тестироваться с вашим устройством, с использованием всей тестовой системы от подготовки образца до обнаружения при оценке LoD анализа. Это может быть достигнуто путем ограничения разведения размножаемых и титрованных вирусных запасов. Исследование должно включать серийные разведения по крайней мере двух штаммов, репрезентативных по типам или подтипам для каждого заявленного вируса гриппа (предлагаемые вирусные штаммы см. В таблице 1) и 3-5 повторов для каждого разведения.Референсными методами, которые мы рекомендуем для определения LoD, являются: Инфекционная доза тканевой культуры 50 (TCID 50 ), Инфекционная доза яйца 50 (EID 50 ) или анализ бляшек. Поскольку устройства на основе нуклеиновых кислот обнаруживают не только инфекционные вирусные частицы, но и общую вирусную РНК, присутствующую в образце, может также использоваться дополнительный контрольный метод, количественное определение нуклеиновых кислот (например, эквивалент копии генома или мкг / мл вирусной РНК). включены. Вы должны сообщать о LoD как об уровне вируса, обеспечивающем 95% -ную степень обнаружения.LoD следует подтвердить, подготовив не менее 20 дополнительных реплик при концентрации LoD и продемонстрировав, что вирус выявлялся в 95% случаев.
Мы рекомендуем вам определять LoD для каждого аналита в наиболее часто используемой или наиболее сложной матрице, тестируемой устройством. Вы можете обратиться к документу EP17-A [4] Института клинических лабораторных стандартов (CLSI) за примерами дизайна исследования. При выборе подходящей матрицы для ваших аналитических исследований вы должны выбрать одну из двух альтернатив, указанных ниже:
- Отрицательные клинические образцы респираторных органов человека могут быть объединены для создания большого объема однородной матрицы образцов (например,g., отрицательные пулы носоглотки (NP), полученные из оставшихся клинических образцов мазков NP). Объединенная матрица должна быть просеяна перед добавлением.
- Вирусная транспортная среда (VTM) или другая смоделированная матрица может использоваться, если вы можете продемонстрировать в исследовании, что аналитические характеристики вашего анализа эквивалентны использованию предлагаемой смоделированной матрицы и естественной клинической матрицы, содержащей вирусы. Исследование может быть проведено собственными силами (то есть в вашей собственной компании) и включать ограниченное количество образцов (например,г., 60).
Мы рекомендуем вам продемонстрировать, что тест может обнаруживать как минимум 5 штаммов гриппа B и 10 штаммов для каждого подтипа гриппа A, обнаруженного вашим устройством. Обнаружение гриппа A должно быть проверено на всех подтипах, которыми инфицированы люди, и на вирусных уровнях на уровне LoD или рядом с ним. Следует включить штаммы гриппа B, представляющие обе линии (Victoria и Yamagata). Выбранные штаммы гриппа должны отражать временное и географическое разнообразие с упором на современные штаммы.Для каждого заявленного подтипа гриппа следует включить дополнительный набор штаммов, представляющих известные клоны и клады. Для подтипов, для которых трудно получить достаточное количество штаммов, чтобы продемонстрировать реактивность, мы рекомендуем вам связаться с Отделом микробиологических устройств для обсуждения вашего исследования. Все идентификаторы и титры вирусов должны быть подтверждены. Дополнительная информация о вирусных культурах и процедурах идентификации доступна в документе CLSI M41-A [5] и в руководстве ВОЗ [6].
Примеры рекомендованных штаммов для исследований LoD и аналитической реактивности показаны в таблице 1. Можно включить вакцинные штаммы (дикого типа) из недавних сезонов гриппа. Штаммы вакцины могут варьироваться от сезона к сезону гриппа. Информацию о текущих штаммах вакцин можно получить в Центрах по контролю и профилактике заболеваний (CDC) по адресу http://www.cdc.gov/flu/professionals [7].
Таблица 1. Примеры штаммов гриппа для исследований аналитической чувствительности (LoD).
| Тип | Подтип | Штамм вируса гриппа |
|---|---|---|
| А | х2Н1 | A / California / 7/2009 (h2N1) |
| А | h4N2-подобный | А / Перт / 16/2009 (h4N2) * |
| B | Б-как | B / Брисбен / 60/2008 |
| А | х2Н1 | A / PR / 8/34 |
| А | х2Н1 | A / FM / 1/47 |
| А | х2Н1 | A / NWS / 33 |
| А | х2Н1 | A1 / Денвер / 1/57 |
| А | х2Н1 | A / New Caledonia / 20/1999 |
| А | х2Н1 | A / Нью-Джерси / 8/76 |
| А | х2Н1 | A / Брисбен / 59/2007 |
| А | х2Н1 | A / Hawaii / 15/2001 |
| А | х4N2 | A / Порт-Чалмерс / 1/73 |
| А | х4N2 | A / Hong Kong / 8/68 |
| А | х4N2 | A2 / Aichi2 / 68 |
| А | х4N2 | A / Victoria / 3/75 |
| А | х4N2 | A / New York / 55/2004 |
| А | х4N2 | A2 / Висконсин / 67/2005 |
| B | B / Malaysia / 2506/2004 | |
| B | B / Lee / 40 | |
| B | B / Allen / 45 | |
| B | B / GL / 1739/54 | |
| B | B / Тайвань / 2/62 | |
| B | B / Hong Kong / 5/72 | |
| B | B / Мэриленд / 1/59 | |
| А | H5N1 | Человек и / или птица |
| А | H5N2 | Птичий |
| А | H7N2 | Человек и / или птица |
| А | H7N7 | Человек и / или птица |
| А | Другие подтипы | Виды людей и / или животных |
* A / Wisconsin / 15/2009 — это вирус, подобный A / Perth / 16/2009 (h4N2), и вирус вакцины 2010 года в Южном полушарии.
9.A.ii Аналитическая специфичность
ЭксклюзивностьМы рекомендуем продемонстрировать аналитическую специфичность вашего анализа на типах и подтипах гриппа, не обнаруженных вашим устройством. Панель эксклюзивности может состоять из хорошо охарактеризованных сезонных или новых штаммов гриппа, не обнаруженных вашим устройством, а также вирусов гриппа, не относящихся к человеку, которые, как было доказано, заражают людей. Относящиеся к устройствам на основе нуклеиновых кислот, для больших панелей или для штаммов гриппа, которые трудно культивировать, очищенные нуклеиновые кислоты могут быть определены количественно, например.грамм. копий генома / мл вместо определения вирусных титров. Нуклеиновые кислоты также могут быть определены количественно в тех случаях, когда в исследовании используются высокоочищенные вирусы гриппа, например очистка от вирусов гриппа в градиенте сахарозы.
Перекрестная реактивностьМы рекомендуем вам провести тест на потенциальную перекрестную реактивность с респираторными патогенами, не связанными с гриппом, и другими микроорганизмами, которыми могло быть инфицировано большинство населения. Мы рекомендуем вам подтвердить идентичность и титры вируса и бактерий и протестировать микроорганизмы на медицински значимых уровнях (обычно 106 КОЕ / мл или выше для бактерий и 10 5 БОЕ / мл или выше для вирусов).Микроорганизмы, рекомендованные для исследований перекрестной реактивности, перечислены в таблице 2. Относящиеся к устройствам на основе нуклеиновых кислот, для больших панелей или для организмов, которые трудно культивировать, очищенные нуклеиновые кислоты могут быть определены количественно, например копий генома / мл вместо определения вирусных или бактериальных титров. Нуклеиновые кислоты также могут быть определены количественно в тех случаях, когда в исследовании используются высокоочищенные организмы, например очистка от вирусов градиентом сахарозы.
Таблица 2. Микроорганизмы, рекомендованные для исследования аналитической специфичности (перекрестной реактивности).
| Организм | Тип |
|---|---|
| Аденовирус | Тип 1 |
| Аденовирус | Тип 7 |
| Коронавирус человека * | OC43 и 229E штаммы |
| Цитомегаловирус | |
| Энтеровирус | |
| Вирус Эпштейна-Барра | |
| Парагрипп человека | Тип 1 |
| Парагрипп человека | Тип 2 |
| Парагрипп человека | Тип 3 |
| Корь | |
| Метапневмовирус человека | |
| Вирус паротита | |
| Респираторно-синцитиальный вирус | Тип B |
| Риновирус | Тип 1A |
| Bordetella pertussis | |
| Chlamydia pneumoniae | |
| Corynebacterium sp. | |
| Escherichia coli | |
| Hemophilus influenzae | |
| Lactobacillus sp. | |
| Legionella spp | |
| Moraxella catarrhalis | |
| Mycobacterium tuberculosis | авиирулент |
| Mycoplasma pneumoniae | |
| Neisseria meningitidis | |
| Neisseria sp. | |
| Синегнойная палочка | |
| Золотистый стафилококк | Производитель протеина А, например, штамм Cowan |
| Эпидермальный стафилококк | |
| Streptococcus pneumoniae | |
| Streptococcus pyogenes | |
| Streptococcus salivarius |
Для устройств, определяющих несколько аналитов, например.g., гриппа A и B и каждого из подтипов гриппа A, вы должны установить, что перекрестная реактивность между типами и подтипами не обнаружена. Мы призываем спонсоров представлять данные тестирования перекрестной реактивности для устройств, обнаруживающих несколько патогенов, в формате, показанном в таблице 3).
Таблица 3. Пример представления данных.
| ПРИМЕР | Референтный реагент, результаты положительные (+) или отрицательные (-) для реактивности | |||||||
|---|---|---|---|---|---|---|---|---|
| Организм | Штамм | Адено | Грипп A | Грипп B | Пункт 1 | пункт 2 | пункт 3 | RSV |
| Аденовирус | Тип 1 | + | – | – | – | – | – | – |
| Тип 3 | + | – | – | – | – | – | – | |
| Тип 5 | + | – | – | – | – | – | – | |
| Тип 6 | + | – | – | – | – | – | – | |
| Тип 7 | + | – | – | – | – | – | – | |
| Тип 10 | + | – | – | – | – | – | – | |
| Тип 13 | + | – | – | – | – | – | – | |
| Тип 14 | + | – | – | – | – | – | – | |
| Тип 18 | + | – | – | – | – | – | – | |
| Тип 31 | + | – | – | – | – | – | – | |
| Тип 40 | + | – | – | – | – | – | – | |
| Тип 41 | + | – | – | – | – | – | – | |
| Грипп A | Айти (h4N2) | – | + | – | – | – | – | – |
| Мал (h2N1) | – | + | – | – | – | – | – | |
| Гонконг (h4N2) | – | + | – | – | – | – | – | |
| Денвер (h2N1) | – | + | – | – | – | – | – | |
| Порт Чалмерс (h4N2) | – | + | – | – | – | – | – | |
| Виктория (h4N2) | – | + | – | – | – | – | – | |
| WS (h2N1) | – | + | – | – | – | – | – | |
| ПР (х2Н1) | – | + | – | – | – | – | – | |
| Грипп B | Гонконг | – | – | + | – | – | – | – |
| Мэриленд | – | – | + | – | – | – | – | |
| Масса | – | – | + | – | – | – | – | |
| Тайвань | – | – | + | – | – | – | – | |
| GL | – | – | + | – | – | – | – | |
| Россия | – | – | + | – | – | – | – | |
| RSV | длинный | – | – | – | – | – | – | + |
| Мойка | – | – | – | – | – | – | + | |
| 9320 | – | – | – | – | – | – | + | |
Мы рекомендуем вам провести всестороннее исследование интерференции с использованием релевантных с медицинской точки зрения концентраций интерферента и не менее двух штаммов для каждого типа гриппа, чтобы оценить потенциально ингибирующие эффекты веществ, обнаруженных в респираторных образцах.
Потенциально мешающие вещества включают, помимо прочего, следующие: кровь, выделения из носа или слизь, а также лекарства для носа и горла, используемые для облегчения заложенности носа, сухости носа, раздражения или симптомов астмы и аллергии. Примеры потенциально мешающих веществ представлены в Таблице 4 ниже. Мы рекомендуем вам тестировать интерференцию на пороге анализа, определенном для каждого типа / подтипа вируса гриппа, обнаруженного вашим устройством, и для каждого из мешающих веществ.Мы также рекомендуем вам оценивать каждое мешающее вещество в его потенциально самой высокой концентрации («наихудший случай»). Если не наблюдается значительного эффекта, дальнейшее тестирование не требуется. Пожалуйста, обратитесь к документу CLSI EP7-A2 [8] для получения дополнительной информации.
Таблица 4. Вещества, рекомендованные для интерференционных исследований
| Вещество | Активный ингредиент |
|---|---|
| Муцин: подчелюстная железа крупного рогатого скота, тип I-S | Муцин очищенный |
| Кровь (человеческая) | |
| Спрей или капли назальные | Фенилэфрин, оксиметазолин, хлорид натрия с консервантами |
| Назальные кортикостероиды | Беклометазон, дексаметазон, флунизолид, триамцинолон, будесонид, мометазон, флутиказон |
| Гель назальный | Luffa opperculata, сера |
| Гомеопатическое лекарство от аллергии | Galphimia glauca, Histaminum hydrochloricum |
| FluMist © | Вакцина против вируса гриппа живая интраназальная |
| Пастилки для перорального анестетика и анальгетика для горла | Бензокаин, ментол |
| Противовирусные препараты | Занамивир |
| Антибиотик, мазь назальная | Мупироцин |
| Антибактериальное, системное | Тобрамицин |
9.A.iii Пороговая и сомнительная зона
В своей заявке вы должны объяснить, как определялось пороговое значение анализа и как значения порогового значения были подтверждены (см. Также Раздел 8, «Интерпретация и представление результатов теста»). Пороговое значение следует определять с использованием соответствующих статистических методов. Например, предоставьте распределение результатов, 95-й и 99-й процентили, проценты неотрицательных (положительных или сомнительных) результатов и другие статистические данные для клинических образцов без каких-либо респираторных вирусов (нулевая концентрация аналита), протестированных в ваших пилотных исследованиях. .Выбор подходящего порогового значения может быть обоснован соответствующими уровнями чувствительности и специфичности на основе анализа рабочей кривой приемника (ROC) пилотных исследований с клиническими образцами (подробные сведения об анализе ROC см. В документе CLSI GP10-A [9]. ). Если в анализе есть сомнительная зона, вам следует объяснить, как вы определили пределы сомнительной зоны. Рабочие характеристики вашего устройства с использованием заранее определенного порогового значения (и сомнительной зоны, если применимо) должны быть проверены на независимой группе в соответствии с определенным предполагаемым использованием вашего устройства.
9.A.iv Precision
Мы рекомендуем вам предоставить данные, демонстрирующие точность (т. Е. Повторяемость и воспроизводимость) вашей системы. Документы CLSI, EP5-A2 [10] и EP12-A2 [11], включают руководящие принципы, которые могут быть полезны для разработки соответствующего статистического экспериментального плана, расчетов и формата для установления заявленных характеристик. Точность должна быть установлена для каждого типа и подтипа вируса гриппа, обнаруженного отправленным устройством. Любая переменная, которая может повлиять на точность анализа, должна быть исследована.
Воспроизводимость между объектамиПротокол исследования воспроизводимости может незначительно отличаться в зависимости от формата анализа, но он должен включать оценку всех основных источников вариабельности, описанных ниже:
- Между сайтами и от оператора к оператору. Вы должны включить три или более сайта (например, два внешних сайта и один внутренний сайт) с несколькими операторами на каждом сайте. Операторы должны представлять конечных пользователей анализа с точки зрения образования и опыта.Вы должны проводить обучение только в той степени, в какой вы собираетесь обучать пользователей после продажи устройства. Мы рекомендуем, чтобы для быстрого тестирования или для устройств по месту обслуживания (POC) 2 вы включали в оценку большее количество тестов и операторов, чтобы лучше представить настройки, в которых будут использоваться устройства.
- Повседневная изменчивость. Тестирование должно проводиться в течение пяти дней подряд, включая минимум два цикла в день (если дизайн анализа не исключает нескольких прогонов в день) и три повтора каждого члена комиссии за цикл для оценки компонентов неточности между прогоном и внутри прогона. .Вариативность цикла может сочетаться с изменчивостью оператора, например, каждый цикл может выполняться другим оператором.
- Вариабельность от экстракции к экстракции. Для устройств, требующих стадии экстракции, таких как анализы амплификации нуклеиновых кислот, образцы, используемые в тесте воспроизводимости, должны обрабатываться на месте тестирования, начиная с клинических образцов (например, мазков из носоглотки), с использованием процедуры экстракции, которую вы рекомендуете в маркировке теста. . Если рекомендуется более одной процедуры экстракции, каждый метод экстракции следует оценивать на каждом участке отдельно (см. Также «Экстракция нуклеиновых кислот» в Разделе 9.E).
- Панель тестового образца должна представлять каждый тип и подтип вируса гриппа, обнаруженный вашим устройством, на трех уровнях вирусной нагрузки, включая аналит или выходные концентрации, близкие к пороговому значению анализа. Панель воспроизводимости может быть подготовлена путем добавления вирусов в пулы отрицательных клинических матриц, приготовленные из оставшихся клинических образцов.
- «сильно отрицательный» образец (концентрация C 5 ) с концентрацией аналита ниже клинически установленного порогового значения, так что результаты повторных тестов этого образца будут отрицательными примерно в 95% случаев, а результаты положительными примерно в 5%. того времени, (e.g., для ПЦР-анализов в реальном времени образец с концентрацией аналита не более чем в 10 раз ниже клинического порога анализа).
- «Низко положительный» образец (концентрация C 95 ) с концентрацией аналита чуть выше клинически установленного порогового значения, так что результаты повторных тестов этого образца являются положительными примерно в 95% случаев.
- «Умеренно положительный» образец должен отражать клинически значимую вирусную нагрузку 3 . При такой концентрации можно ожидать положительных результатов примерно в 100% случаев (например,g., примерно в два-три раза больше клинически установленного порогового значения).
- Для сверхчувствительного теста, для которого невозможно установить клинический порог на основе действительно отрицательных образцов (нулевая концентрация), может быть невозможно получить образец C 5 . Для такого устройства в исследовании прецизионности / воспроизводимости могут быть проверены следующие два уровня концентрации вместо рекомендованной выше концентрации C 5 :
- «Отрицательный» образец: образец с концентрацией аналита ниже клинического порогового значения, так что результаты повторных тестов этого образца будут отрицательными в 100% случаев, если менее 10% клинических образцов положительны по сравнению с эталоном. метод дает результаты в анализе ПЦР в реальном времени ниже порогового цикла (Ct), соответствующего LoD,
OR - Образец, близкий к пороговому значению (от C20 до C80): образец с концентрацией аналита чуть выше или ниже порогового значения анализа таким образом, что результаты повторных тестов этого образца являются положительными примерно от 20% до 80% время, если более 10% клинических образцов, положительных по контрольному методу, дают результаты ниже Ct, соответствующих LoD.
- «Отрицательный» образец: образец с концентрацией аналита ниже клинического порогового значения, так что результаты повторных тестов этого образца будут отрицательными в 100% случаев, если менее 10% клинических образцов положительны по сравнению с эталоном. метод дает результаты в анализе ПЦР в реальном времени ниже порогового цикла (Ct), соответствующего LoD,
Мы рекомендуем вам предоставить подробное описание дизайна исследования и использованного статистического анализа. Для факторов (например, калибровки прибора, операторов), учитываемых при исследовании точности, мы рекомендуем использовать сбалансированный факторный план, то есть исследование точности включает все возможные комбинации этих факторов.Например, если исследование точности выполняется в течение пяти дней с использованием двух операторов / прогонов и трех площадок, будет 5 дней, умноженных на 2 оператора на прогоны, умноженные на 3 сайта, что равняется 30 общим комбинациям различных уровней оцениваемых факторов. Если каждая комбинация оценивается с использованием 3 повторов, то это исследование дает 90 результатов на каждого члена комиссии. Как правило, для качественных тестов компоненты дисперсии следует оценивать с использованием соответствующих статистических моделей и методов для каждого из факторов, рассматриваемых в исследовании прецизионности.Следует описать смешанные источники изменчивости, а также общие вариации с указанием всех включенных факторов. Для качественных тестов, в основе которых лежат количественные результаты, компонент точности часто измеряется для каждого источника отклонений, а также для общего отклонения с помощью дисперсионного анализа. Для каждого члена комиссии в исследовании точности вы должны предоставить как отдельный анализ по площадкам, так и комбинированный анализ данных по площадкам, включая среднее значение с каждой оценкой компонента дисперсии (стандартное отклонение и процент CV), а также общую дисперсию.Например, для комбинированного анализа данных сайта, если исследование точности выполняется на трех площадках в течение пяти дней с использованием двух операторов на цикл и трех повторов на цикл, укажите среднее значение, стандартное отклонение и процент CV для общей дисперсии и компонентов дисперсии. для сайта на сайт, изо дня в день, от оператора / прогона к оператору / прогону и остаточного (репликация для репликации). Кроме того, для каждого члена панели вы должны указать проценты значений выше и ниже порогового значения и процент недействительных результатов для каждого сайта отдельно и для всех сайтов вместе.Если возможно, вы также должны предоставить процент неоднозначных результатов для каждого члена комиссии в исследовании точности для каждого сайта и для всех сайтов вместе взятых. Документ CLSI, EP15-A2 [12], содержит дополнительную информацию о дизайне исследования воспроизводимости.
Внутрилабораторная точность / повторяемостьМы рекомендуем вам проводить внутрилабораторные исследования точности устройств, которые включают инструменты или автоматизированные компоненты. Эти исследования могут быть выполнены собственными силами, т.е.е., в вашей собственной компании. Мы рекомендуем вам тестировать источники изменчивости (такие как операторы, дни, анализы и т. Д.) В течение как минимум 12 дней (не обязательно подряд), с двумя операторами, каждый из которых выполняет два цикла в день (всего четыре цикла за один день), и по два повтора каждого образца на цикл, всего 96 результатов для каждого члена тестовой группы. Эти тестовые дни должны охватывать как минимум два цикла калибровки, если цикл калибровки короче двух месяцев, а также должны представлять разные моменты времени в пределах одного цикла калибровки.Мы рекомендуем вам использовать тот же образец панели, который описан в разделе « Site-to-Site Reproducibility» выше . Мы рекомендуем использовать сбалансированный факторный план; то есть исследование точности должно включать все возможные комбинации оператора, цикла и дня. Например, исследование точности выполняется двумя операторами в течение 12 дней в течение двух прогонов. В этом примере 12 дней умножаются на два оператора, умноженные на два прогона, что равняется 48 общим комбинациям различных уровней для каждого оцениваемого фактора.Если каждую комбинацию оценивать в двух повторностях, то это исследование дает 96 результатов на каждого члена комиссии. Для двух повторов все факторы потенциального источника отклонений должны оставаться постоянными. Мы рекомендуем вам сообщать об этих результатах аналогично тому, как это описано в разделе « Site-to-Site Reproposibility» .
9.A.v Исследования переноса и перекрестного загрязнения (для анализов с несколькими пробами и устройств, требующих инструментария).
Для анализов с несколькими пробами и устройств, требующих оборудования, мы рекомендуем вам продемонстрировать, что с вашим устройством не происходит переходящего остатка и перекрестного загрязнения.При исследовании переходящего остатка и перекрестного загрязнения мы рекомендуем использовать пробы с высоким содержанием положительных проб последовательно, чередуя образцы с отрицательными пробами в зависимости от функциональной функции устройства. По крайней мере, 5 циклов с чередованием высоких положительных результатов (самая высокая вирусная нагрузка, обнаруженная в клинических образцах или минимум 10 5 БОЕ / мл) и высоких отрицательных образцов (как определено в разделе « Межсайтовая воспроизводимость », выше) должны выполняться. Мы рекомендуем, чтобы количество положительных образцов в исследовании было достаточно высоким, чтобы превышать 95% или более результатов, полученных на образцах от больных пациентов в популяции предполагаемого использования.В случае сверхчувствительного устройства образец с высоким отрицательным результатом может быть заменен на образец с отрицательным результатом (дополнительные пояснения см. В разделе «Воспроизводимость между площадками» выше). Эффект переходящего остатка и перекрестного загрязнения можно затем оценить по проценту отрицательных результатов для отрицательного образца в исследовании переходящего остатка [13].
9.A.vi Условия хранения и транспортировки образцов
Если вы рекомендуете условия хранения и транспортировки образцов, вы должны продемонстрировать, что ваше устройство генерирует эквивалентные результаты для хранимых образцов в нескольких временных точках на протяжении рекомендованного хранения и транспортировки при обоих концах рекомендуемого диапазона температур.Если вы рекомендуете вирусную транспортную среду (VTM) для хранения или транспортировки, вам следует провести соответствующие исследования и предоставить данные, показывающие, что один или несколько рекомендуемых VTM подходят и что устройство будет работать, как описано, когда образец хранится в рекомендованных условиях. VTM [5]. Вы должны включить в листок-вкладыш заявление об этом, также указав коммерческий источник или химический состав приемлемого (ых) VTM (ов).
9.B Исследования клинической эффективности
Мы рекомендуем вам провести проспективные клинические исследования, чтобы определить производительность вашего устройства по сравнению с установленными эталонными методами для всех типов и подтипов гриппа и каждого типа образца, который вы указываете в своей маркировке. 6
Протокол исследования 9.B.i
Мы рекомендуем вам разработать и включить в предмаркетную заявку подробный протокол исследования, который описывает:
- Критерии включения и исключения пациентов.
- Тип и количество необходимых образцов.
- Руководство по эксплуатации.
- План статистического анализа, который учитывает отклонения для предотвращения смещения данных.
- Документы, подтверждающие соблюдение правил защиты прав человека.
- Любая другая важная информация протокола.
Клинические исследования неутвержденных и не прошедших сертификацию диагностических устройств in vitro регулируются положениями об исключении исследуемых устройств (IDE) Раздела 520 (g) Федерального закона о пищевых продуктах, лекарствах и косметических средствах (21 USC 360j) и нормативными актами. . Вам следует подумать о том, как 21 CFR часть 812 (IDE) применима к вашему конкретному исследованию, и обратиться к 21 CFR, часть 50 (Информированное согласие) и 21 CFR, часть 56 (Institutional Review Board), чтобы узнать о других применимых требованиях.Исследовательские устройства, позволяющие дифференцировать подтипы гриппа A и выявлять новые вирусы гриппа, такие как грипп A / H5, с большой вероятностью соответствуют определению «устройства значительного риска» в 21 CFR 812.3 (m). Клинические исследования устройств со значительным риском требуют подачи заявки на IDE в FDA для рассмотрения и утверждения в соответствии с 21 CFR, часть 812. 7
Для исследуемых устройств, которые позволяют дифференцировать подтипы гриппа A A / h2, A / h4 и A / 2009 h2N1, но не грипп A / H5, мы рекомендуем, чтобы протокол клинического исследования определял процедуры для своевременного устранения неподдающихся подтипов результатов гриппа A, в том числе следующие шаги:
- Образец следует протестировать с помощью компаратора (согласно протоколу исследования), чтобы подтвердить результат как неподдающийся подтипу.
- Следует проявлять осторожность и соблюдать лабораторные СОП перед размножением неподдающегося подтипу вируса в культуре.
- В случае, если образец не подлежит подтипу с помощью метода сравнения, следует немедленно уведомить соответствующие местные, государственные и / или федеральные органы здравоохранения и следовать их инструкциям.
Мы призываем спонсоров связаться с Отделом микробиологических устройств и запросить обзор предлагаемых ими исследований и выбор типов образцов до начала исследований.Мы особенно рекомендуем производителям искать такого рода обсуждения, когда трудно получить образцы.
9.B.ii Популяция исследования
Мы рекомендуем вам проводить исследования с образцами, взятыми у людей с гриппоподобным заболеванием (например, кашель, заложенность носа, ринорея, боль в горле, лихорадка, головная боль и миалгия). Концентрация вируса гриппа в выделениях из носа и трахеи остается высокой в течение 24-48 часов после появления симптомов и может сохраняться дольше у детей.Мы рекомендуем собирать образец в течение трех дней с момента появления гриппоподобных симптомов, чтобы получить оптимальные результаты анализа. Если ваше устройство предназначено для скрининга людей на инфекцию гриппа, вам следует включить в исследуемую популяцию значительное количество лиц с симптомами и бессимптомно, а также провести исследование в период времени, когда грипп не является распространенным.
Мы рекомендуем вам включить репрезентативное количество положительных образцов (определенное эталонным методом) из каждой возрастной группы и представить данные, стратифицированные по возрасту (например,g., педиатрическое население в возрасте от рождения до 5 лет, от 6 до 21 года, [14] взрослых в возрасте от 22 до 59 лет и старше 60 лет) в дополнение к общей сводной таблице данных.
9.B.iii Образцы
Вы должны включить в клинические исследования образцы, состоящие из всех типов образцов и матриц, заявленных для предполагаемого использования (например, мазки из носа, мазки из носоглотки, носовые аспираты), чтобы продемонстрировать, что правильные результаты могут быть получены на каждом типе клинического материала. Вы должны указать типы устройств для сбора (тампоны, среда — VTM), используемые для сбора клинических образцов и для подтверждения заявленных характеристик, указанных во вкладыше к упаковке.Если тампоны не входят в комплект поставки устройства, вкладыш в упаковку должен содержать информацию о коммерческом источнике и технических характеристиках тампона (например, размер, форма, волокно и тип стержня). Не следует использовать тампоны с деревянными стержнями или другими материалами, которые, как известно, подавляют рост вирусов гриппа. Аналитические исследования, демонстрирующие эквивалентность VTM (например, LoD), должны быть включены в заявку, если рекомендованная VTM отличается от той, которая использовалась для образцов в клинических исследованиях, или если в маркировке рекомендуется более одной VTM.
Общее количество образцов, необходимых для подтверждения заявления об обнаружении гриппа A, гриппа B или подтипов H / N гриппа A, будет зависеть от распространенности вируса и эффективности анализа. Мы рекомендуем, чтобы все устройства для выявления гриппа демонстрировали специфичность с нижней границей 95% (двустороннего) доверительного интервала (ДИ), превышающей 90%.
- Для устройств быстрого определения антигена вируса гриппа A мы рекомендуем вам включить достаточное количество проспективно собранных образцов для каждого заявленного типа образцов, чтобы получить результат чувствительности с нижней границей двустороннего 95% доверительного интервала более 60%.Как правило, мы рекомендуем тестировать не менее 50 образцов, положительных с использованием эталонного метода, для каждого типа образцов.
- Для устройств быстрого определения антигена вируса гриппа B мы рекомендуем вам включить достаточное количество образцов для каждого заявленного типа образца, чтобы получить результат по чувствительности с нижней границей двустороннего 95% доверительного интервала более 55%. Обычно мы рекомендуем минимум 30 положительных образцов для каждого типа образцов.
- Тесты на основе нуклеиновых кислот должны демонстрировать не менее 90% чувствительности для каждого аналита и каждого типа образца с нижней границей двустороннего 95% доверительного интервала более 80%.
Мы рекомендуем вам оценить способность вашего устройства обнаруживать вирусы гриппа в свежих образцах, взятых у пациентов с подозрением на гриппозную инфекцию, которые были последовательно включены в исследование (всестороннее исследование).
Замороженные заархивированные образцы могут быть полезны для оценки аналитических характеристик, но не рекомендуются для исследований по расчету клинической чувствительности или специфичности. Замораживание-размораживание может изменить характеристики образца по сравнению с характеристиками свежих образцов, с которыми предполагается использовать тест, что может повлиять на эффективность анализа.Однако для устройств, предназначенных для обнаружения и / или дифференциации вирусов гриппа, свежие образцы которых трудно получить, может потребоваться, например, замороженные архивные клинические образцы:
- Для новых вирусов гриппа вам может потребоваться использовать замороженные архивные клинические образцы от пациентов с подтвержденным случаем в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) для лабораторно подтвержденных случаев, чтобы продемонстрировать работоспособность вашего устройства [6].
- Во время сезона гриппа, когда распространенность гриппа определенного типа или подтипа необычно низка, проспективно собранные архивные образцы 8 известного типа могут быть использованы для дополнения свежих проспективно собранных образцов.Мы также рекомендуем следующее:
- Если заархивированные образцы были культивированы перед замораживанием и результаты культивирования доступны, образцы следует тестировать только с помощью исследуемого устройства, а результаты следует сравнивать с исходными результатами культивирования вирусов.
- Если результаты посева недоступны, заархивированные образцы следует разморозить и протестировать с помощью приемлемого компаратора на основе NAAT (например, панели CDC rRT-PCR flu) и исследуемого устройства.Для получения подробной информации и обновлений о приемлемых устройствах сравнения на основе NAAT, пожалуйста, свяжитесь с Отделом микробиологических устройств (DMD).
- Необходимо провести исследование эквивалентности свежезамороженных образцов, чтобы продемонстрировать эквивалентность характеристик исследуемого устройства с использованием свежих и замороженных образцов.
В целом, когда количество образцов, доступных для клинических испытаний, очень невелико (например, новые штаммы), имеющиеся доказательства для предпродажного обзора FDA могут, при необходимости, быть получены в результате аналитических, а не клинических исследований.В этих обстоятельствах особенно важно иметь хорошо спланированные аналитические исследования. Исследования на животных могут использоваться в качестве дополнения к аналитическим исследованиям.
Если доступно ограниченное количество свежих образцов гриппа, мы рекомендуем вам связаться с DMD для обсуждения альтернативных предложений.
9.B.iv Оценка свежих и замороженных образцов
Производительность вашего устройства для обнаружения вирусов гриппа может измениться при тестировании замороженных образцов по сравнению со свежими.Если в клиническое исследование были включены как свежие, так и замороженные образцы, вы должны оценить влияние повторных циклов замораживания / оттаивания на эффективность анализа и должны продемонстрировать положительное согласие не менее 95% с нижней границей 95% (двустороннее). доверительный интервал более 90%. Для этого исследования могут использоваться как клинические, так и искусственные образцы. Искусственные образцы могут быть приготовлены путем добавления культивированных вирусов в соответствующую отрицательную клиническую матрицу при различных уровнях вирусной нагрузки, включая титры, близкие к пороговому значению анализа.Необходимо проверить как минимум 60 образцов, представляющих типы образцов тампонов, и 60 образцов, представляющих смывы и аспираты.
Размножение вируса гриппа в культуре наиболее надежно при использовании свежих образцов. Замораживание и размораживание вируса гриппа может снизить его жизнеспособность и дать ложноотрицательный результат, особенно в образцах с низкой вирусной нагрузкой. Если эти результаты посева используются в качестве эталонного метода, то результат исследуемого устройства может быть положительно смещен.Если размножаются замороженные образцы, вы должны продемонстрировать отсутствие существенной потери титра вируса или изменения характеристик исследуемого устройства по сравнению с размножением свежих образцов. Исследование, сравнивающее титры вирусов после размножения свежих и замороженных образцов, должно включать образцы с диапазоном вирусной нагрузки, включая титры вокруг LoD. Результаты должны продемонстрировать положительное согласие не менее 95% с нижней границей 95% (двустороннего) доверительного интервала, превышающей 90%.
9.B.v Учебные площадки
Мы рекомендуем вам собирать образцы и проводить исследования как минимум в трех географически разнесенных учреждениях, одно из которых может быть внутренним.
Мы рекомендуем, чтобы оценка производительности устройств, предназначенных для использования в POC) или экспресс-тестирования, включала, как минимум, одно место в клинической лаборатории, а также места, репрезентативные для внелабораторных условий, где устройство предназначено для использования (например, пациента прикроватная, отделение неотложной помощи).Проведение испытаний устройства в клинической лаборатории с более опытным и обученным персоналом, в дополнение к испытаниям вне лабораторий, где устройство предназначено для использования, но операторы, вероятно, будут иметь меньшую лабораторную подготовку, поможет определить, насколько обучение лицо, проводящее тест, может повлиять на работу устройства.
9.B.vi Справочные методы
Мы рекомендуем вам сравнить результаты, полученные на вашем устройстве, с результатами, полученными с помощью одного или нескольких из следующих стандартных эталонных методов или компараторов:
- Культура вируса с последующим введением прямых флуоресцентных антител (DFA) или другой тип-специфической системы обнаружения антигена (например,g., ELISA).
- Прямой анализ флуоресценции образца (DSFA), одобренный FDA. Прямое тестирование образцов с использованием иммунофлуоресцентных методов (DSFA) дает конкретный результат, который доступен быстрее, чем посев. Однако для обеспечения оптимальной точности важно, чтобы оператор следовал инструкциям и рекомендациям, содержащимся в листке-вкладыше, и проследил за всеми DSFA-отрицательными образцами путем культивирования вирусов.
Мы рекомендуем вам убедиться, что методы культивирования вирусов, используемые в вашем исследовании, соответствуют документу CLSI M41-A и Руководству ВОЗ по диагностике и эпиднадзору за гриппом животных [5,6].Очень важно, чтобы образцы были быстро доставлены в лабораторию для оптимального восстановления или обнаружения вирусов. Не следует проводить культивирование замороженных образцов, если доступны другие варианты, поскольку замораживание-оттаивание может привести к потере инфекционности вируса. Если флуоресцентное антитело, используемое для обнаружения вируса в культивируемых клетках, одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), информация о валидации не требуется, если лаборатория, выполняющая тест, следует инструкциям на вкладыше к упаковке. Если антитело, используемое в DFA, является устройством до внесения поправок, 9 , вам следует предоставить опубликованные литературные или лабораторные данные (например,грамм. LoD и аналитическая реактивность) в вашей предмаркетной заявке в поддержку валидации антител, используемых для типирования вируса гриппа, выделенного из культуры.
Если ваш клинический протокол включает использование замороженных образцов, мы рекомендуем вам связаться с отделом микробиологических устройств FDA для обсуждения альтернативных предложений.
- Для устройств, основанных на технологиях амплификации нуклеиновых кислот (NAAT), могут использоваться альтернативные методы сравнения, включая одобренные FDA анализы на основе NAAT, тестирование непосредственно на клинических образцах.Приемлемым компаратором является анализ, который (i) демонстрирует для каждого аналита (например, типа A, B или подтипа h2N1, h4N2) чувствительность (по сравнению с вирусной культурой) не менее 95% и специфичность не менее 92% с нижняя граница 95% (двустороннего) доверительного интервала, превышающего 90%, и (ii) который не рекомендует или не требует подтверждения культуры для отрицательных результатов. Если производительность вашего устройства установлена по сравнению с приемлемым анализом компаратора, вам следует рассчитать результаты как положительное процентное совпадение и отрицательное процентное совпадение (а не чувствительность и специфичность).Производительность должна соответствовать следующим критериям: положительное и отрицательное процентное соответствие не менее 95% с нижней границей 95% (двустороннего) доверительного интервала, превышающей 90%. Поскольку вирус гриппа продолжает мутировать и подвергаться антигенному дрейфу, характеристики устройств сравнения также могут изменяться со временем. Мы рекомендуем вам связаться с DMD для получения списка приемлемых в настоящее время тестов для сравнения.
- Если тесты FDA или хорошо охарактеризованные антитела недоступны, мы рекомендуем использовать подтвержденную полимеразную цепную реакцию (ПЦР) с последующим двунаправленным секвенированием гемагглютинина (HA) или других специфичных для подтипа целевых ампликонов для идентификации подтипа гриппа А.Этот альтернативный метод приемлем для определения подтипов вирусов в культивируемых клетках или в образцах, которые определены как положительные на грипп A либо культурой, либо приемлемым компаратором NAAT. Если ваш тест основан на технологиях амплификации нуклеиновых кислот, последовательности праймеров для ПЦР-компаратора, не одобренного FDA, должны отличаться от последовательностей праймеров, включенных в ваше устройство, и анализ компаратора должен быть валидирован.
Вы должны предоставить опубликованную литературу или лабораторные данные в поддержку валидации ПЦР для дифференциации подтипа гриппа А.Валидация должна включать данные по LoD и аналитической реактивности. LoD этой ПЦР должен быть аналогичен аналитической чувствительности представленного устройства. Если секвенирование используется в качестве компонента сравнительного метода дифференциации вирусов гриппа A, мы рекомендуем вам выполнить реакцию секвенирования на обеих цепях ампликона (двунаправленное секвенирование) и чтобы созданная последовательность соответствовала всем следующим критериям приемлемости:- Последовательность должна содержать не менее 100 непрерывных оснований.
- Базы должны иметь значение качества 20 или выше, измеренное PHRED, Applied Biosystems KB Basecaller или аналогичными программными пакетами (это представляет вероятность ошибки 1% или ниже) [15].
- Последовательность должна соответствовать эталонной или согласованной последовательности с ожидаемым значением (E-Value) <> -30 для конкретной цели (для поиска BLAST в GenBank http://www.ncbi.nlm.nih.gov / Генбанк /).
Кроме того, если органы общественного здравоохранения рекомендуют не культивировать образец от пациента, подозреваемого на заражение новым вирусом гриппа, мы рекомендуем использовать устройство NAAT, одобренное FDA, или подтвержденное тестирование ПЦР с последующим секвенированием ампликонов до подтвердить личность нового вируса.
9.C Проверка эффективности после выхода на рынок
Мы рекомендуем вам получить и проанализировать постпродажные данные, чтобы обеспечить постоянную надежность вашего устройства, особенно с учетом склонности вирусов гриппа к мутации и возможности изменения распространенности вирусных штаммов с течением времени. В соответствии с требованиями 21 CFR 820.100 (a) (1), «Корректирующие и предупреждающие действия», «вы должны анализировать процессы… жалобы, возвращенный продукт и другие источники данных о качестве, чтобы определить существующие и потенциальные причины несоответствующей продукции или других проблем с качеством.«По мере появления обновленных последовательностей вирусов гриппа (от ВОЗ, NIH и других организаций общественного здравоохранения) вам следует продолжать контролировать эффективность вашего анализа. Кроме того, эти анализы следует сравнивать с подтверждением конструкции устройства и анализом рисков, требуемым согласно 21 CFR 820.30 (g), Проверка конструкции, чтобы определить, могут ли потребоваться какие-либо изменения конструкции. Целью вашего послепродажного мониторинга должно быть обеспечение того, чтобы ваше устройство сохраняло заявленный уровень производительности с течением времени, несмотря на дрейф антигенов, характерный для вирусов гриппа.
9.D Отказ от CLIA
Если вам требуется категоризация вашего устройства в соответствии с Поправками по улучшению клинических лабораторий 1988 г. (CLIA), 10 , мы рекомендуем вам проконсультироваться с персоналом отдела микробиологических устройств относительно разработки конкретных исследований для поддержки заявки на отказ от CLIA для вашего устройства. устройство. Также доступно руководство «Рекомендации по улучшению клинических лабораторий с поправками от 1988 г. (CLIA)» [16].
9.Устройства против гриппа на основе нуклеиновых кислот
Информация, описанная здесь, относится к исследованиям, предназначенным для определения эффективности тестов на грипп на основе нуклеиновых кислот [17,18]. Этот раздел дополняет рекомендации по исследованиям производительности, описанные ранее в этом документе. Там, где это возможно, вы должны описать спецификации управления дизайном, которые направлены на устранение или снижение рисков, связанных с праймерами, зондами и контролями, используемыми для обнаружения вирусных сегментов РНК, например следующие примеры:
- Предотвращение перекрестного загрязнения зонда для мультиплексных тестов, в которых многие зонды обрабатываются в процессе производства.
- Сведение к минимуму ложных срабатываний из-за загрязнения или уноса образца.
- Использование нескольких зондов для одного аналита для обнаружения вариантов вируса, возникающих из-за мутаций в целевом сегменте (ах) РНК, или вариантов в пределах указанного штамма (или линии) вируса гриппа.
- Разработка или рекомендация проверенных методов экстракции и очистки нуклеиновых кислот, которые позволяют получить подходящее количество и качество вирусной нуклеиновой кислоты для использования в тест-системе с вашими реагентами.
Экстракция нуклеиновой кислоты 9.E.i
Различные методы экстракции могут давать нуклеиновые кислоты различного количества и качества, поэтому метод экстракции может иметь решающее значение для успешного результата. Очистка вирусных нуклеиновых кислот может быть сложной задачей, поскольку биологические образцы могут содержать низкие вирусные титры, замаскированные фоном геномной ДНК человека, а также высокие уровни белков и других загрязнителей.
По этим причинам вам следует оценить влияние выбранного вами метода экстракции на эффективность анализа.Если вы включаете или рекомендуете несколько методов экстракции для использования с вашим анализом, вы должны продемонстрировать аналитические и клинические характеристики вашего анализа с каждым методом экстракции и каждым заявленным типом и подтипом вируса гриппа. В частности, вы должны продемонстрировать LoD и воспроизводимость для каждой рекомендованной процедуры экстракции. Вы можете комбинировать переменную метода извлечения с каждой переменной производительности сайта в исследовании воспроизводимости. Например, если вы рекомендуете три различных метода экстракции, вы можете разработать исследование воспроизводимости для оценки одного из трех методов экстракции на каждом из трех участков тестирования: тестовый метод экстракции A на участке 1, метод B на участке 2 и метод C на участке сайт 3.Однако, если исследования в трех центрах указывают на статистически значимые различия в характеристиках анализа, исследование воспроизводимости следует расширить, включив в него тестирование каждого метода экстракции в трех исследовательских центрах (например, методы экстракции для участка 1 A, B и C, методы экстракции для участка 2 A , B и C, и методы экстракции сайта 3 A, B и C).
В дополнение к аналитическим исследованиям (LoD и воспроизводимость на внешних участках) каждый метод экстракции должен использоваться по крайней мере в одном клиническом центре во время клинических исследований для получения данных о клинических характеристиках.Если результаты расширенного тестирования воспроизводимости указывают на значительную разницу в эффективности между методами экстракции, данные из отдельных центров клинических испытаний (с использованием различных методов экстракции нуклеиновых кислот) не считаются эквивалентными и не должны объединяться, а должны анализироваться отдельно. . Как следствие, может потребоваться дальнейшее тестирование предполагаемых клинических образцов для подтверждения заявленного метода экстракции.
9.E.ii Контроли для анализов гриппа на основе нуклеиновых кислот
Мы рекомендуем использовать материалы для контроля качества для проверки эффективности анализа в аналитических и клинических исследованиях.Если ваше устройство основано на технологии нуклеиновых кислот, мы обычно рекомендуем вам включить следующие типы элементов управления:
Отрицательный контрольЗаготовки или отсутствие контроля шаблона
Бланк или контроль без матрицы содержит буфер или среду для транспортировки образцов и все компоненты анализа, кроме нуклеиновой кислоты. Эти контроли используются для исключения контаминации целевой нуклеиновой кислотой или повышенного фона в реакции амплификации.Он может не понадобиться для анализов, проводимых в одноразовых картриджах или пробирках для одного теста.
Отрицательный контроль образца
Отрицательный контроль образца содержит нецелевую нуклеиновую кислоту или, если используется для оценки процедур экстракции, он содержит весь нецелевой организм. Он выявляет неспецифическое праймирование или обнаружение и указывает, что сигналы не получаются в отсутствие целевых последовательностей. Примеры приемлемых отрицательных контрольных материалов включают:
- Образец от человека, не инфицированного гриппом.
- Образцы, содержащие нецелевой организм (например, линия клеток, инфицированная вирусом, не являющимся вирусом гриппа).
- Суррогатный отрицательный контроль, например, инкапсидированная чужеродная РНК [19].
Положительный контроль для полного анализа
Положительный контроль содержит нуклеиновые кислоты-мишени и используется для контроля всего процесса анализа, включая выделение РНК, амплификацию и детекцию. Он разработан для имитации образца пациента и проводится как отдельный анализ одновременно с образцами пациентов с частотой, определяемой Системой качества (QS) лаборатории.Примеры приемлемых положительных контрольных материалов включают:
- Клеточные линии, инфицированные инактивированным или невирулентным штаммом вируса гриппа.
- Упакованная РНК гриппа.
Положительный контроль для амплификации / детекции
Положительный контроль для амплификации / детекции содержит очищенную нуклеиновую кислоту-мишень на пределе или близком к пределу обнаружения для качественного анализа. Он контролирует целостность образца пациента и компонентов реакции при получении отрицательных результатов.Это указывает на то, что цель обнаружена, если она присутствует в образце.
Внутренний контрольВнутренний контроль представляет собой последовательность нуклеиновой кислоты, не являющуюся мишенью, которая экстрагируется и коамплифицируется совместно с нуклеиновой кислотой-мишенью. Он контролирует целостность реагентов (полимеразы, праймеры и т. Д.), Работу оборудования (термоциклер) и наличие ингибиторов в образцах. Этот тип контроля также может гарантировать адекватность образца или то, что был взят образец клеточного материала человека (мишень-хозяин).Примеры приемлемых материалов для внутреннего контроля включают бактериофаг MS2 или нуклеиновую кислоту человека, совместно экстрагированную с вирусом гриппа, и праймеры, амплифицирующие гены домашнего хозяйства человека (например, RNaseP, β-актин).
10. Список литературы
- Руководящий документ по специальным средствам контроля класса II: Приборы для клинических мультиплексных тестовых систем.
- Руководство по содержанию предпродажных заявок на программное обеспечение, содержащееся в медицинских устройствах.
- Институт клинических и лабораторных стандартов.2001. Спецификации иммунологического тестирования на инфекционные заболевания; Утвержденное руководство, второе издание. ILA18-A2.
- Институт клинических и лабораторных стандартов. 2004 г. Протокол определения пределов обнаружения и количественного определения; Утвержденное руководство. ЭП17-А.
- Институт клинических и лабораторных стандартов. 2006. Вирусная культура; Утвержденное руководство. М41-А. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Руководство ВОЗ по диагностике и эпиднадзору за гриппом животных.2002 г., Женева (Всемирная организация здравоохранения). (Полный документ WHO / CDS / CSR / NCS / 2002.5)
- Центры по контролю и профилактике заболеваний. 2006-07 Состав вакцины против гриппа в «Рекомендациях и отчетах MMWR: Профилактика и борьба с гриппом: Рекомендации Консультативного комитета по практике иммунизации (ACIP)». 2006; 28 июля; 55 (RR10): 1-42.
- Институт клинических и лабораторных стандартов. 2005. Тестирование помех в клинической химии; Утвержденное руководство. EP7-A2.Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Институт клинических и лабораторных стандартов. 1995. Оценка клинической точности лабораторных испытаний с использованием графиков рабочих характеристик приемника (ROC); Утвержденное руководство. GP10-A. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Институт клинических и лабораторных стандартов. 2004. Оценка точности количественных методов измерения; Утвержденное руководство. EP5-A2. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Институт клинических и лабораторных стандартов. 2002. Пользовательский протокол для оценки выполнения качественных тестов; Утвержденное руководство. EP12-A2. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Институт клинических и лабораторных стандартов. 2006. Пользовательская проверка работоспособности на точность и правильность; Утвержденное руководство. EP15-A2. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Haeckel R. (1991) Предложения по описанию и измерению эффектов переноса в клинической химии. Pure Appl. Chem . 63: 302-306.
- Руководство для промышленных предприятий и персонала FDA по предпродажной оценке педиатрических медицинских устройств. 2004 г.
- Паттон, С.Дж., Уоллес, А.Дж., Эллес, Р. (2006) Контрольный показатель для оценки качества секвенирования ДНК: предложение международной схемы внешней оценки качества. Клиническая химия, 52: 728-736.
- Руководство для промышленности и персонала FDA: Рекомендации по улучшению клинических лабораторий Поправки 1988 г. (CLIA) Заявления об отказе от требований для производителей In Vitro диагностических устройств.2008.
- Институт клинических и лабораторных стандартов. 2004. Методы секвенирования нуклеиновых кислот в диагностической лабораторной медицине; Утвержденное руководство. ММ9-А. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Институт клинических и лабораторных стандартов. 2006 Молекулярные методы диагностики инфекционных заболеваний; Предлагаемое руководство. ММ3-А2. Институт клинических и лабораторных стандартов, Уэйн, штат Пенсильвания.
- Pasloske BL, Walkerpeach CR, Obermoeller RD, Winkler M и DuBois DB.(1998) Технология бронированных РНК для производства устойчивых к рибонуклеазам вирусных РНК-контролей и стандартов. J. Clin. Microbiol, 36: 3590-3594.
1 Существует три типа вирусов гриппа: A, B и C. Вирусы гриппа A далее классифицируются по подтипам на основе двух основных поверхностных гликопротеинов, гемагглютинина (HA) и нейраминидазы (NA). Подтипы гриппа A и вирусы гриппа B дополнительно классифицируются по штаммам (http://www.cdc.gov/flu/avian/gen-info/flu-viruses.htm).
2 Тесты, предназначенные для использования на территории или рядом с местом, где находится пациент, не требуют постоянного выделенного пространства и выполняются за пределами физических помещений клинических лабораторий http://www.cap.org/ apps / cap.portal
3 Образец с типичной концентрацией вируса, обнаруженный у инфицированных субъектов в целевой популяции.
4 Предел холостого опыта определяется как наивысшее ожидаемое значение в серии результатов для образца, не содержащего аналита, или как самый низкий наблюдаемый результат теста, который можно достоверно объявить больше нуля.
5 Ошибка типа I — это вероятность того, что действительно отрицательные образцы (с нулевой концентрацией аналита) генерируют значения, указывающие на присутствие аналита. Обычно ошибка типа I составляет 5% или меньше.
6 Сравнение производительности нового анализа с установленным эталонным методом создает систему отсчета для оценки устройства, которая полезна независимо от того, должны ли данные учитываться при первоначальном действии классификации или для облегчения сравнения с производительностью устройства предиката в случае предварительного уведомления и оценки существенной эквивалентности.
7 Вы также можете обратиться к «Руководству по информационному листу для ЭСО, клинических исследователей и спонсоров» и «Руководству по информированному согласию на исследования диагностических устройств in vitro с использованием оставшихся образцов человека, которые не поддаются индивидуальной идентификации».
8 Для целей настоящего руководства проспективно собранные архивные образцы — это образцы, собранные последовательно у всех пациентов, соответствующих критериям включения в исследование и представляющие целевую популяцию использования анализа (т.е., не предварительно отобранные образцы с известными результатами), поступающие в центр клинических испытаний между двумя заранее определенными датами (например, от начала до конца одного сезона гриппа), поэтому нет предвзятости и сохраняется распространенность . Эти образцы следует хранить надлежащим образом (например, заморозить при -70 ° C).
9 Устройства до внесения поправок — это устройства, которые были введены или поставлены для коммерческого распространения между штатами до 28 мая 1976 г. (дата вступления в силу поправок к медицинским устройствам 1976 г.).
10 См. 42 U.S.C. § 263a (d) (3).
Добавить комментарии
Вы можете отправить онлайн или письменные комментарии к любому руководству в любое время (см. 21 CFR 10.115 (g) (5))
Если вы не можете отправить комментарии в режиме онлайн, отправьте письменные комментарии по адресу:
Управление картотеки
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
5630 Fishers Lane, Rm 1061
Rockville, MD 20852
Все письменные комментарии должны быть обозначены номером в реестре этого документа: FDA-2008-D-0095.
Определите характеристики эффективного показателя результативности — Принципы бухгалтерского учета, Том 2: Управленческий учет
Важно определить характеристики, по которым показатель эффективности является хорошей оценкой согласованности целей. Хорошая система измерения эффективности приведет в соответствие цели менеджмента с целями корпорации, и обе стороны выиграют.Отсутствие согласованности целей в системе измерения эффективности может во многих отношениях пагубно сказаться на бизнесе. Без надлежащих показателей эффективности согласование целей практически невозможно достичь и, скорее всего, приведет к упущенной прибыли и недовольству сотрудников,
Хорошая система измерения эффективности должна иметь следующие характеристики:
- Он должен основываться на деятельности, которую менеджеры контролируют или влияют.
- Это должно быть измеримо.
- Это должно быть своевременно.
- Он должен быть последовательным в своем применении.
- При необходимости фактические результаты следует сравнить с результатами, заложенными в бюджет, стандартами или прошлыми показателями.
- Измерения не должны отдавать предпочтение менеджеру над целями всей организации. Часто менеджеры имеют возможность принимать решения в пользу их отдельных подразделений, но это может нанести ущерб общей производительности организации.
Как вы узнали, важно, чтобы действия, по которым оцениваются менеджеры, находились в пределах его контроля.Кроме того, очень важно, чтобы информация, которая используется в системе измерения производительности, была собрана, оценена и представлена своевременно. Системы измерения эффективности показывают, насколько хорошо оцениваемые менеджеры выполняют свою работу. Помните, что организация хочет, чтобы менеджеры принимали решения, которые отвечают наилучшим интересам организации в целом и, следовательно, потребности в системе управления эффективностью. Если менеджеры не получат своевременную обратную связь, они не будут знать, какие решения им следует продолжать принимать в той же манере, а какие менее эффективны.То же верно и с точки зрения корпорации. Своевременная информация позволяет группе оценки определять влияние отдельных управленческих решений на корпорацию в целом.
Показатели эффективности не только своевременны, но и должны применяться или измеряться последовательно. Учетные переменные или другие показатели, которые используются для оценки менеджера, должны измеряться одинаково от периода к периоду. Например, если показатель эффективности включает некоторую форму дохода, такую как операционный доход, то этот показатель следует использовать каждый раз и не заменять другим показателем дохода для текущего цикла измерения (обычно один год).Если после дальнейшего анализа окажется, что чистая прибыль — лучший показатель для использования при оценке менеджера, то новый показатель может быть применен в течение следующего цикла измерения. При изменении показателей крайне важно, чтобы оцениваемый менеджер знал об изменении показателей, поскольку это может повлиять на его или ее принятие решений. Идея состоит в том, чтобы удерживать цели стабильными в течение определенного периода. В противном случае измерения могут быть несовместимыми и, следовательно, вводить в заблуждение. Хороший план оценки эффективности должен включать вклад менеджера в обсуждение дизайна.Это не только помогает обеспечить ясность плана для всех сторон, участвующих в процессе, но и помогает мотивировать менеджеров. Вместо того, чтобы говорить, какие цели должны быть достигнуты, менеджеры будут более мотивированы для достижения целей, если они внесут свой вклад в процесс, цели, которые должны быть достигнуты, и используемые измерения или метрики.
Показатели эффективности полезны только в том случае, если есть базовый уровень, с которым можно сравнивать измеренные результаты. Например, учащиеся часто оценивают, насколько хорошо они справились с тестом, сравнивая свою оценку со средним значением по тесту.Если учащийся набрал 65 баллов из 100 на тесте, первоначальный ответ может заключаться в том, что это менее чем звездная оценка, если только этот балл не сравнивается со средним. Предположим, что средний балл по этому конкретному тесту был равен 50. Очевидно, что в этом примере ученик показал результат выше среднего по этому тесту, но это нельзя было интерпретировать правильно, пока результат не сравнивался с базовым уровнем. При оценке показателей эффективности обычно используются стандартные, базовые или пороговые значения для сравнения фактических результатов менеджера.
У компании есть как краткосрочные, так и долгосрочные цели. Краткосрочные цели включают снижение затрат на производство на определенный процент в текущем году или увеличение продаж в годовом исчислении на определенный процент. Долгосрочные цели могут включать выход на новые территории или добавление новых продуктов. У сотрудников также есть краткосрочные и долгосрочные цели. Краткосрочные цели могут включать пляжный отдых, а долгосрочные — сбережения на пенсию или учебу в колледже. Хорошая система измерения эффективности будет включать как краткосрочные, так и долгосрочные меры, чтобы мотивировать менеджеров принимать решения, которые будут соответствовать как корпорациям, так и их собственным краткосрочным и долгосрочным целям.
Вы узнали о человеческом факторе, который заставляет менеджеров принимать то, что обычно является лучшим решением для них самих, а не лучшим решением для общего блага корпорации, особенно если решение, которое приносит пользу корпорации, не выгодно для менеджера. Опять же, это означает, что система измерения эффективности должна пытаться предотвратить выгоду менеджера без выгоды для корпорации. Это одна из самых сложных частей проектирования системы измерения производительности.
Например, предположим, что менеджер отдела подержанных автомобилей в автомобильном представительстве несет ответственность за прибыль, которую он получает от продажи подержанных автомобилей, которые были приняты в обмен на продажи новых автомобилей. Некоторые из этих подержанных автомобилей нуждаются в небольшом ремонте, чтобы подготовить их к продаже. У менеджера есть выбор: отремонтировать автомобили через сервисный отдел автосалона или передать ремонт на аутсорсинг другой компании. Если менеджер может выполнить ремонт с меньшими затратами в другой ремонтной мастерской, и если он будет оценен и получит премию, основанную на его прибыли, то он, вероятно, воспользуется услугами сторонней ремонтной мастерской.Это хорошо? Очевидно, это хорошо для менеджера отдела подержанных автомобилей, который будет иметь меньше затрат на подготовку подержанного автомобиля к продаже и, следовательно, получит больше прибыли от продажи этого автомобиля. Более высокая прибыль отдела подержанных автомобилей означает более высокий бонус для менеджера. Но как насчет автосалона? Было ли решение отдать ремонт на аутсорсинг правильным решением?
Это зависит от нескольких факторов, но здесь есть над чем подумать. Что, если сервисный отдел дилерского центра стоит дороже, потому что он поставляет детали более высокого качества, а механики сертифицированы? Влияет ли репутация качества подержанных автомобилей, продаваемых дилерским центром, не только на отдел подержанных автомобилей? Что, если бы сервисная служба могла выполнить работу по себестоимости? Как вы можете понять по этим вопросам, без дополнительной информации мы не знаем, должен ли менеджер по подержанным автомобилям отдать ремонт на аутсорсинг.Но мы знаем, что его решение было основано на том, что его бонус был привязан к его прибыльности, а не на других факторах, таких как прибыльность дилерского центра или репутация дилерского центра (удовлетворенность клиентов). Поэтому важно, чтобы система управления эффективностью не способствовала принятию решений, которые приносят пользу менеджеру в ущерб корпорации.
Показатели эффективности в НАСА 1Почти двадцать лет назад Национальное управление по аэронавтике и исследованию космического пространства (НАСА) вместе с пятью подрядчиками НАСА реализовало проект по определению показателей эффективности.В результате они разработали серию из пяти моделей мер. Эти меры включали эффективность, количество, качество, ценность и изменение и заключаются в следующем:
- Эффективность оценивалась как прогнозируемая / фактическая. Примером было количество завершенных тестов / количество запланированных тестов.
- Количество измерялось как единица / источники затрат процесса или продукта. Примером было общее количество запусков испытаний в аэродинамической трубе / стоимость управления оборудованием.
- Качество измерялось как индикаторы ошибки или потери / процесса или единицы продукта.Примером мер качества являются ошибки в выпущенных рабочих пакетах / выпущенных рабочих пакетах в целом.
- Стоимость оценивалась как желательность / источник затрат. Примером меры стоимости является экономия от программы предложений / человеко-часов на рассмотрение предложений.
- Изменение было измерено как информация, предоставленная индексами, разработанными путем отслеживания одних и тех же показателей эффективности с течением времени. Примером могут служить меры по улучшению, такие как
- Сокращение на X процентов времени простоя оборудования / выполненных или предпринятых тестов или
- Увеличение на X процентов подготовленных документов / делопроизводителя
Эти меры имеют ряд явных преимуществ, но могут встретить некоторое сопротивление со стороны сотрудников и подрядчиков.Скорее всего, преимущества заключались в лучшем понимании своих процессов, а также в понимании количества потраченного впустую времени и ценности эмуляции этих процессов. Разработка и внедрение дают возможность обнаружить, что может быть не так в процессах, начать диалог о текущих изменениях и улучшениях, а также пообщаться и провести мозговой штурм по поводу организационной неэффективности. Сетевое взаимодействие, участвующее в разработке показателей эффективности, может стать уравнителем между процессами, разрушающими разрозненность и сложность.
Сопротивление, вероятно, возникнет из-за того, что измерения отнимают слишком много времени, а процессы слишком сложны, чтобы их можно было нанести на карту для этих целей измерения. Как высшее руководство может судить о сложном прогрессе в проектах, если оно практически не участвует? Если бы эти меры были настолько важны, то НАСА уже разработало бы их в организации, которая была основана примерно в 1960 году. Подобное сопротивление развивается как такое сопротивление, при котором предшествующее отсутствие этих мер становится основным сопротивлением их разработке.
Ключевые концепции и резюме
- Хорошая система измерения эффективности использует меры, которые контролирует менеджер, обеспечивает своевременную и последовательную обратную связь, сравнивает меры со стандартами в той или иной форме, имеет как краткосрочные, так и долгосрочные меры и ставит цели бизнеса и человек на равном уровне.
(рисунок) Что из следующего является , а не характеристикой хорошей системы измерения производительности?
- своевременно
- последовательный
- на основе видов деятельности, над которыми менеджеры не могут повлиять или не повлиять
- использует как долгосрочные, так и краткосрочные характеристики и стандарты
(Рисунок) Хорошая система измерения эффективности согласовывает цели управления с ________.
- цели сити-менеджера и аппарата мэрии
- целей корпорации, и обе стороны принесут пользу
- приоритеты акционеров, указанные на годовом собрании
- Ответ инвестиционного отдела на годовой аудит
(рисунок) Что должна делать организация, если показатели эффективности изменились?
- Убедитесь, что оцениваемый менеджер осведомлен об изменении измерения, так как это может повлиять на его или ее принятие решений.
- Убедитесь, что менеджер получает выгоду без выгоды для корпорации.
- Убедитесь, что у каждого менеджера есть существенные преимущественные возможности, если он не знает об изменении.
- Получите опросы клиентов об изменении, прежде чем сообщать об изменении менеджеру.
(Рисунок) Что будет в хорошей системе измерения эффективности?
- краткосрочные цели
- долгосрочные цели
- краткосрочные и долгосрочные цели
- совсем нет голов
(Рисунок) Без надлежащих показателей эффективности согласование целей практически невозможно достичь и, скорее всего, приведет к ________.
- более стабильные цели
- уменьшились дефекты
- упущенная выгода
- сотрудников довольны статус-кво
(рисунок) Что было бы неправильным в использовании двух точек данных в системе измерения эффективности, чтобы сообщить компании, является ли величина отклонения нормальной или ненормальной?
(Рисунок) Сравните и сопоставьте краткосрочные и долгосрочные цели компании. Приведите пример каждого из них и объясните, почему они важны для систем измерения производительности.
Краткосрочные цели включают такие цели, как снижение производственных затрат на определенный процент в текущем году или увеличение продаж в годовом исчислении на определенный процент. Долгосрочные цели могут включать такие цели, как выход на новые территории или добавление новых продуктов в течение следующих пяти лет. Хорошая система измерения эффективности будет включать как краткосрочные, так и долгосрочные меры, чтобы мотивировать менеджеров принимать решения, которые будут соответствовать как корпорациям, так и их собственным краткосрочным и долгосрочным целям.
(Рисунок) Может ли краткосрочная цель быть долгосрочной? Где находится подразделение и почему сотруднику важно понимать, является ли цель краткосрочной или долгосрочной?
(рисунок) Что означает соответствие цели ? Приведите пример с вашим объяснением.
Ответы будут разными, и их следует обсудить. Согласованность целей означает согласование целей бизнеса с личными целями менеджера. Например, если у компании есть цель значительно улучшить продажи определенного продукта, у регионального менеджера по продажам в результате будет повышенная цель продаж.
(рисунок) Каковы шесть характеристик хорошей системы измерения производительности?
(Рисунок) Сара только что устроилась на работу помощником директора средней школы в районном школьном округе. До этого она была учительницей. На своей первой административной работе она получила следующие показатели эффективности. Ее первая задача — определить, являются ли эти измерения производительности краткосрочными или долгосрочными целями в зависимости от ее индивидуальной ситуации.Она получила степень администратора, но еще не работала администратором. Определите каждую из следующих целей как краткосрочные или долгосрочные.
- Проведение обходов / наблюдений / оценок учителей для учителей 6 и 7 классов.
- Содействовать миссии округа в стремлении дать образование всей молодежи школьного округа.
- Тренируйтесь, чтобы стать руководителем строительного обучения. Действовать в качестве администратора здания в отсутствие доверителя.
- Посещайте встречи с руководителями зданий и административной группой, когда их об этом попросят.
- Вовлекайте всех учащихся конструктивным образом и помогайте учителям и сотрудникам обеспечивать их строгость и актуальность. Успех общешкольной политики дисциплины и посещаемости, а также их соблюдения зависит от сочетания творческих способностей и разумной педагогики при соблюдении окружных, государственных и федеральных законов, руководящих принципов и постановлений.
- Содействовать и контролировать все учения, санкционированные федеральным правительством и штатом (пожар, блокировка, торнадо и т. Д.).
- Одевайтесь профессионально.
- Помогать директору здания во всех его должностных обязанностях и ответственности.
(Рисунок) Падма получила докторскую степень и заняла должность доцента в местном университете. Ей были даны следующие критерии оценки ее новой должности. Определите, являются ли эти цели долгосрочными или краткосрочными.
- Честно и беспристрастно взаимодействуйте со студентами.
- Продвигать и получать доступ к академическим достижениям учащихся.
- Консультации студентов в рамках норм общества и правил колледжа.
- Мотивируйте студентов.
- Эффективно планировать и организовывать лекции и лабораторные работы в соответствии с планом курса колледжа.
- Сообщите о посещаемости занятий в соответствии с политикой и процедурами колледжа.
- Работает в академических комитетах по назначению.
- Сделать успехи в обучении, необходимом для обучения в университете.
(рисунок) Джош О’Ши — руководитель лаборатории сердечно-сосудистых и респираторных заболеваний. Этот отдел отвечает за измерение газов крови, выполнение респираторных процедур и распространение автоматизированного оборудования для внутривенных вливаний.В качестве менеджера Джош нанимает и обучает персонал, составляет бюджет своего отдела и поддерживает штатное расписание. Джош рекомендует оборудование, необходимое для отдела, но он может быть отвергнут в процессе приобретения. Джошу и его сотрудникам департамента платят за профессиональные навыки, которые они имеют, зарабатывают и поддерживают, а больница возмещает им все одобренное обучение или профессиональные навыки, которые они приобретают. Джош должен использовать оборудование, реагенты и расходные материалы, предоставленные ему централизованно.Основываясь на этой информации, какие стимулы вы считаете теми, которые будут мотивировать Джоша как члена команды больницы, и почему? Какие стимулы будут демотивировать и почему?
(Рисунок) Канье Ачебе только что стал операционным менеджером Weston Transportation. Weston перевозит большие ящики для онлайн-компаний и перевозит контейнеры за границу.
Канье хотел бы оценить каждого менеджера подразделения на основе, аналогичной сегментной отчетности, требуемой в соответствии с общепринятыми принципами бухгалтерского учета (GAAP). Финансовая отчетность, содержащаяся в годовых отчетах.Эти данные включают представление чистых продаж, операционных прибылей и убытков до и после налогообложения, общей суммы идентифицируемых активов и амортизации по отчетным сегментам. Канье считает, что уместно оценивать руководителей бизнес-подразделений по тем же критериям, что и всю компанию.
- Объясните, почему вы думаете, что главный финансовый директор (CFO) не согласен и говорит Канье, что публичное сообщение информации может демотивировать менеджеров.
- Для лучшей оценки менеджеров, какую информацию Канье должен предложить, чтобы финансовый директор мог принять?
Сноски
- 1 Д.Кинло. «Разработка показателей эффективности с менеджерами аэрокосмической отрасли». Национальный обзор производительности . 1 декабря 1986 г.

 – 2003. – Vol. 62, Issue 1. – P. 134–154. DOI: https://dx.doi.org/10.1016/S0001-8791(02)00046-5
– 2003. – Vol. 62, Issue 1. – P. 134–154. DOI: https://dx.doi.org/10.1016/S0001-8791(02)00046-5 , Mayseless O. Juggling the roles of parents, therapists, friends and teachers – a working model for an integrative conception of mentoring // Mentoring and Tutoring: Partnership in Learning. – 2008. – Vol. 16 (4). – P. 412–428. DOI: https://dx.doi.org/10.1080/13611260802433783
, Mayseless O. Juggling the roles of parents, therapists, friends and teachers – a working model for an integrative conception of mentoring // Mentoring and Tutoring: Partnership in Learning. – 2008. – Vol. 16 (4). – P. 412–428. DOI: https://dx.doi.org/10.1080/13611260802433783 – P. 202–221. DOI: https://dx.doi.org/10.1177/0044118X93025002002
– P. 202–221. DOI: https://dx.doi.org/10.1177/0044118X93025002002 , Pettersson C., Eriksson Ch., Skoog Th. Initial motives and organizational context enabling female mentors’ engagement in formal mentoring – A qualitative study from the mentors’ perspective // Children and Youth Services Review. – 2016. – Vol. 71. – P. 17–26. DOI: https://dx.doi.org/10.1016/j.childyouth.2016.10.026
, Pettersson C., Eriksson Ch., Skoog Th. Initial motives and organizational context enabling female mentors’ engagement in formal mentoring – A qualitative study from the mentors’ perspective // Children and Youth Services Review. – 2016. – Vol. 71. – P. 17–26. DOI: https://dx.doi.org/10.1016/j.childyouth.2016.10.026 , Spencer R. Structuring mentoring relationships for competence, character, and purpose // New Directions for Youth Development. – 2010. – Vol. 2010, Issue 126. – P. 149–152. DOI: http://dx.doi.org/10.1002/yd.356
, Spencer R. Structuring mentoring relationships for competence, character, and purpose // New Directions for Youth Development. – 2010. – Vol. 2010, Issue 126. – P. 149–152. DOI: http://dx.doi.org/10.1002/yd.356 – 2017. – Vol. 110. – P. 116–126. DOI: https://dx.doi.org/10.1016/j.compedu.2017.03.011
– 2017. – Vol. 110. – P. 116–126. DOI: https://dx.doi.org/10.1016/j.compedu.2017.03.011