Роль вегетативной нервной системы в эмоциях. Мозг, разум и поведение
Роль вегетативной нервной системы в эмоциях
Конечно, деятельность мозга включает контроль над системами тела. Возбуждение, которое вы ощущаете, когда испытываете чувство страха или ярости, запускается вашим мозгом, но осуществляется с помощью вегетативной (автономной) нервной системы.
Вегетативная нервная система имеет два анатомически различных отдела (см. гл. 4; рис. 62). Симпатический отдел мобилизует энергию и ресурсы тела (реакция типа «борьбы или бегства»). Деятельность парасимпатического отдела в целом направлена на сбережение энергии и ресурсов тела. Как вы видели, оба отдела действуют согласованно, хотя их функции могут показаться противоположными. Равновесие между их различными эффектами в каждый данный момент зависит от взаимодействия между требованиями внешней ситуации и внутренним состоянием организма.
В эволюционном плане симпатический отдел развивался поздно и весьма постепенно (Pick, 1970).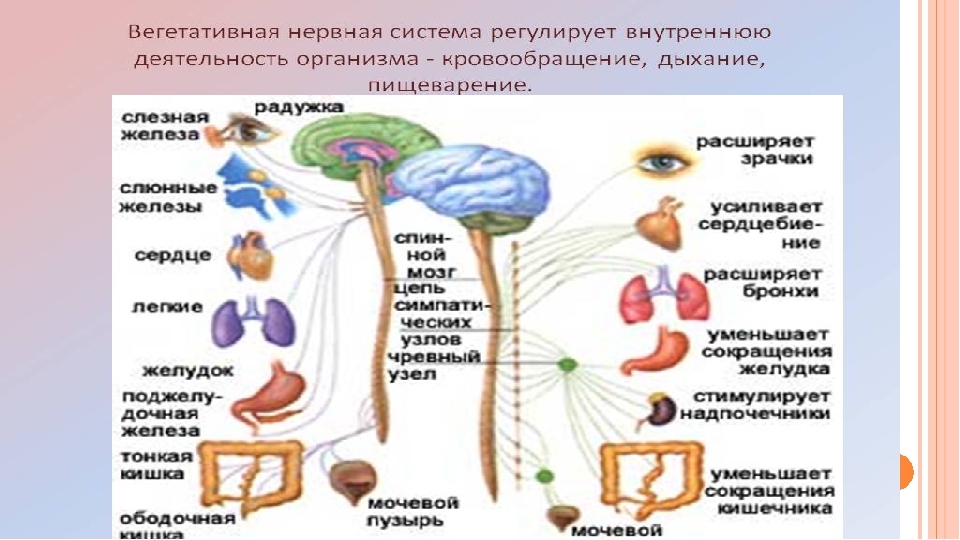
В условиях крайнего стресса эти системы могут оказаться удивительно полезными. У некоторых лабораторных животных, получающих сильные электрические удары, которые они не могут предотвратить (так же как и у некоторых людей на поле битвы), симпатическая система, призванная мобилизовать их силы для борьбы или бегства, вообще не приводится в действие. Напротив, они как бы «застывают», игнорируя сравнительно недавно приобретенные способы реакции и обращаясь к «филогенетически более древним способам, когда раздражитель чрезмерно силен» (Pick, 1970).
На рис. 63 (в гл. 4) схематически показана симпатическая и парасимпатическая иннервация различных органов. Чтобы ярче проиллюстрировать ее действие, предположим, что вы только что основательно пообедали. Парасимпатические нервы замедляют работу вашего сердца и усиливают деятельность пищеварительного тракта. Но если в вашу столовую внезапно ввалится человек с пистолетом или если вы услышите за окном шум, в действие вступит ваша симпатическая система. Процессы пищеварения замедлятся, сердце начнет биться быстрее, и кровь, отхлынув от кожи и органов пищеварения, устремится к мускулам и мозгу; ваши легкие будут сильнее растягиваться и поглощать больше кислорода, зрачки ваших глаз расширятся, чтобы пропускать больше света, потовые железы активизируются, готовые охладить ваше тело во время предстоящего напряжения. Те же симпатические нервы заставят мозговое вещество надпочечников выделять адреналин, а окончания других симпатических нервов будут секретировать медиатор норадреналин, который прямо воздействует на сердце и кровеносные сосуды.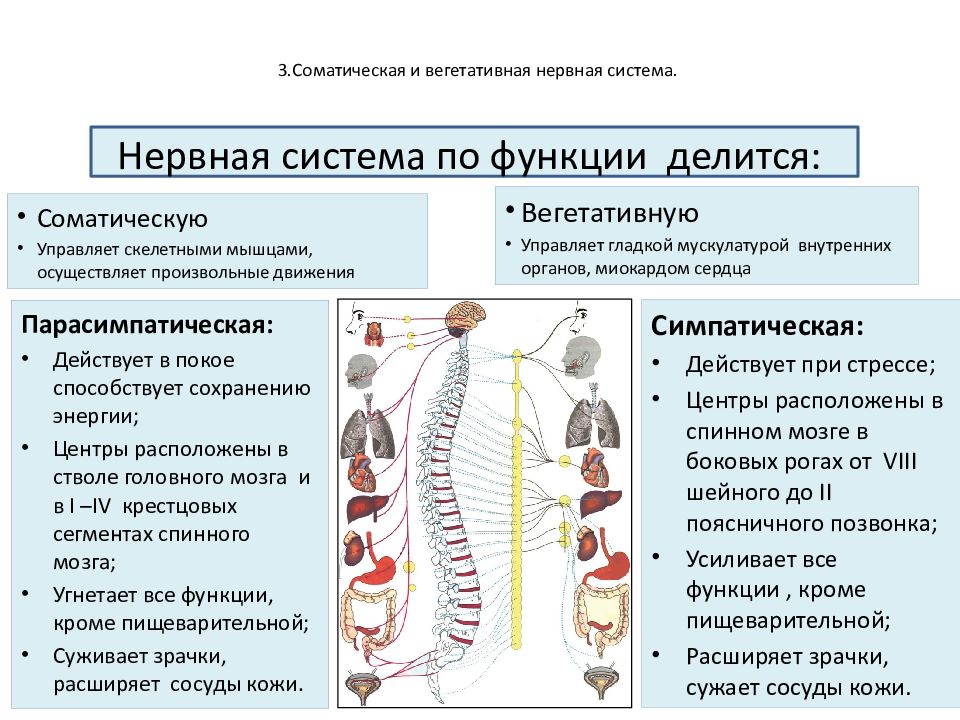
Эндокринная система тоже играет свою роль в общей активации, секретируя гормоны прямо в кровь. В ответ на физический или психологический стимул гипоталамус посылает сигнал гипофизу, побуждая его выделять в кровяное русло большие количества адренокортикотропного гормона (АКТГ). АКТГ попадает с кровью в надпочечники и заставляет их усиленно секретировать гормоны. Эти гормоны в свою очередь поступают в различные органы и подготавливают их к деятельности в экстренной ситуации.
Когда человек сталкивается с событием, требующим мобилизации внутренних ресурсов, вегетативная нервная система реагирует в течение одной-двух секунд. Кажется, что это очень быстро. Но представьте, что происходит, когда вы видите, что едущий впереди вас по магистрали автомобиль внезапно останавливается. Меньше чем за полсекунды вы автоматически нажимаете на тормоза и при этом, возможно, успеваете посмотреть в зеркале заднего вида, как близко находится следующая за вами машина. Признаки возбуждения — колотящееся сердце, дрожащие руки и т.д. — появляются уже после того, как экстренная ситуация миновала. Ваш мозг, очевидно, справился с ситуацией, не прибегая к помощи сложных вспомогательных механизмов.
Это происходит потому, что нервные пути от органов чувств к коре и обратно к мышцам являются по существу прямыми. Сигналы проходят через ретикулярную систему и таламус к коре. За какую-то долю секунды вы совершаете нужное действие. В описанном нами случае вы нажимаете на тормоза. Те же самые сигналы проходят и по нервным путям, соединяющим таламус и гипоталамус, а также по путям, соединяющим гипоталамус с лобными долями коры через миндалины и гиппокамп. Если все системы признают, что поступил сигнал опасности, гипоталамус включает механизм возбуждения вегетативной нервной системы. Это происходит через секунду или около того. Гормональные сигналы от активированного гипофиза передаются, однако, через кровь, и поэтому они движутся медленнее, чем сигналы, идущие по нервным путям. С этим и связана задержка физиологической реакции. Конечно, с точки зрения биологической адаптации важно то, что вы были бы готовы бороться, бежать или предпринимать другие действия, если бы опасность была связана с внезапным нападением. И это позволяет объяснить, почему многие мелкие стычки сопровождаются шумными спорами о том, кто виноват.
Те же самые сигналы проходят и по нервным путям, соединяющим таламус и гипоталамус, а также по путям, соединяющим гипоталамус с лобными долями коры через миндалины и гиппокамп. Если все системы признают, что поступил сигнал опасности, гипоталамус включает механизм возбуждения вегетативной нервной системы. Это происходит через секунду или около того. Гормональные сигналы от активированного гипофиза передаются, однако, через кровь, и поэтому они движутся медленнее, чем сигналы, идущие по нервным путям. С этим и связана задержка физиологической реакции. Конечно, с точки зрения биологической адаптации важно то, что вы были бы готовы бороться, бежать или предпринимать другие действия, если бы опасность была связана с внезапным нападением. И это позволяет объяснить, почему многие мелкие стычки сопровождаются шумными спорами о том, кто виноват.
Рис. 108. Обезьяна демонстрирует «оскал испуга» -знак подчинения. С этой мимикой, возможно, связана по своему происхождению человеческая улыбка, на которую способны даже крошечные младенцы.
Возбуждение симпатической системы имеет очевидный эволюционный смысл, так как подготавливает наш организм к встрече с непредвиденной ситуацией. Ученые установили, что и другие аспекты нашего эмоционального багажа имеют свою эволюционную историю.
ВЛИЯНИЕ ВЕГЕТАТИВНОЙ НЕРВНОЙ РЕГУЛЯЦИИ НА РАЗВИТИЕ СЕРДЕЧНЫХ АРИТМИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | Опубликовать статью ВАК, elibrary (НЭБ)
1Кандидат медицинских наук, ассистент кафедры, 2Кандидат медицинских наук, ассистент кафедры, 3Кандидат медицинских наук, ассистент кафедры, Доктор медицинских наук, Профессор, заведующий кафедрой, Ярославский государственный медицинский университет
ВЛИЯНИЕ ВЕГЕТАТИВНОЙ НЕРВНОЙ РЕГУЛЯЦИИ НА РАЗВИТИЕ СЕРДЕЧНЫХ АРИТМИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Аннотация
У больных сердечно-сосудистыми заболеваниями, особенно ишемической болезнью сердца (ИБС), отмечается выраженное ремоделирование миокарда, происходит перестройка вегетативной нервной системы сердца.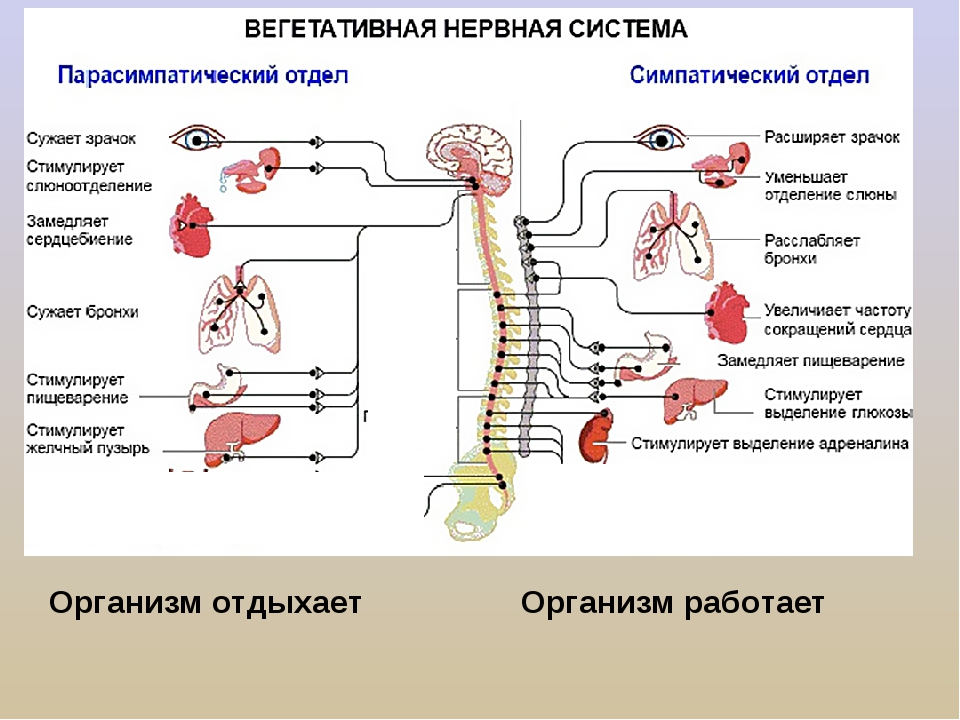
Ключевые слова: вегетативная нервная система, ишемическая болезнь сердца, электрическая нестабильность миокарда, нарушения ритма сердца.
Lysenkova N.O.1, Rumyancev M.I.2, Zhilina A.N.3, Kratnov A.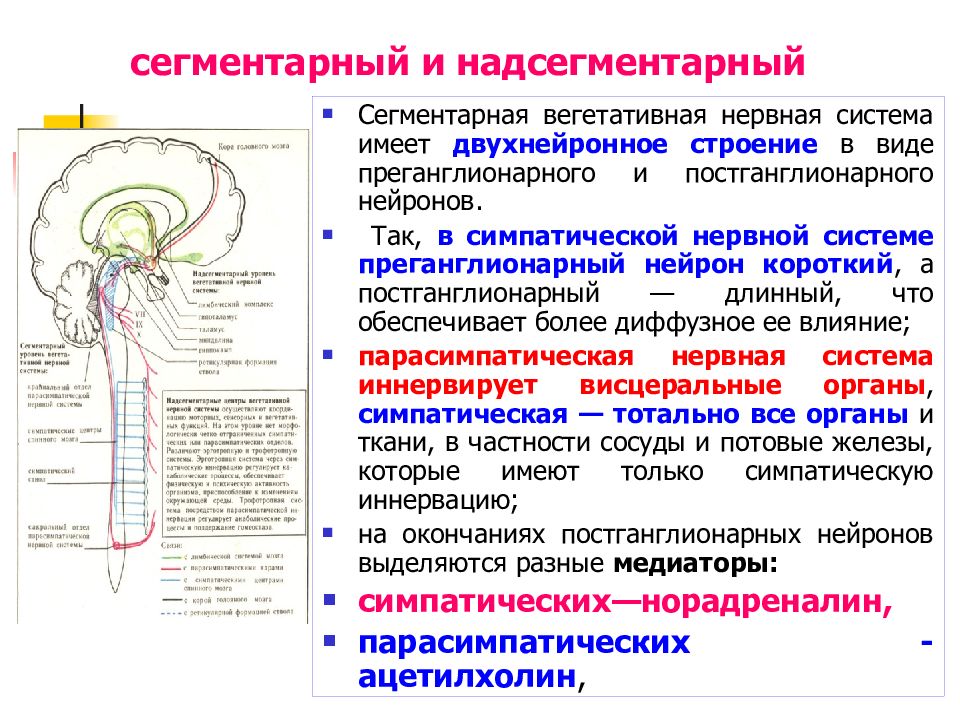 E.4
E.4
THE INFLUENCE OF AUTONOMIC NERVOUS REGULATION ON THE DEVELOPMENT OF CARDIAC ARRHYTHMIAS IN PATIENTS WITH CORONARY HEART DISEASE
Abstract
In patients with cardiovascular diseases, especially coronary heart disease, there is a marked remodeling of the myocardium, there is a rearrangement of the autonomic nervous system of the heart. This leads to disruption of both sympathetic and parasympathetic regulatory influences. The mismatch between electrophysiological processes in the myocardium, with efferent impulses from the central agencies and the state of the afferent connections, and also themselves dysfunction of the central nervous structures can cause electrical instability of the myocardium and lead to fatal cardiac arrhythmias leading to cardiac death occurrence.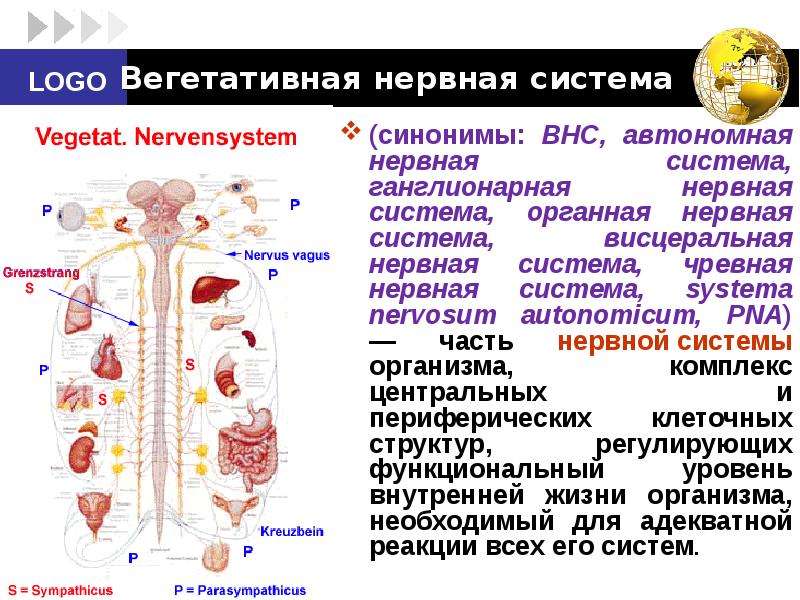
Keywords: autonomic nervous system, coronary heart disease, electrical instability of the myocardium, arrhythmias.
Одной из актуальных проблем современной кардиологии является своевременное определение у больных ИБС риска развития угрожающих жизни аритмий и наступления кардиальной смерти [1]. Данные клинических и морфологических исследований доказывают тесную взаимосвязь развития кардиальной смерти с наличием фатальных нарушений ритма, дисфункцией ВНС, нейрогуморальными механизмами, и сниженной ФВ левого желудочка у больных ИБС [17]. Определяющим условием для возникновения фатальных аритмий признается наличие структурной патологии сердца, которое под действием различных функциональных факторов становится электрически нестабильным [25]. Кроме того, существуют данные, согласно которым нестабильность электрофизиологических процессов в миокарде у пациентов, страдающих ИБС, в первую очередь связана с нарушением регуляции вегетативного и электролитного баланса [7, 19].
Сердце иннервируется вегетативной нервной системой (ВНС), состоящей из симпатических и парасимпатических нервов. Симпатические нервы, стимулируя β-адренорецепторы синусового узла, увеличивают частоту сердечных сокращений (ЧСС). Раздражение блуждающего нерва, в свою очередь, стимулирует М-холинорецепторы синусового узла, вследствие чего развивается брадикардия. Синусовый и атриовентрикулярный узлы находятся в основном под влиянием блуждающего нерва и, в меньшей степени, симпатического, в то время как желудочки контролируются преимущественно симпатическим нервом [28, 37]. Деятельность ВНС контролируется центральной нервной системой и рядом гуморальных влияний. В продолговатом мозге расположен сердечно-сосудистый центр, который объединяет парасимпатический, симпатический и сосудодвигательный центры. Регуляция этих центров осуществляется подкорковыми узлами и корой головного мозга. На ритмическую деятельность сердца влияют импульсы, исходящие из сердечно-аортального, синокаротидного и других сплетений.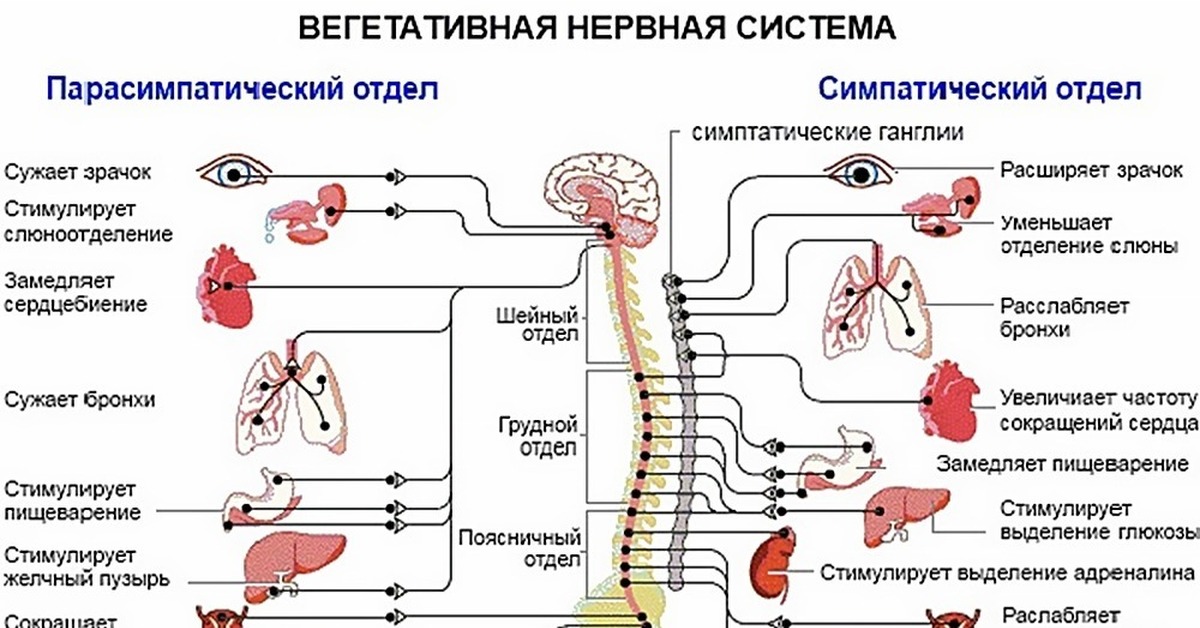 Также на сердечно-сосудистый центр действуют гуморальные нарушения, изменения в крови (парциального давления углекислого газа и кислорода, кислотно-основного состояния), хеморецепторный рефлекс [11]. В состоянии покоя доминирует тонус вагуса и изменчивость сердечной периодики в значительной степени зависит от его влияний. Вагусная и симпатическая активность находятся в постоянном взаимодействии. Поскольку синусовый узел богат холинэстеразой, действие любого вагусного импульса краткосрочно, так как ацетилхолин быстро гидролизируется. Преобладание парасимпатических влияний над симпатическими может быть объяснено двумя независимыми механизмами: холинергически индуцируемым снижением высвобождения норадреналина в ответ на симпатическую стимуляцию и холинергическим подавлением ответа на адренергический стимул. Афферентная вагусная стимуляция приводит к рефлекторному возбуждению эфферентной вагусной активности и ингибированию эфферентной симпатической активности [37]. Эффекты противоположно ориентированного рефлекса опосредуются стимуляцией афферентной симпатической активности [33].
Также на сердечно-сосудистый центр действуют гуморальные нарушения, изменения в крови (парциального давления углекислого газа и кислорода, кислотно-основного состояния), хеморецепторный рефлекс [11]. В состоянии покоя доминирует тонус вагуса и изменчивость сердечной периодики в значительной степени зависит от его влияний. Вагусная и симпатическая активность находятся в постоянном взаимодействии. Поскольку синусовый узел богат холинэстеразой, действие любого вагусного импульса краткосрочно, так как ацетилхолин быстро гидролизируется. Преобладание парасимпатических влияний над симпатическими может быть объяснено двумя независимыми механизмами: холинергически индуцируемым снижением высвобождения норадреналина в ответ на симпатическую стимуляцию и холинергическим подавлением ответа на адренергический стимул. Афферентная вагусная стимуляция приводит к рефлекторному возбуждению эфферентной вагусной активности и ингибированию эфферентной симпатической активности [37]. Эффекты противоположно ориентированного рефлекса опосредуются стимуляцией афферентной симпатической активности [33]. Эфферентная вагусная активность также находится под тоническим сдерживающим влиянием афферентной кардиальной симпатической активности [16]. Эфферентная симпатическая и вагусная импульсации, направленные на синусовый узел, характеризуются разрядом, преимущественно синхронизированным с каждым сердечным циклом.
Эфферентная вагусная активность также находится под тоническим сдерживающим влиянием афферентной кардиальной симпатической активности [16]. Эфферентная симпатическая и вагусная импульсации, направленные на синусовый узел, характеризуются разрядом, преимущественно синхронизированным с каждым сердечным циклом.
Литературные данные о роли вегетативной регуляции в аритмогенезе неоднозначны. В последнее время активно обсуждается положение о том, что повышение активности симпатического звена ВНС при ишемии миокарда приводит к возникновению нарушений ритма, тогда как активация парасимпатического звена обладает протективным эффектом [36]. Однако, при гистологическом исследовании миокарда у пациентов, погибших внезапно, было выявлено нарушение автономной регуляции, обширные очаги истощения катехоламинов в адренергических сплетениях миокарда и изменения вегетативных нервных ганглиев. Показано, что ишемические изменения в области нижней стенки левого желудочка вызывают активацию парасимпатического отдела ВНС, а в передней стенке приводят к повышению тонуса симпатических афферентных нервов [3].
Известно, что у больных ИБС, отмечается выраженное ремоделирование миокарда, происходит перестройка вегетативной нервной системы сердца. Это ведет к нарушению как симпатических, так и парасимпатических регуляторных влияний. Особого внимания заслуживает активация симпатоадреналовой системы и снижение активности парасимпатического отдела ВНС, связанные как с развитием общего адаптационного синдрома, так и со значительной структурной перестройкой миокарда, что обуславливает увеличение электрической нестабильности, склонность к возникновению фатальных нарушений сердечного ритма [2, 9, 10, 18], тем самым повышается риск кардиальной смерти.
Известно, что вагусное влияние понижает порог возникновения угрожающих жизни желудочковых аритмий и обеспечивает “антиаритмическую защиту”, возможно, путем снижения возбудимости кардиомиоцитов, а симпатическое, напротив, повышает этот порог, что приводит к более частым аритмическим осложнениям. Выявлено, что в остром периоде инфаркта миокарда (ИМ) наблюдается повышение тонуса симпатической нервной системы и снижение тонуса парасимпатической. В ряде исследований выявлено, что снижение вагусной активности или нарушение баланса влияний ВНС на синусовый ритм в пользу симпатического отдела, наблюдаемое уже в ранние сроки обострения ИБС, сопряжено с тяжестью заболевания и сохраняется не менее 6-12 месяцев [12, 15, 29]. Есть основания полагать, что этот дисбаланс связан с повышенным риском развития тяжелых осложнений и смерти: так, существуют свидетельства проаритмического эффекта уменьшения вагусных или повышения симпатическихвлияний на сердце, а также защитного действия противоположных изменений активности ВНС [10].
Исследования показали, что большинству эпизодов ишемии миокарда (61,8%) предшествовали значимые изменения тонуса ВНС (симпатической – 61,9%, парасимпатической – 38,1%). Остальные эпизоды (38,8%) возникали на фоне неизмененной активности ВНС. Установлено, что повышение активности симпатической нервной системы достоверно уменьшает продолжительность эпизодов безболевой ишемии миокарда и увеличивает длительность приступов спонтанной стенокардии [4]. Органические изменения миокарда, особенно ИМ, вносят значительные изменения в регуляторные процессы автономной нервной системы вследствие развития “вегетативной денервации” сердца. Нарушение вегетативной регуляции сердечно-сосудистой системы может быть обусловлено усилением симпато-симпатических [13, 31, 32] и симпато-вагальных рефлексов [37]. Изменение геометрических свойств пораженного миокарда приводит к усилению афферентной симпатической стимуляции вследствие механического раздражения нервных окончаний и рефлекторному ослаблению парасимпатических влияний на сердце [31]. Также снижается ответ клеток синусового узла на изменение нейрорегуляторных механизмов.
Достаточно хорошо освещен обсуждаемый в течение длительного времени вклад ВНС в генезис нарушений ритма сердца и внезапной кардиальной смерти у больных ИБС [14]. Известно, что по мере прогрессирования ИБС зоны ишемии, а также фиброза и кардиосклероза становятся более чувствительными к воздействию катехоламинов и поэтому реагируют на малейшие изменения симпатического тонуса [27]. В последние годы выявлено, что очаговые повреждения нервных волокон в желудочках сердца у больных с перенесенным ИМ могут приводить к нарушению реполяризации и, таким образом, способствовать электрической нестабильности миокарда [7, 8].Обнаружено, что при ИМ и нестабильной стенокардии нарушения симпатической иннервации сердца превышают по площади и глубине зоны нарушенной перфузии, что объясняется большей чувствительностью нейрональных окончаний к ишемии. Предполагается, что усиление адренергических влияний на кардиомиоциты у больных с ОКС происходит вследствие снижения захвата симпатическими окончаниями сердца поступающего из кровотока норадреналина [7].
Известно, что нервная регуляция стабилизирует электрическую активность сердца. Повреждения внутрисердечных нервных волокон и ганглиев могут лежать в основе серьезных нарушений образования импульсов, проведения возбуждения и нарушения процессов реполяризации миокарда. Длительные сравнительные клинические и патологоанатомические наблюдения свидетельствуют о том, что у больных с ВКС нервные волокна часто изменены вблизи проводящей системы сердца [20, 21]. Также встречаются очаговые повреждения нервных волокон в желудочках сердца, которые могут приводить к нарушению реполяризации и способствовать электрической нестабильности миокарда [42]. В литературе описаны связи между нервными волокнами и кардиомиоцитами, особенно расположенными вблизи проводящей системы, где в большом количестве проходят периферические нервы [22, 23, 43]. Не исключено, что поражение нервных сплетений в желудочках сердца, где определяется большое количество симпатических нервов [41], вызывают нарушения реполяризации из-за изменения адренергических нервных влияний. Вблизи синусового узла могут повреждаться как симпатические, так и парасимпатические нервные элементы, и естественно предположить, что поражения нервных волокон разной медиаторной природы будет вызывать противоположное действие.
Таким образом, эпидемиологические, клинические и морфологические данные убедительно доказывают, что регуляция ВНС является одним из наиболее важных механизмов, стабилизирующих электрическую активность сердца. А повреждения внутрисердечных нервных волокон и ганглиев у больных ИБС, могут лежать в основе серьезных нарушений ритма сердца.
Литература
- Bojcov S.A., Nikulina N.N., Jakushin S.S. i dr. Vnezapnaja serdechnaja smert’ u bol’nyh IBS: rasprostranennost’, vyjavljaemost’ i problemy statisticheskogo ucheta // Rossijskij kardiologicheskij zhurnal. -2011.-№2.-S.59-64.
- Bokerija L.A., Revishvili A.Sh., Neminushhij N.M. Vnezapnaja serdechnaja smert’. – M.: GJeOTAR-media, 2011. – 272 s.
- Vahljaev V.D., Nedostup A.V., Caregorodcev D.A. i soavt. Rol’ gumoral’nyh faktorov v patogeneze aritmij serdca // Rossijskij medicinskij zhurnal. -2000.-№2.-S. 54-57
- Dzizinskij A.A., Smirnova Ju.Ju., Beljalov F.I. Ocenka aktivnosti vegetativnoj nervnoj sistemy pri pristupe ishemii miokarda s pomoshh’ju issledovanija variabel’nosti ritma // Kardiologija. -1999.-№1.-S. 34-37.
- Ivanov G.G., Smetnev A.S., Syrkin A.L. i dr. Osnovnye mehanizmy, principy prognoza i profilaktiki vnezapnoj serdechnoj smerti // Kardiologija.-1998.-№12.-S. 64-73
- Kalinkin M.N., Dubrovin I.A., Chelnokov V.S. Strukturno-metabolicheskie osnovy central’nyh mehanizmov vnezapnoj serdechnoj smerti // Kardiologija. -2000.-№4.-S. 30-33
- Nifontov E.M., Shihaliev D.R., Bogachev M.I. i dr. Antiaritmicheskaja jeffektivnost’ omega-3 polinenasyshhennyh zhirnyh kislot u bol’nyh stabil’noj ishemicheskoj bolezn’ju serdca s zheludochkovymi narushenijami ritma // Kardiologija. -2010.-№12.-S.:15-17.
- Jakushin S.S., Bojcov S.A., Furmenko G.I., i dr. Vnezapnaja serdechnaja smert’ u bol’nyh ishemicheskoj bolezn’ju serdca po rezul’tatam Rossijskogo mnogocentrovogo jepidemiologicheskogo issledovanija Zabolevaemosti, smertnosti, kachestva diagnostiki i lechenija ostryh form IBS (REZONANS) // Rossijskij kardiologicheskij zhurnal. -2011.-№2.-S. 59-64
- Algra A., Tijssen J.G.P., Roelandt J.R.T.C., et al. Heart rate variability from 24-hour electrocardiography and the 2-year risk for sudden death // Circulation. -1993.- Vol. 88, №1.-P. 180-185.
- Bernardi L., Salvucci F., Suardi R., et al. Evidence for an intrinsic mechanism regulating heart rate variability in the transplanted and the intact heart during submaximal dynamic exercise? // Cardiovasc Res. – 1990.-№24.-P. 969-981.
- Bigger J.T., Fleiss J.L., Rolnitzky L.M., et at. Time course of recovery of heart period variability after myocardial infarction // J Am Coll Cardiol. -1991.- Vol. 18, №7.-P. 1643-1649
- Brown A.M., Malliani A. Spinal sympathetic reflexes initiated by coronary receptors // J Physiol. – 1971-№212.-P. 685-705.
- Cao J.M., Fishblin M.C., Ham J.B. et al. Relationship between regional cardiac hyperinnervation and ventricular arrhythmia // Curculation. – 2000.-Vol. 101, №16.-P. 1960-1969.
- Casolo G.C., Stroder P., Signorini С., et al. Heart rate variability during the acute phase of myocardial infarction // Circulation. – 1992.- Vol. 85, №6.-P. 2073-2079
- Cerati D., Schwartz P.J. Single cardiac vagal fiber activity, acute myocardial ischemia, and risk for sudden death // Circ Res. – 1991.-№69.-P. 1389-1401.
- Chen S.W. A wavelet-based heart rate variability analysis for the study of nonsustained ventricular tachycardia // Trans Biomed Eng. – 2002.- Vol. 49, №7.-P. 736-742
- Ewing D.J. Heart Rate Variability: New Risk Factor in Patients Following Myocardial Infarction // Clin Cardiol. – 1991.-№14.-P. 683-685
- ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST- segment elevation // European Heart Journal. – 2012.- doi:10.1093/eurheartj/ehs 215.
- James T.N. De Subitaneis Mortibus. Apoplexy of the heart // Circulation. – 1978.-P. 385-391.
- James T.N., Zipes D.P., Finegan F.E., Eisele J.W., Carter J.E. Cardiacganglionitis associated with sudden unexpected death // Ann. Intern. Med. – 1979/- №91.- 727-730.
- James T. N. Cholinergic mechanisms in the sinus node with particular reference to the actions of hemicholinium // Circ. Res. – 1966.-. №19.-P. 347-357.
- James T. N., Bear E. S., Lang K. F., Green E W., Winkler H. H. Adrenergic mechanisms in the sinus node // Arch, Intern. Med. – 1970.-№125.-P. 512-547.
- Griffin B.P., Topol E.J. The manual of cardiovascular medicine. – LWW, 2013. – 1192.
- Kaasik A., Ristimae T., Soopold U. The relationship between left ventricular mass and ventricular late potential in patients with myocardial infarction // J Coronary Artery Disease. – 2001.- Vol. 4, №1.-P. 60.
- Kent K.M., Smith E.R., Redwood O.R., et al. Electrical stability of acutely ischemic myocardium. Influences of heart rate and vagal stimulation // Circulation. -1973.- Vol.47, №2.-P. 291-298
- Leenhardt A., Maison-Blancke P., Denjoy I. et al. Mechanism of spontaneous occurence of tachycardia // Arch Mal Coeur Vaiss. – 1999.- Vol. 92, №1.-P. 17-22
- Levy M.N. Sympathetic-parasympathetic interactions in the heart // Circ Res. – 1971.-№29.-P. 437-445.
- Lombardi F., Sandrone G., Pempruner S., et al. Heart rate variability as an index of sympathovagal interaction after acute myocardial infarction // Am J Cardiol. -1987.- Vol. 60, №16.-P. 1239-1245.
- Lown B., Verrier R.L. Neural activity and ventricular fibrillation // N Engl J Med. -1976.- Vol. 294, №21.- 1165-1170.
- Malfatto G., Rosen T.S., Steinberg S.F. et al. Sympathetic neural modulation of cardiac impulse initiation and repolarization in the newborn rat // Circ Res. – 1990.-№66.-P. 427-437.
- Malliani A., Recordati G., Schwarz P.J. Nervous activity of afferent cardiac sympathetic fibers with atrial and ventricular endings // J Physiol. -1973.-№229.-P. 457-469.
- Malliani A. Cardiovascular sympathetic afferent fibers // Rev Physiol Biochem Pharmacol. – 1982.-№94.-P. 11-74
- Malliani A., Schwartz P.J., Zanchetti A. A sympathetic reflex elicited by experimental coronary occlusion // Am J Physiol. – 1969.-№217.-P. 703-709.
- Nannenberg, E. A., Sijbrands, E. J. G., Dijksman, et al. Mortality of Inherited Arrhythmia Syndromes / Clinical Perspective // Circulation: Cardiovascular Genetics. – 2012.- Vol. 5, №2.-P. 183-189.
- Osaka M., Saitoh H., Sasabe N. et al. Changes in autonomic activity preceding onset of nonsustained ventricular tachycardia // Ann Noninvasive Electrocardiol. – 1996.- Vol. 1, №1.- 3-11.
- Schwarz P.J., Pagani M., Lombardi F., Malliani A., Brown A.M. A cardio-cardiac sympatho-vagal reflex in the cat // Circ Res. – 1973.-№32.-P. 215-220.
- Saul J.P., Berger R.D., Albrecht P., Stein S.P., Chen M.N., Cohen R.J. Transfer function analysis of the circulation: Unique insights into cardiovascular regulation // Am J Physiol. – 1991.-№261.-P. 1231-1245.
- Schwartz P.J., Vanoli E., Stramba-Badiale M., De Ferrari G.M., Billman G.E., Foreman R.D. Autonomic mechanisms and sudden death. New insights from analysis of baroreceptor relexes in conscious dogs with and without a myocardial infarction // Circulation. – 1988.- Vol. 78, №4.-P. 969-979.
- Schwarz P.J., Pagani M., Lombardi F., Malliani A., Brown A.M. A cardio-cardiac sympatho-vagal reflex in the cat // Circ Res. – 1973.-№32.-P. 215-220.
- Shvalev V.N., Stropus R.A., Abraytis R.I., et al. Ultrastructural and histochemical studies of the cardiac nervous system and the hypothalamohypophyseal-adrenal system in sudden cardiac death. In: Sudden Cardiac Death, Proceedings of the Third USA-USSR Joint Symposium, Kaunas, USSR, June 29-July 1, 1982. Washington, D.C.: U.S. Department of Health & Human Services, Public Health Service, National Institutes of Health. // DNEW Рublication no. (NIH) 84–1604.- 1984.-P. 115-139.
- Third Universal Definition of Myocardial Infarction // European Heart Journal. – 2012.- doi:10.1093/eurheartj/ehs 184.
- Urthaler F., Katholi С.R., Macy J., James T.N. Electrophysiological and mathematical characteristics of the escape rhythm during complete AV block // Cardiovasc. Res. – 1974.-№8.-P. 173-186.
Трепетание предсердий: какова роль вегетативной нервной системы?
Трепетание предсердий (ТП) занимает второе место среди тахиаритмий по распространенности после фибрилляции предсердий (ФП) с частотой встречаемости до 10–15 % всех наджелудочковых нарушений ритма и характеризуется правильным предсердным ритмом с частотой 250–350 уд/мин [47].
Помимо возраста и мужского пола, факторы риска возникновения ТП включают сердечную недостаточность (СН), хронические заболевания легких, перенесенное острое нарушение мозгового кровообращения и инфаркт миокарда. Состояниями, ассоциированными с ТП, являются: тиреотоксикоз, клапанные пороки сердца, заболевания перикарда, оперативные вмешательства на открытом сердце, обширные экстракардиальные оперативные вмешательства и особенно хирургическая коррекция врожденных пороков сердца [13, 27, 28, 31, 57, 63]. Важным фактором, влияющим на инициацию или поддержание ТП, является активность вегетативной нервной системы (ВНС). В то же время исследования по изучению роли ВНС в генезе аритмии выполнялись, как правило, у больных с ФП и ТП [21, 43, 50].
Синдром тахибрадикардии (синусовая брадикардия в сочетании с ТП или предсердной тахикардией) как проявление повышенного тонуса вагуса нередко выявляют у молодых пациентов без органической кардиальной патологии. Синусовая брадикардия является независимым предиктором развития ТП. Антиаритмическая терапия (ААТ) в таких ситуациях имеет ряд ограничений: длительный прием антиаритмических препаратов (ААП) может привести к симптомной брадикардии или проаритмогенным эффектам [28, 29, 45].
Какова роль вегетативной нервной системы в патогенезе трепетания предсердий?
На возникновение ТП влияет повышенный как симпатический, так и парасимпатический тонус. Вегетативные ганглии, содержащие симпатические и парасимпатические волокна, находятся на эпикардиальной поверхности обоих предсердий, сконцентрированы на задней стенке рядом с устьями легочной вены, верхней полой вены и каротидного синуса.
У здорового человека доминируют вагусные влияния на предсердия. Часто ранней характеристикой больного сердца является снижение вагусного тонуса, что обычно предшествует увеличению симпатического тонуса [51, 52, 59].
В экспериментах на животных доказано возникновение пароксизма ФП под влиянием стимуляции блуждающего нерва. Причем вероятность возникновения ФП линейно возрастала при увеличении частоты стимуляции вагуса. А вагусная денервация предсердий предотвращает запуск ФП [30, 34, 48]. В другом исследовании у 297 больных с пароксизмальной формой ФП вагусная денервация, проведенная в сочетании с расширенной эндокардиальной катетерной абляцией, ассоциировалась со значимым снижением частоты последующих эпизодов ФП в 1/3 случаев [28, 44, 49].
Логично обоснованным представляется мнение исследователей о том, что способность ВНС индуцировать ФП/ТП не находится в прямой зависимости от индивидуальной активности симпатической или парасимпатической нервной системы, а определяется результатом их комплексного взаимодействия, зависящим от тонуса каждого из отделов и последовательности изменений активности в них. Исследования показали, что изолированное существенное повышение вагусной активности обусловливает высокий риск развития аритмии [22, 46]. В то же время значительное самостоятельное повышение симпатической активности сопровождается менее выраженным аритмогенным эффектом. Повышение симпатической активности может существенно ингибировать аритмогенные вагусные эффекты [28, 58, 67].
Какие существуют различия в ответе предсердий на повышение вагусного или симпатического тонуса?
Известно, что вагусная стимуляция характеризуется укорочением протяженности волны возбуждения с тенденцией к формированию петель macrore-entry при ТП или предсердной тахикардии. При симпатической стимуляции имеет место тенденция к формированию петель microre-entry, развитию патологического повышенного автоматизма и триггерной активности [32, 35]. Такое различие, по мнению Р. Coumel, в определенной мере объясняется наличием органических поражений предсердий и их выраженностью. При наличии последних предсердия более чувствительны к адренергическим влияниям [34, 36]. Р. Coumel предложил выделять вагусную и симпатическую формы ФП/ТП, основываясь на клинических различиях (табл. 1).
Описанные формы ФП/ТП в чистых вариантах встречаются нечасто. Однако, по данным других исследований, у большинства больных не представляется возможным установить вегетативный вариант аритмии. В других исследованиях вегетативный тонус был определен только в 34 % случаев, причем в отличие от данных Р. Coumel, где преобладала вагусная форма, последняя имела место лишь в 14 % случаев, а симпатический профиль начала пароксизмов был в 20 % случаев [28]. По мнению А. Waldo, выделение вегетативного статуса, предложенное Р. Coumel и соавт., несомненно, улучшило как понимание факторов, способствующих развитию аритмии, так и терапевтическую тактику при пароксизмах. Однако большинство больных с пароксизмами ФП/ТП не могут быть распределены в подгруппы вагусного или адренергического профиля на основании клинических критериев, используемых Р. Coumel [63].
Повышенный парасимпатический и сниженный симпатический тонус оказывает отрицательный дромотропный эффект на атриовентрикулярное (АВ) проведение, тогда как усиление симпатического влияния и ослабление парасимпатического оказывают противоположный эффект [13, 41, 50, 68]. Тонус вагуса также усиливает отрицательный хронотропный эффект скрытого проведения в АВ-узле [13]. Колебания вегетативного тонуса могут определять различия желудочкового ответа при ФП/ТП у каждого больного, примером чего может служить замедление желудочкового ритма во время сна и его ускорение при физической нагрузке.
Как диагностировать вегетативные нарушения у больных с трепетанием предсердий?
Инициация аритмии исключительно за счет нарушений ВНС в клинике встречается довольно редко и может наблюдаться только в ситуациях с повышенным симпатическим или вагусным тонусом. Но записи вариабельности сердечного ритма (ВСР), выполненные методом холтеровского мониторирования электрокардиограммы (ЭКГ), обнаруживают у некоторых больных вегетативные нарушения, которые предшествуют началу пароксизма [28, 39].
Для оценки преобладающего типа ВНС проводятся функциональные (синокаротидная, ортостатическая, дыхательная, кашлевая, холодовая и др.) и фармакологические (с пропранололом и атропином) пробы [3].
Наиболее точным методом на сегодняшний день, дающим возможность судить о функции ВНС миокарда, является оценка ВСР. Вариабельность и колебания сердечного ритма в зависимости от средней частоты сердечных сокращений (ЧСС) являются естествен ной реакцией сердечно-сосудистой системы. Изменение ритма сердца — универсальная реакция целостного организма на любое воздействие внешней среды. В основе ее лежит обеспечение баланса между симпатической и парасимпатической нервной системой. Именно на этом основываются многочисленные методы изучения ВСР [4, 5, 11].
При холтеровском мониторировании ЭКГ имеет значение выделение двух компонентов — HF (высокочастотный) и LF (низкочастотный) уровни, при этом HF отражает прежде всего уровень дыхательной аритмии и парасимпатических влияний на сердечный ритм, LF — преимущественно симпатические влияния, но парасимпатический тонус также влияет на его формирование. Рассчитывается и соотношение LF/HF, что отражает уровень вагосимпатического тонуса [11, 25, 26].
ВСР в большей степени отражает изменения в относительной вегетативной модуляции сердечного ритма, чем абсолютный уровень симпатического или парасимпатического тонуса. Оказалось, что баланс между симпатическими и вагусными влияниями является таким же важным прогностическим фактором аритмии, как и абсолютный симпатический и парасимпатический тонус. Колебания вегетативного тонуса при измерении ВСР появляются до возникновения аритмии. У некоторых пациентов со структурно нормальным сердцем наблюдалось преобладание вагусного влияния за несколько минут до начала ФП, в то время как у других пациентов наблюдался сдвиг в сторону преобладания симпатического влияния. Хотя Р. Соumеl и выделил вагусную и адренергическую формы ФП, эти случаи, вероятно, представляют собой крайние варианты воздействий ВНС [28].
У больных с брадисистолической формой ФП практически невозможно оценить функциональное состояние синусового узла (СУ), но можно предположить его дисфункцию. В то же время у пациентов с тахисистолической формой ТП не исключается наличие органических нарушений функции СУ [13, 40].
Оценить функцию АВ-проведения у больных с брадисистолическим ТП возможно с помощью атропиновой пробы (патент Украины № 45439 от 10.11.2009 г.). Атропин, блокируя парасимпатическое влияние на сердце, способствует улучшению АВ-проведения, и при его отсутствии прогнозируются органические нарушения АВ-соединения.
Какое влияние оказывает тонус вегетативной нервной системы на подбор антиаритмической терапии при трепетании предсердий?
Согласно существующим современным рекомендациям, до начала ААТ проводят лечение провоцирующих состояний или обратимых причин ФП/ТП (класс рекомендаций I, уровень доказательности С) [19, 28]. Общепринятых рекомендаций в отношении выбора ААП для лечения персистирующей формы ФП/ТП на сегодняшний день не существует. Один из подходов решения этой задачи предусматривает проведение дифференцированной терапии в зависимости от того, с активацией какой части ВНС связано возникновение приступов аритмии [37, 38, 42, 65, 66].
Если приступы аритмии связаны с повышением активности симпатической системы, b -адреноблокаторы являются препаратами выбора первой линии, а при их неэффективности применяются пропафенон, обладающий относительно выраженными b -блокирующими свойствами, и соталол. Амиодарон у пациентов с изолированным ТП является менее удачным средством выбора [9, 60].
При вагусном патогенетическом типе ТП необходимо блокировать рефлекторные воздействия на миокард. С этой целью устраняют метеоризм, запоры, ограничивают объем пищи, рекомендуют после еды хотя бы час находиться в вертикальном положении, не есть на ночь. Большое значение имеет снижение массы тела у тучных людей, регулирование углеводного обмена, больным советуют избегать резких поворотов, наклонов туловища.
При вагусных пароксизмах рекомендовано начинать лечение с применения антихолинергических препаратов, таких как дизопирамид или хинидин, а b -адреноблокаторы и сердечные гликозиды считаются противопоказанными, т.к. усугубляют симптоматику. Следует отметить, что дизопирамид относится к ААП с доказанной эффективностью, в то же время, согласно рекомендациям, эффективность хинидина не доказана [28, 53].
Дигиталис, которой замедляет АВ-проведение преимущественно за счет повышения вагусного тонуса, более эффективен для контроля частоты желудочковых сокращений (ЧЖС) при ТП в покое, чем при нагрузке [17].
У пациентов с вагусной формой ТП антихолинергическая активность дизопирамида теоретически делает его препаратом выбора. В этой ситуации флекаинид и амиодарон являются препаратами второй и третьей линии выбора соответственно, в то время как пропафенон не рекомендован к применению в связи с тем, что его внутренняя b -блокирующая активность может ухудшать течение аритмии. В нескольких небольших рандомизированных исследованиях была показана эффективность применения дизопирамида для профилактики рецидивов ФП/ТП после проведения электрической кардиоверсии. В то же время дизопирамид обладает негативным инотропным и дромотропным эффектом, поэтому может стать причиной развития СН или АВ-блокады у больных с органическими нарушениями проводящей системы сердца (ПСС) [28, 56].
В ряде исследований сравнивалась эффективность профилактического противорецидивного лечения при ФП/ТП хинидина с пропафеноном и соталолом [33, 54, 55, 64]. Хинидин оказался менее эффективным ААП, а также при его использовании преобладали побочные эффекты [28]. Но следует отметить, что ни в одном из проведенных исследований не оценивалась его эффективность в зависимости от вегетативного статуса [61, 62].
Основным свойством ААП III класса, по классификации Е.М. Vaughan Williams (амиодарон, соталол, дофетилид, ибутилид, азимилид, дронедарон, нибентан), является их способность к существенному замедлению реполяризации без изменения скорости деполяризации, что приводит к значительному увеличению продолжительности потенциала действия и рефрактерных периодов. На ЭКГ это проявляется значительным увеличением продолжительности интервала P-Q и Q-T при неменяющейся продолжительности комплекса QRS. Большинству ААП этого класса свойственен феномен обратной частотной зависимости — антиаритмическое действие более выражено при редком ритме сердца, чем при частом. Это значит, что при лечении ААП III класса у больных с вагусной формой ТП на фоне брадикардии более значимым будет удлинение интервала Q-T, и поэтому — риск развития проаритмогенного действия в виде желудочковой тахикардии типа torsade de pointes [15, 16].
Исследованиями российских уче ных показана высокая эффективность аллапинина и этацизина (IС-класс) при лечении ФП/ТП у больных с брадикардиями [13, 15]. Влияние на ЧСС отличает их от других ААП этого класса (флекаинид и пропафенон). Но дизопирамид, хинидин и аллапинин в настоящее время в Украине не применяются.
Эффективным ААП IС-класса, кото рый может применяться у больных с вагусным типом ТП, является этацизин. Электрофизиологическим ме ханизмом его антиаритмического действия является замедление скорости проведения импульсов в миокарде. На ЭКГ под действием этацизина может наблюдаться расширение зубца Р и комплекса QRS, а также удлинение интервала P-Q. Высокая антиаритмическая эффективность получена в результате детальных электрофизиологических исследований Л.В. Розенштрауха и соавт., посвященных мембранно-клеточным механизмам его действия [18, 20]. Следует подчеркнуть, что, несмотря на отсутствие влияния на ЧСС, этацизин с осторожностью должен применяться у больных с органической кардиальной патологией и выраженными нарушениями ПСС. По данным некоторых работ, этацизин может вызывать увеличение ЧСС у больных с функциональными нарушениями ПСС [2, 10, 12–14, 23].
У пациентов с длительно существующей ФП/ТП после проведения кардиоверсии обычно проявляются имеющиеся нарушения функции СУ. Низкая ЧЖС без применения медикаментов, замедляющих АВ-проведение, может свидетельствовать о нарушении функции ПСС. Пациенты должны быть обследованы на предмет развития дисфункции СУ до кардиоверсии для возможности проведения профилактической трансвенозной или чрескожной имплантации электрокардиостимулятора [28]. Но данный подход больше относится к больным с ФП, в то же время желудочковая брадисистолия при ТП в большей мере свидетельствует о нарушениях АВ-проведения.
По современным рекомендациям, лечение амиодароном, флекаинидом, ибутилидом, пропафеноном или соталолом перед электрической кардиоверсией может повысить эффективность этой процедуры и уменьшить вероятность развития рецидивов аритмии (класс рекомендаций IIа, уровень доказательности В). Но у больных с вагусным типом ТП перед проведением кардиоверсии необходимо учитывать тонус ВНС в связи с риском проаритмогенных эффектов после восстановления синусового ритма: остановка СУ, АВ-блокады и ранние рецидивы аритмии.
При вагусном типе ТП появление острых и подострых рецидивов аритмии в большей степени может свидетельствовать о дисфункции ПСС, а отмена ААП, влияющих на функцию СУ и АВ-проведение, способствует сохранению синусового ритма. Необходимо также подчеркнуть, что применение высоких доз ААП и их комбинаций для замедления АВ-проведения при желудочковой тахисистолии может усугублять проаритмогенные эффекты после кардиоверсии. Кроме того, у больных с вагусным типом ТП возможно спонтанное восстановление синусового ритма после отмены ААП, блокирующих АВ-проведение ( b -адреноблокаторы, верапамил, дилтиазем, дигоксин).
Какой метод восстановления синусового ритма у больного с трепетанием предсердий наиболее эффективен в случае неэффективности медикаментозного лечения?
При ТП наиболее эффективным методом восстановления синусового ритма является электрокардиостимуляция, которую осуществляют с частотой, превышающей предсердный ритм, с целью проникновения импульса в круг macrorе-еntry и создания условий для его прерывания [13, 63, 68]. По данным ряда работ отмечено повышение эффективности электрокардиостимуляции на фоне предварительного применения ААП [13, 27]. В то же время существуют исследования, в которых не выявлено повышение эффективности процедуры у больных с предварительной антиаритмической подготовкой [7, 8]. Кроме того, у больных с ТП применение препаратов, блокирующих АВ-проведение перед кардиоверсией, не повышает ее результаты, т.к. АВ-узел не участвует в петле rе-еntry [6]. Как отмечалось выше, высокая частота желудочкового ритма при ТП не исключает наличие дисфункции СУ, а назначение ААП, замедляющих АВ-проведение, будет способствовать возникновению блокад после кардиоверсии. Следовательно, перед проведением электростимуляционной или электрической кардиоверсии целесообразно отменить препараты, блокирующие АВ-проведение.
Таким образом, восстановление синусового ритма при вагусном типе ТП является более трудной задачей для практического врача и подчас требует высокого врачебного профессионализма. Правильная оценка тонуса ВНС может способствовать как успешной кардиоверсии, так и длительному сохранению синусового ритма.
Bibliography1. Абрамкин Д.В., Явелов И.С., Грацианский Н.А. Связь изменений ЧСС во время рефлекторных тестов с вариабельностью ритма сердца // Кардиология. — 2004. — № 8. — С. 27-34.
2. Батушкин В.В., Науменко Е.В. Эффективная фармакологическая поддержка синусового ритма у больных с персистирующей формой фибрилляции предсердий // Укр. кардіол. журн. — 2005. — № 2. — С. 65-70.
3. Бренер И.П. Определение степени риска возникновения нарушений ритма сердца у больных с нестабильностью вегетативной регуляции // Укр. кардіол. журнал. — 1994. — № 4. — С. 71.
4. Буланова Н.А., Иванов Г.Г. Холтеровское мониторирование ЭКГ у больных с фибрилляцией предсердий // Кардиология и сер дечно-сосудистая хирургия. — 2008. — № 5. — С. 69-73.
5. Деев М.А. Клиническое моделирование динамики электрофизиологических процессов сердца и его симпатико-парасимпатический контроль // Укр. кардіол. журнал. — 2000. — № 5–6. — Выпуск II. — С. 54-56.
6. Зинченко Ю.В. Влияние функционального состояния атриовентрикулярного проведения на эффективность чреспищеводной электрокардиостимуляции при трепетании предсердий I типа // Укр. кардіол. журнал. — 2010. — № 3. — С. 72-78.
7. Зинченко Ю.В., Вализаде Чари Джафар, Рей Е.С. и др. Антиаритмическая подготовка перед восстановлением синусового ритма у больных с пароксизмами трепетания предсердий до 7 суток // Укр. кардіол. журнал. — 2008. — № 1. — С. 71-77.
8. Зинченко Ю.В., Вализаде Чари Джафар, Степаненко А.П. и др. Антиаритмическая подготовка перед восстановлением синусового рит ма у больных с пароксизмами трепетания предсердий более 7 суток // Укр. кардіол. журнал. — 2009. — № 3. — С. 72-78.
9. Исакова Н.Н., Кулаков Ю.В., Кононова А.М. и др. Эффективность лечения пароксизмальной фибрилляции предсердий препаратами пропафенона и амиодарона // Рос. кардиол. журнал. — 2006. — № 3. — C. 58-62.
10. Каверина Н.В., Лысковцев В.В., Сенова З.П. и др. Этацизин: фармакологические свойства и перспективы клинического применения // Кардиология. — 1984. — № 5. — С. 52-57.
11. Коркушко О.В., Писарук А.В., Шатило В.Б. Значение ана ли за вариабельности ритма сердца в кардиологии: возрастные аспекты // Кровообіг та гемостаз. — 2009. — № 1–2. — С. 127-139.
12. Крючкова О.Н., Заболотнов В.А., Романец В.Н. и др. Применение этацизина в лечении аритмій сердца у беременных // Укр. кардіол. журнал. — 2000. — № 3. — С. 40-42.
13. Кушаковский М.С. Аритмии сердца. Нарушения сердечного рит ма и проводимости: Руководство для врачей. — СПб.: Фолиант, 2004. — 672 с.
14. Лозинский Л.Г., Замотаев И.П., Керимова Р.Э. и др. Результаты лечения пароксизмальной мерцательной аритмии этацизином // Кардиология. — 1989. — № 7. — С. 37-40.
15. Недоступ А.В. Некоторые трудности и спорные вопросы лечения аритмий // Кардиология и сер дечно-сосудистая хирургия. — 2007. — № 1. — С. 9-15.
16. Несукай О.Г., Бренер І.П. Нові підходи до лікування хворих з пароксизмальними формами фібриляції передсердь // Матеріали V конгресу кардіологів України, Київ, 12–14 травня 1997 // Укр. кардіол. журнал (додаток до № 3). — 1996. — С. 232.
17. Подлесов А.М., Бойцов С.А., Егоров Д.Ф. и др. Мерцательная аритмия. — ЭЛБИ-СПб., 2001. — С. 203.
18. Лозинский Л.Г., Замотаев И.П., Керимова Р.Э., Ракова Н.А. Результаты лечения пароксизмальной мерцательной аритмии этацизином // Кардиология. — 1989. — № 7. — С. 37-40.
19. Рекомендації Робочої групи з порушень серцевого ритму Українського наукового товариства кардіологів. Принципи ведення хворих з фібріляцією та тріпотінням передсердь // Укр. кардіол. журнал. — 2003. — № 2 (додаток). — С. 4.
20. Розенштраух Л.В., Алиев Р.Р., Белошапко Г.Г. и др. Экспериментальный и теоретический анализ роли локальной невозбудимости холинергической природы в возникновении мерцания и трепетания предсердий // Кардиология. — 2007. — № 4. — С. 4-17.
21. Сергиенко И.В., Алексеева И.А., Камбегова А.А. и др. Нарушения вегетативной иннервации миокарда у больных ишемической болезнью сердца // Кардиология. — 2004. — № 8. — С. 82-87.
22. Сетынь Т.В., Колпаков Е.В., Волов Н.А. Значение вариабельности ритма сердца и результатов чреспищеводной стимуляции предсердий для определения риска повторных пароксизмов фибрилляции предсердий // Рос. кардиол. журнал. — 2007. — № 2. — С. 66-71.
23. Сычев О.С., Зинченко Ю.В. Эффективность применения антиаритмического препарата этацизина у больных с нарушениями ритма сердца // Укр. кардіол. журн. — 2007. — № 5. — С. 62-66.
24. Таджиева Н.И., Мазыгула Е.П., Белов Б.С. и др. Вариабельность ритма сердца у больных с пароксизмальной фибрилляцией предсердий раз личной этиологии // Кардиология. — 2005. — № 1. — С. 28-34.
25. Хаспекова Н.Б., Соловьева А.Д., Недоступ А.В. и др. Спектральный анализ вариабельности ритма сердца в диагностике вегетативной дисфункции у больных с пароксизмальной формой мерцательной аритмии // Кардиология. — 2004. — № 11. — С. 61-65.
26. Яблучанский Н.И., Мартимьянова Л.И. Сердечная недоста точность и вариабельность ритма сердца при мерцательной аритмии // Укр. кардіол. журнал. — 2002. — № 1. — С. 49-51.
27. ACC/AHA/ESC 2003 Guidelines for management patients with supraventricular arrhythmias // Eur. Heart. J. — 2003. — Vol. 24, № 20. — Р. 1857-1897.
28. ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation // Circulaition. — 2006. — Vol. 114. — P. 257-354.
29. Aime-Sempe C., Folliguet T., Rucker-Martin C. et al. Miocardial cell death in fibrillating and dilated hu man right atria // J. Am. Coll. Cardiol. — 1999. — № 34. — P. 883-891.
30. Akyurek O., Sayin T., Dincer I. et al. Lengthening of intraatrial conduction time in atrial fibrillation and its relation with early recurrence of atrial fibrillation // Jpn. Heart J. — 2001. — № 42. — P. 575-584.
31. Baretto A.C., Wady C., Nussbacher A. et al. Atrial fibrillation in endomyocardial fibrosis is a marker of worse prognosis // Int. J. Cardiol. — 1998. — № 67. — P. 19-25.
32. Brundel B.J., Henning R.H., Kampinga H.H. et al. Molecular mechanisms of remodeling in human atrial fibrillation // Cardiovasc. Res. — 2002. — № 54. — P. 315-324.
33. Castro A., Bianconi L., Santini M. New antiarrhythmic drugs for the treatment of atrial fibrillation // Pacing Clin. Electrophysiol. — 2002. — № 25. — P. 249-259.
34. Coumel P. Paroxysmal atrial fibrillation: a disorder of autonomic tone? // Eur. Heart J. — 1994. — Vol. 15. — P. 9-16.
35. Cox J.L. Cardiac surgery for arrhythmias // J. Cardiovasc. Electrophysiol. — 2004. — № 15. — P. 250-262.
36. Friberg J., Scharling H., Gadsbolln et al. Sex-specific increase in the prevalence of atrial fibrillation (The Copenhagen Citi Heart Study) // Am. J. Cardiol. — 2003. — № 92. — P. 1419-1423.
37. Gillinov A.M., McCarthy P.M. Advances in the surgical treatment of atrial fibrillation // Cardiol. Clin. — 2004. — № 22. — P. 147-157.
38. Hocini M., Sanders P., Jais P. et al. Techniques for curative treatment of atrial fibrillation // J. Cardiovasc. Electrophysiol. — 2004. — № 15. — P. 1467-1471.
39. Kerr C.R., Humphries K.H., Talajic M. et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: results from the Canadian Registry of Atrial Fibrillation // Am. Heart. J. — 2005. — № 149. — P. 489-496.
40. Lamas G.A., Lee K.L., Sweeney M.O. et al. Ventricular pacing or dualchamber pacing for sinus-node dys function // N. Engl. J. Med. — 2002. — 346. — P. 1854-1862.
41. Lazar S., Dixit S., Marchlinski F.E., Callans D.J., Gerstenfeld E.P. Presence of left-to-right atrial fre quency gradient in paroxysmal but not persistent atrial fibrillation in humans // Circulation. — 2004. — № 110. — P. 3181-3186.
42. Lee M.A., Weachter R., Pollak S. et al. The effect of atrial pacing therapies on atrial tachyarrythmia burden and frequency: results of a randomized trial in patients with bradycardia and atrial tachyarrythmias // J. Am. Coll. Cardiol. — 2003. — № 41. — P. 1926-1932.
43. Levi S. Factors predisposing to the development of atrial fibrillation // Pacing Clin. Electrophysiol. — 1997. — № 20. — P. 2670-2674.
44. Li Z., Hertervig E., Yuan S. et al. Dispersion of atrial repolarization in patiens with paroxysmal atrial fibrillation // Europace. — 2001. — № 3. — P. 285-291.
45. Lloud-Jones D.M., Wang T.J., Liep E.P. et al. Lifetime risk for development of atrial fibrillation: the Frimingham Heart Study // Circulation. — 2004 — № 110. — P. 1042-1046.
46. Lombardi F., Tarricone D., Tundo F. et al. Autonomic nervous s ystem and paroxysmal atrial fibrillation: a study based on the analysis of RR interval changes before, during and after paroxysmal atrial fibrillation // Eur. Heart J. — 2004. — № 25. — P. 1242-1248.
47. Maisel W.H., Stevenson L.W. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and ra tionale for therapy // Am. J. Cardiol. — 2003. — № 91. — P. 2D-8D.
48. Maisel W.H. Autonomic modulation preceding the onset of atrial fibrillation // J. Am. Coll. Cardiol. — 2003. — № 42. — P. 1269-1270.
49. Mozaffarian D., Psaty B.M., Rimm E.B. et al. Fish intake and risk of incident atrial fibrillation // Circulation. — 2004. — № 110. — P. 368-373.
50. Myerburg R.J., Kessler K.M., Castellanos A. Recognation, clinical assessment and management of arrhythmias and conduction disturbances // Hurst»s The Heart, Arterial and veins / Ed. by R.W. Alexander, R.C. Schlant, V. Fuster et al. — New York/San Francisco: McGraw-Hill, 1998. — Ch. 27. — P. 873-941.
51. Nattel S. New ideas about atrial fibrillation 50 years on // Nature. — 2002. — № 415. — P. 219-226.
52. Nattel S., Khairy P., Roy D. et al. New approaches to atrial fibrillation management: a critical review of a rapidly evolving field // Drugs. — 2002. — № 62. — P. 2377-2397.
53. Parcker D.L., Asirvatham S., Munger T.M. Progress in nonpharmacologic therapy of atrial fibrillation // J. Cardiovasc. Electrophysiol. — 2003. — № 14. — P. 296-309.
54. Peters N.S., Schilling R.J., Kanagaratnam P. et al. Atrial fibrillation: strategies to control, combat, and cure // Lancet. — 2002. — № 359. — P. 593-603.
55. Prystowsky E.N. Management of atrial fibrillation: therapeutic options and clinical decisions // Am. J. Cardiol. — 2000. — № 85. — P. 3-11.
56. Rationale and design of a study assessing treatment strategies of atrial fibrillation in patients with heart failure: the Atrial Fibrillation and Congestive Heart Failure (AF-CHF) trial // Am. Heart J. — 2002. — № 144. — P. 597-607.
57. Sakade K., Fukuda N., Soeki T. et al. Relation of age and sex to atrial electrophysiological properties in patients with no history of atrial fibrillation // Pacing Clin. Electrophysiol. — 2003. — № 26. — Р. 1238-1244.
58. Savelieva I., Camm A.J. Clinical relevance of silent atrial fibrillation: prevalence, prognosis, quality of life, and management // J. Interv. Card. Electrophysiol. — 2000. — № 4. — P. 369-382.
59. Stewart S., Hart C.L., Hole D.J. et al. A population-based study of the long-term risks associated with atrial fibrillation: 20 year follow-up of the Renfrew / Paisley study // Am. J. Med. — 2002. — № 113. — P. 359-364.
60. Tamargo J., Caballero R., Delpon E. Pharmacological approaches in the treatment of atrial fibrillation // Curr. Med. Chem. — 2004. — № 11. — P. 13-28.
61. Tamariz L.J., Bass E.B. Pharmacological rate control of atrial fibrillation // Cardiol. Clin. — 2004. — № 22. — P. 35-45.
62. Van Gelder I.C., Hagens V.E., Bosker H.A. et al. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation // N. Engl. J. Med. — 2002. — № 347. — P. 1834-1840.
63. Waldo A.L., Wit A.L. Mechanisms of cardiac arrhythmias and conduction disturbances // Hurst»s The Heart, Arterial and veins / Ed. By R.C. Schlant, V. Fuster et al. — New York/San Francisco: McGraw-Hill, 1998. — Ch. 26. — P. 825-872.
64. Wijffels M.C., Crijns H.J. Recent advances in drug therapy for atrial fibrillation // J. Cardiovasc. Electrophysiol. – 2003. — №14. – P.40-47.
65. Wijffels M.S., Crijns H.J. Rate versus rhythm control in atrial fibrilla tion // Cardiol. Clin. — 2004. — № 22. — P. 63-69.
66. Wyse D.G., Waldo A.L., DiMarco Jp. et al. A comparison of rate control and rhythm control in patients with atrial fibrillation // N. Engl. J. Med. — 2002. — № 347. — P. 1825-1833.
67. Yamada T., Fukunami M., Shimonagata T. et al. Prediction of paroxysmal atrial fibrillation in patients with congestive heart failure: a prospective study // Am. Coll. Cardiol. — 2000. — № 35. — P. 405-413.
68. Zipes D. Specific arrhythmias. Diagnosis and treatment // Heart Disease. A Textbook of Cardiovascu lar Medicine / Ed. by Е. Braun-
wald. — Philadelphia, Saunders. — 1988. — P. 658-716.
Урок № 23. «Гигиена вегетативной нервной системы и ее роль в регуляции физиологических процессов организма»
Урок с видеоматериалами разработан по учебнику «Человек и окружающая среда» Анастасова Л.П. и др, для пред профильного обучения с учётом изменившихся требований в условиях реализации нового образовательного стандарта. Необходимость формирования и развития физически и нравственно здорового человеческого общества.
Полная версия разработки уроков « Человек и окружающая Среда» (68час)
Тип урока- комбинированный
Методы: частично-поисковый, проблемного изложения, репродуктивный, объяснительно-иллюстративный.
Цели:
-осознание жизни как наивысшей ценности, умение строить свои отношения с природой и обществом на основе уважения к жизни, ко всему живому как уникальной и бесценной части биосферы;
-разностороннее развитие личности учащихся: наблюдательности, устойчивого познавательного интереса, стремление к самообразованию и применению полученных знаний на практике;
-формирование санитарно- гигиенической культуры, их экологического мышления и нравственности.
Задачи:
Образовательные: обладать определенными экологическими знаниями и гигиеническими знаниями — важную составляющую культуры каждого человека;
Развивающие: развивать познавательно — практическую направленность, свободу и творческую мысль, обще-учебные умения работы с научно- популярной литературойи интернет источниками
Воспитательные: воспитывать учащихся средствами данного урока для развития физически и нравственно здорового человеческого общества.
УУД
Регулятивные: организовывать своё рабочее место под руководством учителя; определять план выполнения заданий на уроке, оценивать результат своей деятельности.
Коммуникативные: участвовать в диалоге на уроке; отвечать на вопросы учителя, товарищей по классу; слушать и понимать речь других; работать в малой группе.
Познавательные: ориентироваться в учебнике; находить нужную информацию в тексте учебной статьи.
Планируемые результаты
Предметные
влияние человека на отдельные компоненты природы и влияние природы на все стороны человеческой деятельности;
подготовку школьников к практической деятельности в области биологии, экологии и медицины;
— установление гармоничных отношений с природой, со всем живым, как главной ценностью на Земле.
основную биоэкологическую терминологию и символику
Личностные:
формирование интереса к глобальной проблеме, получившую название: «экологическая проблема», которая связана с ухудшением качественных характеристик окружающей человека.
Межпредметные: связи с такими учебными дисциплинами как биология, химия, физика, география — будут способствовать более высокому уровню владения навыками по данному курсу и реализации задач предпрофильной подготовки школьников.
Форма урока— традиционная
Технология- проблемного обучения
Основные понятия
парасимпатическая, симпатическая нервная система, гомеостаз!
Изучение нового материала
ГИГИЕНА ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ И ЕЕ РОЛЬ В РЕГУЛЯЦИИ ФИЗИОЛОГИЧЕСКИХ ПРОЦЕССОВ ОРГАНИЗМА
Вегетативная нервная система располагается сегментами в спинном мозг е в виде двух цепочек, идущих вдоль позвоночника и в отдельные участки головного, мозга. Вегетативные нервные волокна пронизывают все наше тело. С периферии они несут информацию о работе внутренних органов и обратные приказы об их ;. корректировке. 15 вегетативной, нервной системе выделяются 2 отдела: симпатический и парасимпатический.
Первый работает с полной нагрузкой, когда необходимо поддержать активную деятельность организма. Так, он учащает ритмы сердца, расширяет зрачки, помогает сокращению мышц. Парасимпатический отдел активен в период покоя организма, например ночью. Во сне мышцы расслабляются, зрачки сужены, сердце бьется реже — идет накопление сил для следующего дня. Работа этих отделов при нормальной деятельности гибко связана между собой. Стоит повыситься кровяному давлению, как по парасимпатической системе к сердцу приходит приказ и оно замедляет свой ритм, сосуды расширяются.
Таким образом, достигается гармония в функционировании организма. Вегетативная нервная система изменяет и регулирует функции кровообращения и дыхания, процессы теплообмена й теплоотдачи, объем и состав крови, а также, выполняя ряд других функций, играет важнейшую роль в поддержании гомеостаза. Гомеостаз — совокупность процессов, обеспечивающих постоянство внутренней среды организма. Четкая, согласованная работа отдельных органов и систем координируется комплексами вегетативной нервной системы, располагающейся в головном мозге. Изменения их могут приводить к развитию вегетативных нарушений, которые проявляются в несогласованной работе отдельных органов и систем.
Это надо знать. Факторы, провоцирующие вегетативные нарушения: эмоциональные перегрузки, тяжелые сновидения, приступы эпилепсии, расстройства -вестибулярного аппарата, аллергические заболевания, инфекционные заболевания, различные физические и химические факторы \22\. Они приводят к заболеваниям функционального и органического характера. Заболевания, вызванные факторами риска, приводят к нарушению механизмов вегетативной системы через симпатические и парасимпатические отделы, которые изменяют состояние управляемых ими органов.
Задания 1. Рассмотрите схему на рисунке и объясните природу .- вегетативных нарушений. Условные обозначения: 1 :— большие полуша- ■ рия;2 — гипоталамус; 3 — гипофиз; 4 — ствол мозга; 5 — мозжечок; 6 — спинной мозг; 7 — симпатический ствол. Приведите примеры
Задание 2. На примере воздействия любого фактора риска проследите последствия, к которым приведет нарушение функции вегетативной нервной системы.
Подумайте и ответьте. 1. Какова роль вегетативной нервной системы в регуляции жизненных процессов организма? 2. Как строение вегетативной нервной системы связано с ее функцией? Приведите примеры. 3. Какие факторы приводят к нарушению стабильности в функционировании вегетативной нервной системы? 4. Какие меры профилактики необходимо предпринять для того, чтобы вегетативная нервная система функционировала стабильно?
Объясните значение терминов: парасимпатическая, симпатическая нервная система, гомеостаз!
Вегетативная нервная система
Соматический и вегетативный отделы. Урок биологии
Симп. и пара симпатические нервные части ВНС
Анатомия человека вегетативная нервная система и мышления
Симпатическая нервная система
Ресурсы:
Анастасова Л.П. и др. Человек и окружающая среда. Учебник для дифференцированного обучения 9класс. Москва « Просвещение» 1997г.320с
Сайт YouTube: https://www.youtube.com /
Хостинг презентаций
— http://ppt4web.ru/nachalnaja-shkola/prezentacija-k-uroku-okruzhajushhego-mira-vo-klasse-chto-takoe-ehkonomika.html
Роль вегетативной нервной системы в регенерации и апоптозе печени — Последние разработки — FullText — Digestion 2002, Vol. 66, № 2
Аннотация
Гепатоциты обладают большой репликативной способностью и способны повторно заселять печень. Предыдущие исследования показали, что вегетативная нервная система регулирует регенерацию печени и апоптоз. Более того, центральная нервная система модулирует их через вегетативную нервную систему.Область бокового гипоталамуса (ЛГ) и вентромедиальное ядро гипоталамуса (ВМГ) были изучены на предмет их роли в интеграции нейрогуморальной информации. ЛГ является частью парасимпатической системы, а ВМГ относится к симпатической системе. Сообщается, что поражения ЛГ вызывают повышение активности симпатического нерва, тогда как поражения ЛГ вызывают усиление активности блуждающего нерва. Более того, поражения VMH или LH способствуют регенерации печени после частичной гепатэктомии. Кроме того, гипоталамус опосредует апоптоз печени через вегетативную нервную систему.Хотя необходимы дальнейшие исследования для четкого определения роли, вегетативная нервная система является одним из важных факторов, регулирующих регенерацию печени и апоптоз.
© 2002 S. Karger AG, Базель
Введение
Вегетативная нервная система влияет на многие функции организма, включая сердечно-сосудистую систему, почки, печень, поджелудочную железу, желудочно-кишечный тракт и железы [1] (рис. 1).Подробные исследования механизмов, регулирующих рост печени и апоптоз, были выполнены на животных, перенесших частичную гепатэктомию или химическое повреждение [2]. Поскольку вегетативная нервная система напрямую иннервирует паренхиму печени и играет роль в метаболическом контроле [3], кажется вероятным, что регенерация печени и апоптоз совместно регулируются как гуморальными факторами, так и вегетативной нервной системой. Более того, хорошо известно, что вегетативные аномалии и нейропатия имеют тенденцию увеличиваться с возрастом [4].Распространенность и тяжесть вегетативной дисфункции, по-видимому, связаны с тяжестью заболевания печени и связаны с увеличением смертности [5, 6]. Сообщается также, что у пациентов с циррозом печени наблюдается парасимпатическая гипофункция и симпатическая гиперфункция [7, 8]. В последние годы растет интерес к взаимосвязи между печенью и вегетативной нервной системой. Здесь автор рассматривает текущее состояние исследований, направленных на понимание этих взаимосвязей.
Рис. 1
Схематическое изображение вегетативной нервной системы.
Иннервация вегетативной нервной системы в печени и прорастание нейронов регенерированной печени
Было показано, что паренхима печени имеет парасимпатическую и симпатическую иннервацию [9, 10, 11]. Однако хорошо известно, что внутрипеченочное распределение нервных волокон сильно зависит от вида; кроме того, даже внутри одного вида есть заметные вариации. Чтобы выявить характер и тип иннервации печени у разных видов животных, Akiyoshi et al.[12] исследовали распределение и плотность этих нервных волокон. Эти данные показывают, что были различия в паттернах печеночной иннервации у крыс, золотых хомяков, морских свинок, собак и людей. Данные также показывают, что (1) в печени крыс и хомяков функции печени могут регулироваться как симпатическими, так и парасимпатическими нервами в портальной области; (2) в печени морских свинок, собак и человека они могут регулироваться этими волокнами как в межлобулярной области (парасимпатическая и симпатическая системы), так и во внутрипаренхимальной области (симпатическая система), и, таким образом, (3) у морской свинки , печень собаки и человека, гепатоциты и синусоидальные клетки могут быть иннервируются симпатическими нервами.Berthoud et al. [13] исследовали распределение и структуру иннервации печени блуждающих крыс. Афферентные волокна блуждающего нерва образовывали характерные терминалы в трех местах ворот печени: (1) тонкое варикозное окончание, преимущественно окружающее, но не входящее в многочисленные перибилиарные железы в более крупных внутри- и внепеченочных желчных протоках; (2) большие чашевидные терминалы почти во всех параганглиях и (3) тонкие варикозные окончания в адвентиции воротной вены. В паренхиме печени не обнаружено волокон и окончаний.Варикозные эфферентные волокна блуждающего нерва присутствовали в пучках печеночной ветви блуждающего нерва и тонких терминальных структур в небольшой части параганглии. Не было обнаружено, что эфференты оканчиваются в паренхиме печени или на нескольких нейронах, встроенных в нервы или параганглию. Что касается симпатического нерва в тканях печени крыс, морских свинок и людей, Fukuda et al. [14] также сообщили, что волокна симпатических нервов располагались вокруг кровеносных сосудов в портальной области и вокруг центральной вены.Нормальные морские свинки и человеческая печень показали внутрилобулярные симпатические волокна, в то время как печень крысы — нет [15]. Кроме того, сообщалось, что печень морской свинки, кролика и кошки имеет плотную иннервацию симпатических нервов [15]. У этих животных нервные окончания расположены не только в оболочке Глиссона, но и глубоко в паренхиме.
Carobi [16] исследовал возможное наличие прорастания нервов в афферентных нейронах блуждающего нерва регенерированной печени крысы после гепатэктомии. Этот эксперимент проводился, чтобы увидеть, может ли увеличение паренхимы печени обеспечить адекватный стимул для процесса прорастания.Через 3 недели в регенерированной печени крысы прорастания нервов не происходило. Тем не менее, Tadokoro [17] ранее продемонстрировал, что скорость роста аксонов составляла приблизительно 5 мм / день вокруг ворот печени в модели хирургической дегенерации печени на крысах. Следовательно, регенерирующие аксоны, прорастающие из проксимальных культей аксонов, могут достичь ворот печени в течение 3 дней после трансплантации. В соответствии с этим Takahashi et al. [18] сообщили, что аллотрансплантаты печени стали реиннервируемыми извне, при этом регенерирующие аксоны достигают ворот печени через 3 дня после трансплантации у крыс, и что процесс реиннервации внешней печени считается почти завершенным через 4 месяца.Более того, Philips et al. [19] также сообщили, что печень может подвергнуться резкой афферентной реиннервации после поддиафрагмальной ваготомии. Кроме того, сообщалось, что симпатические волокна отсутствовали в регенерирующих узелках в цирротической печени человека [14].
Автономная нервная система и функция печени
Избирательная печеночная ваготомия не нарушает предполагаемую петлю обратной связи между массой тела и кормлением [20]. Однако сообщалось, что ваготомия снижает потребление пищи, воды и массу тела после печеночной ваготомии только у 100-граммовых крыс, но не у 200- и 280-граммовых крыс [21, 22].Когда 100-граммовых животных с ваготомией на ветвях печени или ложными операциями помещали при трех различных комнатных температурах (12-17, 17-22, 22-27 ° C), снижение веса ваготомизированных животных коррелировало с самой низкой комнатной температурой. потребление пищи также уменьшалось в прямой зависимости от температуры [23]. Следовательно, механизм печеночного блуждающего нерва модулирует потребление пищи молодыми животными, и такой механизм может модулироваться температурой окружающей среды. Более того, чтобы дополнительно охарактеризовать возможное влияние печеночной ваготомии на прием пищи, Langhans et al.[24] предложили крысам диету с новым вкусом сразу после ваготомии по ветвям печени или фиктивной ваготомии и измерили потребление пищи, а также выбор диеты (диета с новым вкусом по сравнению с привычной диетой). Они обнаружили, что ваготомия по ветви печени и мнимая ваготомия имели разные отвращающие эффекты, что приводило к временным различиям в послеоперационном потреблении пищи, когда в начальном послеоперационном периоде предлагались диеты с новым и сильным вкусом. Следовательно, информация, передаваемая печеночной ветвью блуждающего нерва, может, по-видимому, привести к условной реакции на кормление.Это свидетельствует о более тонкой роли печени в контроле за приемом пищи, чем считалось ранее.
Хорошо известно, что 90% большинства волокон блуждающего нерва являются афферентными [25]. Сообщалось, что афферентные блуждающие нервы содержат чувствительные к глюкозе нервные волокна [26], чувствительные к аминокислотам нервные волокна [27], чувствительные к липидам нервные волокна [28] или осмочувствительные нервные волокна [29]. Что касается эфферентных нервных волокон, Niijima [30] зарегистрировал эфферентные разряды из нервных волокон, отсеченных от печеночной ветви блуждающего нерва у крысы.Был сделан вывод, что изменения скорости гликогенеза в печени, которые происходят в ответ на изменения концентрации глюкозы в крови, частично опосредованы блуждающей эфферентной иннервацией печени.
В соответствии с различной плотностью иннервации у разных видов, перфузия норадреналина из перфузированной печени во время стимуляции печеночного нерва была намного выше у морских свинок, чем у крыс [31]. Тем не менее, нервная стимуляция вызвала увеличение выхода глюкозы из печени крысы примерно в той же степени, что и из печени морской свинки [31].Эти наблюдения позволили предположить, что в печени крысы большинство гепатоцитов активируется не при прямом контакте с симпатическими нервами, а посредством косвенного механизма передачи сигнала. Одним из возможных механизмов является участие в межклеточной коммуникации через определенные каналы щелевых контактов, которые существуют между соседними гепатоцитами и позволяют проходить небольшим молекулам и ионам [32]. Таким образом, чтобы изучить возможную роль щелевых контактов между клетками печени в нервной регуляции метаболизма глюкозы в печени, Iwai et al.[33] исследовали влияние стимуляции печеночного нерва на метаболические и гемодинамические изменения в регенерирующей печени крыс. Они обнаружили, что нарушенные эффекты стимуляции симпатического нерва на метаболизм глюкозы, наблюдаемые при регенерирующей печени, не были связаны ни с уменьшенным высвобождением норадреналина, ни с истощением гликогена в печени, а скорее с временным сокращением щелевого соединения, которое способствует распространению сигнала нервного воздействия через межклеточная коммуникация в печени крысы.
Инсулин считается одним из гепатотрофных факторов [34], поскольку он оказывает прямое действие на органеллы, стимулирует синтез ДНК и белка [35], а его секреция, как известно, регулируется через ветвь блуждающего нерва печени [36].Однако сообщалось, что во время голодания уровень инсулина в плазме снижался после частичной гепатэктомии у поддиафрагмальных ваготомированных крыс и печеночных ваготомированных крыс, как и у крыс с ложной операцией [37]. Между тем, Trabelsi et al. [38] оценили влияние селективной печеночной ваготомии на инсулиновый ответ у крыс, голодавших в течение 24 часов, когда уровень глюкозы в крови поддерживался или не поддерживался постоянной инфузией глюкозы. Был сделан вывод, что снижение концентрации глюкозы в плазме во время голодания не полностью объясняет инсулинопенический ответ на голодание и что печень, хотя и является посредником блуждающего нерва, по-видимому, не вносит вклад в инсулинопению у крыс, голодавших в течение 24 часов.Более того, хорошо известно, что в ответ на инсулин, один из гормонов, печеночное инсулино-сенсибилизирующее вещество (HISS) высвобождается из печени, чтобы стимулировать поглощение глюкозы скелетными мышцами, но не печенью или кишечником. В соответствии с этим Lautt et al. [39] недавно сообщили, что прерывание парасимпатических нервов печени хирургической денервацией или атропином блокирует высвобождение HISS.
Что касается печеночных ферментов, показатели печени и почек, общий белок, глутаминовая пировиноградная трансаминаза (ГПТ), лактатдегидрогеназа, общий билирубин, общий холестерин, азот мочевины крови и креатинин не показали значительных различий между ваготомированными в печени и имитированными ваготомированными крысами. .Более того, поскольку ваготомия по ветвям печени не влияет на концентрацию альбумина, одного из белков, специально продуцируемых в печени, блуждающий нерв не должен играть роли в производстве белка в оставшейся печени. Между тем, сообщалось, что уровень щелочной фосфатазы (ЩФ) у крыс, подвергнутых ваготомии в печени, был значительно ниже, чем в контроле [40]. Reilly et al. [41] гистологически наблюдали, что холинергические нервы иннервируют желчные протоки, идущие вдоль сосудистой сети печени. Более того, электрическая стимуляция блуждающего нерва вызвала повышение внутрихоледохального давления, предполагая прямую связь между блуждающим нервом и секрецией желчи [42].Как правило, уровень ЩФ в сыворотке крови при заболеваниях печени повышается из-за застоя желчи. Следовательно, повышенная активность ЩФ может быть интерпретирована как результат застоя желчи, вызванного повышенным внутрихоледохальным давлением из-за стимуляции блуждающего нерва. Однако необходимы более подробные исследования точной взаимосвязи между блуждающим нервом и секрецией желчи.
Автономная нервная система и регенерация печени
Блуждающий нерв
В моделях на животных вес регенерирующей печени восстанавливается примерно до 80% от предоперационного веса через 72 часа после частичной гепатэктомии [43].Сообщается, что восстановление веса печени значительно ухудшается у поддиафрагмальных ваготомированных крыс (таблица 1) [37]. Это нарушение связано с уменьшением потребления пищи, поскольку не было разницы в весе печени между контрольными крысами и крысами, получавшими субдиафрагмальную ваготомию на парном вскармливании [44]. Поддиафрагмальная ваготомия также приводит к значительно большей потере массы тела, чем имитационная ваготомия. Увеличение содержания ДНК и белка в регенерирующей печени также подавляется поддиафрагмальной ваготомией.Более того, субдиафрагмальная ваготомия задерживает и подавляет скорость синтеза ДНК в печени после частичной гепатэктомии. В соответствии с этим, повышение активности печеночной аспартат-транскарбамоилазы и тимидинкиназы, ключевых ферментов в синтезе пиримидиновых нуклеотидов посредством de novo и спасательных путей, соответственно, во время регенерации печени, значительно подавляется и замедляется у поддиафрагмальных ваготомированных крыс. Начало синтеза ДНК, вызванное частичной гепатэктомией, также задерживается поддиафрагмальной ваготомией.
Таблица 1
Сравнение эффектов поддиафрагмальной ваготомии и печеночной ваготомии по сравнению с фиктивной ваготомией после частичной гепатэктомии
Печеночная ваготомия задерживает, но не подавляет увеличение скорости синтеза ДНК в печени и активность тимидинкиназы после частичной гепатэктомии (таблица 1) [45]. На время восстановления содержания ДНК в печени после частичной гепатэктомии печеночная ваготомия не влияет. Печеночная ваготомия не влияет на ежедневное потребление пищи или увеличение массы тела после частичной гепатэктомии.Разница между поддиафрагмальной ваготомией и печеночной ваготомией зависит от того факта, что блуждающий нерв иннервирует не только печень, но и многие органы [46], а поддиафрагмальная ваготомия, а не печеночная ваготомия, снижает потребление пищи и значительно задерживает опорожнение желудка [44, 47] .
Pietroletti et al. [48] исследовали взаимосвязь вегетативной нервной системы и двойного кровоснабжения для оптимального регенеративного ответа в остатках печени после резекции печени. Они обнаружили, что питание вегетативных нервов портальной триады играет, по крайней мере, важную разрешающую роль в регенерации печени.Следовательно, существует вероятность того, что печеночный блуждающий нерв влияет на гепатоциты посредством повреждения свободными радикалами, которое может быть вызвано ишемией из-за изменений сосудистого тонуса, вызванных блуждающим нервом. Однако у крыс, подвергнутых переносу через портакавал с целью увеличения кровотока в печени, меченный тритием тимидин был включен в ДНК печени в такой же степени, как и у контрольных крыс [49]. Более того, при исследовании острых изменений рассечение печеночной ветви чревного или блуждающего нерва не изменяло кровоток в печеночной артерии или воротной вене [40].Изменение кровоснабжения печени, связанное с перерезкой нерва, играет незначительную роль в регенерации печени. Следовательно, блуждающий нерв может напрямую и специально стимулировать регенерацию печени, хотя выяснение его механизма требует дальнейших исследований.
Симпатический нерв
Доказано, что симпатэктомия печеночной ветви не влияет на регенерацию печени [40]. Более того, Kato и Shimazu [37] сообщили, что двусторонняя обширная спланхникэктомия на поддиафрагмальном уровне не оказывает никакого влияния на регенерацию печени.Однако было высказано предположение, что адренергические агенты регулируют регенерацию печени [50]. Cruise et al. [51] также сообщили, что норадреналин стимулировал синтез ДНК в культивируемых гепатоцитах крысы через α 1 -адренергические рецепторы. Более того, Иваи и Симадзу [52] использовали слегка поврежденную, обработанную галактозамином изолированную печень крысы и обнаружили, что активация симпатических нервов печени и циркулирующих катехоламинов усиливает острое повреждение печени за счет воздействия на клетки печени, которое зависит от притока внеклеточного Ca 2+ .В 1960 году Калверт и Броуди [53] предположили, что четыреххлористый углерод (CCl 4 ) оказывает некротический эффект не за счет прямого воздействия на паренхиму печени, а за счет стойких симпатических выделений, приводящих к снижению кровотока в печени и клеточной гипоксии. Однако недавно было высказано предположение, что CCl 4 вызывает клеточное повреждение через свои метаболиты, которые образуются на стадии, зависимой от цитохрома P-450 [54]. Hsu [55] исследовал влияние симпатической нервной системы на повреждение печени, экспериментально вызванное CCl 4 у крыс со спонтанной гипертензией (SHR) и крыс с нормальным давлением Wistar-Kyoto (WKY).Было обнаружено, что у SHR было повышенное содержание катехоламинов в надпочечниках без какого-либо лечения, а гистохимия флуоресценции также выявила плотную адренергическую иннервацию в печени. Более того, SHR показал большую чувствительность к CCl 4 стимуляции симпатической нервной системы, чем WKY, что привело к снижению кровотока в печени в острой стадии и истощению катехоламинов в надпочечниках и снижению артериального давления в хронической стадии. Активность GPT в плазме была увеличена у обоих штаммов, но более значительно у SHR, чем у WKY.Гистологическое исследование печени в SHR показало установленный цирроз, тогда как в WKY был замечен только мостовой фиброз. Следовательно, патогенез повреждения печени, усиленный CCl 4 в SHR, объясняется усиленной реакцией симпатической нервной системы, которая высвобождает огромное количество катехоламина, что затем приводит к сужению сосудов и метаболическим изменениям, которые способствуют повреждению печени.
Что касается регенерации печени после частичной гепатэктомии, чтобы определить, играет ли симпатический нерв роль в регенерации печени после частичной гепатэктомии, Iwai et al.[56] измерили изменения содержания норадреналина в тканях и его обмена у крыс. Скорость фракционного оборота норадреналина временно снижалась в регенерирующей печени через 24–48 часов после частичной гепатэктомии и возвращалась к норме через 8–9 дней после операции; следовательно, симпатическая нервная активность печени подавлялась на ранней стадии регенерации. Однако Кнопп и др. [57] сообщили, что через 20 минут после частичной гепатэктомии уровень норадреналина в плазме увеличился, но через 1 час он снизился до базального уровня как у крыс с частичной гепатэктомией, так и у крыс с ложной операцией и оставался неизменным через 4 и 24 часа.Более того, уровни адреналина и кортикостерона в плазме также быстро увеличивались через 20 минут после частичной гепатэктомии или имитации операции [57]. Первый пик уровней катехоламинов и кортикостерона был результатом неспецифического стрессора, связанного с операцией. Затем через 4 ч уровень адреналина в плазме был выше, чем у ложнооперированных крыс, но через 24 ч уровень адреналина вернулся к базовым значениям [57]. Продолжительное повышение уровня адреналина, обнаруживаемое после частичной гепатэктомии, по-видимому, специфично для регенерации печени.
Ohtake [58] исследовал роль симпатической нервной системы брюшной полости в регулировании кровотока в воротной вене у анестезированных крыс с помощью ультразвукового объемного расходомера. Результаты показали, что симпатический нерв напрямую регулирует кровоток в воротной вене. Ни надлежащая окклюзия печеночной артерии, ни частичная гепатекомия не повлияли на ответ. У животных с частичной гепатэктомией стимуляция печеночной ветви не уменьшала кровоток в селезенке, но уменьшала кровоток в верхней брыжеечной вене и вызывала аналогичный ответ в кровотоке в воротной вене, даже когда поток верхней брыжеечной вены был прерван.Этот факт может быть связан с возможностью того, что изменения в портальном венозном потоке со стороны симпатической нервной системы могут повлиять на регенерацию печени. Однако Ohtake et al. [40] также сообщили, что рассечение симпатических нервов, которое приводит к увеличению кровотока в печени, не влияет на регенерацию печени.
Что касается иммунологии, хорошо известно, что атрофия тимуса всегда индуцируется через 24 часа после частичной гепатэктомии как реакция, связанная со стрессом. В соответствии с этим Minagawa et al.[59] предположили, что стимуляция симпатического нерва очень важна для индукции специфического паттерна иммунной системы, наблюдаемого после частичной гепатэктомии. Стимуляция симпатического нерва после частичной гепатэктомии приводит к последующей активации естественных клеток-киллеров, и эти естественные клетки-киллеры могут быть связаны с иммунологическим наблюдением во время регенерации гепатоцитов.
Также хорошо известно, что щадящие манипуляции с органами быстро вызывают нарушения в активации клеток Купфера [60].В соответствии с этим Schemmer et al. [60] недавно сообщили, что в этом вопросе участвуют как вегетативная нервная система, так и эндотоксин кишечного происхождения.
Вегетативная нервная система и апоптоз печени
Печень может точно регулировать свой рост и массу. Апоптоз — это тип гибели клеток, который служит для устранения избыточных или нежелательных клеток в процессе ремоделирования при регенерации печени, а также при эмбриональном развитии и заживлении ран [61]. Хирургическая резекция долей печени или потеря гепатоцитов, вызванная вирусным или химическим повреждением, запускает репликацию гепатоцитов, в то время как увеличенная масса печени корректируется апоптозом.Как уже упоминалось, норадреналин заметно усиливает стимуляцию пролиферации печени [51]. Однако сообщалось, что норадреналин предотвращал Fas-индуцированный апоптоз гепатоцитов через β 2 -адренергический рецептор [62]. Эти данные привели нас к предположению, что вегетативная нервная система может играть роль стимулятора роста клеток, подавляя апоптоз в регенерирующей печени. Более того, хотя было хорошо известно, что гепатотоксичность CCl 4 была более серьезной у SHR с симпатической гиперактивностью, чем у WKY с нормальной симпатической гиперактивностью [55], Hamasaki et al.[63] сообщили, что как острое, так и хроническое повреждение печени, вызванное CCl 4 , было усилено у SHR по сравнению с WKY. Индекс маркировки ядерного антигена пролиферирующих клеток (PCNA), показывающий количество регенерирующих гепатоцитов, соответствовал тяжести повреждения печени. Напротив, количество TdT-dUTP-меток по ник-концу (TUNEL) -положительных клеток не соответствовало тяжести повреждения печени. Таким образом, Hamasaki et al. [63] предположили, что норадреналин подавлял апоптоз в гепатоцитах, но не подавлял повреждение печени.
Плотность в печени β 2 -адренорецепторов мышей C57BL / 6 низкая, но у недавно описанных трансгенных мышей F28 намного выше [64]. Мыши F28 естественным образом защищены от моноклонального антитела хомячка против мышиного Fas-антигена, Jo2; Мыши F28 были устойчивы к индуцированному Jo2 апоптозу печени и смерти. Антагонист β-адренорецепторов пропранолол сенсибилизировал печень F28 к Jo2. У нормальных мышей кленбутерол, специфический агонист β 2 -адренерорецепторов, значительно снижал индуцированный Jo2 апоптоз печени и смерть; сальбутамол, другой селективный агонист β 2 -адренорецепторов, также снижает индуцированный Jo2 апоптоз и замедляет смерть, но с меньшей эффективностью, чем кленбутерол; а пропранолол блокировал защитный эффект кленбутерола.Это указывает на то, что уровень экспрессии функциональных β 2 -адренорецепторов модулирует Fas-регулируемый апоптоз печени и что этот апоптоз можно ингибировать in vivo, давая агонисты β 2 -адренергических рецепторов [62].
Центральная нервная система и регенерация печени и апоптоз
Гипоталамус играет жизненно важную роль в интеграции нейрогуморальной информации [65], и он обладает вегетативными центрами, связанными с внутренними органами через вегетативную нервную систему.Ядро латерального гипоталамуса (ЛГ) и вентромедиального гипоталамуса (ВМГ) были изучены на предмет их роли в интеграции нейрогуморальной информации [66]. Считается, что оба они реципрокно выполняют несколько регуляторных функций: пищевое поведение, вегетативная регуляция и регуляция метаболизма [65]. ЛГ является частью парасимпатической системы, а ВМГ относится к симпатической системе [67, 68] (рис. 2). Сообщается, что поражения в LH вызывают увеличение активности симпатического нерва, тогда как поражения в VMH вызывают усиление активности блуждающего нерва [23, 69].Как описано выше, как симпатическая, так и парасимпатическая нервная система являются важными модуляторами регуляторов печени [45, 50, 70]. Iwai и Shimazu [71] изучали влияние гипоталамической стимуляции на экспериментальное повреждение печени, вызванное CCl 4 или диметилнитрозамином, у крыс, измеряя активность GPT в плазме как показатель острого повреждения печени. Электрическая стимуляция VMH у крыс, получавших CCl 4 , вызвала заметное увеличение активности GPT в плазме, сопровождающееся значительным снижением активности GPT в печени, хотя обработка CCl 4 сама по себе не оказывала значительного влияния на активность GPT в плазме.Подобный эффект стимуляции VMH на активность GPT в плазме наблюдался у крыс, получавших диметилнитрозамин, другое гепатотоксичное химическое вещество. Не наблюдалось такого преувеличенного эффекта стимуляции VMH на активность GPT в плазме после стимуляции LH. Хирургическая симпатическая денервация печени значительно подавляла увеличение активности GPT в плазме после инъекции CCl 4 и стимуляции VMH. Измерение регионального кровотока показало, что стимуляция VMH не вызвала значительного изменения кровотока в печени.Следовательно, VMH участвовал в развитии химически индуцированного поражения печени через активацию симпатических печеночных нервов, возможно, влияя на метаболизм печени, а не на кровоток в печень. Более того, Kiba et al. [72, 73, 74] ранее сообщали, что активность блуждающего нерва, вызванная поражениями VMH, вызывает увеличение пролиферации клеток печени. Также сообщалось, что поражения VMH способствовали регенерации печени после частичной гепатэктомии [75]. Хотя, как упоминалось выше, предыдущие исследования также указали на реципрокность восстановления вегетативной функции между VMH и LH [69], Kiba et al.[76] сообщили, что поражения ЛГ способствовали регенерации печени. Было показано, что ЛГ напрямую и сильно проецируется на дорсальное моторное ядро блуждающего нерва в продолговатом мозге [65] (рис. 2) и является частью парасимпатической нервной системы [67]. Iwai и Shimazu [56] измерили изменения содержания норадренергических рецепторов в печени и его метаболизм после частичной гепатэктомии, чтобы определить, играет ли симпатический нерв роль в регенерации печени; они обнаружили, что активность симпатического нерва печени подавлялась рано (24–48 ч) после частичной гепатэктомии.Напротив, увеличение частоты возбуждения симпатической нервной системы произошло через 24 часа после поражения ЛГ [77]. Поэтому было высказано предположение, что поражения ЛГ могут предотвращать подавление активности симпатических нервов вскоре после частичной гепатэктомии, тем самым облегчая синтез ДНК в печени.
Рис. 2
Взаимосвязь между вегетативной нервной системой печени и центральной нервной системой. DMV = nucleus dorsalis nervi vagi; LH = боковой гипоталамус; NA = неоднозначное ядро; VMH = вентромедиальный гипоталамус.
Центральные нейропептиды играют важную роль во многих случаях физиологической и патофизиологической регуляции, опосредованной вегетативной нервной системой. Что касается гепатобилиарной системы, несколько нейропептидов действуют в головном мозге, регулируя секрецию желчи, кровоток в печени и разрастание печени. Сообщается, что стрессоры и активация симпатических нервов усугубляют экспериментальное повреждение печени [55, 78, 79]. Известно, что некоторые стрессоры стимулируют синтез кортикотропин-рилизинг-фактора (CRF) в центральной нервной системе и вызывают активацию симпатических нервов на животных моделях [80, 81, 82].Yokohama et al. [83] исследовали влияние интрацистернального CRF на вызванное CCl 4 острое повреждение печени у крыс. Интракистернальная инъекция CRF дозозависимо усиливала повышение уровня GPT в сыворотке, индуцированное CCl 4 . Повышение уровней GPT, ALP и общего билирубина в сыворотке с помощью CCl 4 также усиливалось интрацистернальной инъекцией CRF. Было обнаружено, что CRF действует в головном мозге, обостряя острое повреждение печени через симпатико-норадренергические пути. Кроме того, Йонеда и др.[84] изучали влияние тиреотропин-рилизинг-гормона (TRH) на синтез ДНК в печени у крыс. TRH распространяется по центральной нервной системе и действует как нейромедиатор, регулирующий функции желудка через блуждающий нерв. Было обнаружено, что TRH действует в центральной нервной системе, стимулируя синтез ДНК в печени посредством вагусных и холинергических механизмов, и что TRH может быть химическим посредником, участвующим в регуляции пролиферации печени в мозге.
-аминомасляная кислота (ГАМК) является мощным тормозным нейромедиатором со свойствами регуляции роста.При молниеносной печеночной недостаточности, состоянии, при котором регенерация печени может быть нарушена, системные концентрации ГАМК в сыворотке заметно повышаются. Minuk et al. [85] определили, влияет ли повышенное количество циркулирующей ГАМК на регенеративную активность печени. Их результаты показали, что повышенные концентрации ГАМК в сыворотке препятствовали гипертрофическому компоненту регенерации печени после частичной гепатэктомии у крыс. Недавно Biju et al. [86] сообщили, что ГАМКергическая активность способствует поддержанию гепатоцитов в состоянии покоя.Более того, Biju et al. [86] исследовали ГАМКергические изменения в гипоталамусе и уровни норадреналина в плазме при компенсаторной гиперплазии после частичной гепатэктомии, прямой гиперплазии, индуцированной нитратом свинца, и индуцированной N-нитрозодиэтиламином неоплазии в печени. Результаты показали, что пролиферация клеток печени влияет на ГАМКергическую нейротрансмиссию гипоталамуса, и эти изменения регулируют пролиферацию печени посредством симпатической стимуляции.
Что касается апоптоза печени, Kiba et al.[87] недавно исследовали, опосредует ли система лиганд Fas (APO-1 / CD95) / Fas апоптоз у крыс с поражениями VMH. Результаты показали, что возбуждение блуждающего нерва после поражения VMH может стимулировать апоптоз, опосредованный системой Fas / Fas-лиганд, через холинергическую систему в печени крысы. Однако Fujimoto et al. [88] показали, что апоптоз слизистой оболочки кишечника уменьшился у крыс с поражением VMH. Следовательно, могут потребоваться дальнейшие исследования для определения механизмов, с помощью которых поражения VMH модулируют апоптоз.
Выводы
Текущая литература указывает, что вегетативная нервная система регулирует регенерацию печени и апоптоз. Более того, центральная нервная система модулирует их через вегетативную нервную систему. В последнее время растет интерес к взаимосвязи между заболеванием печени и вегетативной нервной системой (рис. 3). Что касается этого вопроса, будущие исследования должны описать более полный механизм.
Рис. 3
Схема вегетативной нервной системы печени и заболевания печени.
Благодарность
Эта работа была частично поддержана грантом 09670562 Министерства образования Японии.
Список литературы
- Berthoud HR, Neuhuber WL: Функциональная и химическая анатомия афферентной системы блуждающего нерва.Auton Neurosci 2000; 85: 1–17.
- Фаусто Н .: Регенерация печени. J Hepatol 2000; 32 (приложение 1): 19–31.
- Юнгерманн К., Штумпель Ф: Роль печеночных, внутрипеченочных и гепатоэнтеральных нервов в регуляции углеводного обмена и гемодинамики печени и кишечника.Гепатогастроэнтерология 1999; 46 (приложение 2): 1414–1417.
- Rangari M, Sinha S, Kapoor D, Mohan JC, Sarin SK: Распространенность вегетативной дисфункции при цирротической и нецирротической портальной гипертензии. Am J Gastroenterol 2002; 97: 707–713.
- Hendrickse MT, Thuluvath PJ, Triger DR: Естественная история вегетативной невропатии при хроническом заболевании печени.Ланцет 1992; 339: 1462–1464.
- Диллон Дж. Ф., Плеврис Дж. Н., Нолан Дж., Юинг Д. Д., Нейлсон Дж. М., Бушье И. А., Хейс ПК: вегетативная функция при циррозе печени, оцененная с помощью тестов сердечно-сосудистого рефлекса и 24-часовой вариабельности ритма течки. Am J Gastroenterol 1994; 89: 1544–1547.
- Миядзима Х, Номура М., Мугурума Н., Окахиса Т., Шибата Х, Окамура С., Хонда Х, Симидзу I, Харада М., Сайто К., Накая И., Ито С. Взаимосвязь между моторикой желудка, вегетативной активностью и портальной гемодинамикой у пациентов с цирроз печени.J Gastroenterol Hepatol 2001; 16: 647–659.
- Pozzi M, Grassi G, Redaelli E, Dell’oro R, Ratti L, Redaelli A, Foglia G, Di Lelio A, Mancia G: Паттерны регионального симпатического нервного движения при преасцитическом и асцитическом циррозе. Гепатология 2001; 34: 1113–1118.
- Нобин А., Баумгартен Х.Г., Фальк Б., Ингеманссон С., Могхимзаде Э., Розенгрен Э., Фаусто Н.: Организация симпатической иннервации в ткани печени обезьяны и человека.Cell Tissue Res 1978; 195: 371–380.
- Carobi C, Magni F: Афферентная иннервация печени: исследование пероксидазы хрена на крысах. Neurosci Lett 1981; 23: 269–274.
- Rogers RC, Hermann GE: Центральные соединения печеночной ветви блуждающего нерва: гистохимическое исследование пероксидазы хрена.J Auton Nerv Syst 1983; 7: 165–174.
- Акиёси Х, Гонда Т., Терада Т: сравнительное гистохимическое и иммуногистохимическое исследование аминергической, холинергической и пептидергической иннервации в печени крыс, хомяков, морских свинок, собак и человека. Печень 1998; 18: 352–359.
- Berthoud HR, Kressel M, Neuhuber WL: антероградное исследование иннервации блуждающего нерва печени, воротной вены и желчевыводящей системы крыс.Анат Эмбриол (Берл) 1992; 186: 431–442.
- Фукуда Ю., Имото М., Кояма Ю., Миядзава Ю., Хаякава Т.: Демонстрация иммунореактивных нервных волокон в печени. J Int Med Res 1996; 24: 466–472.
- Metz W, Forssmann WG: Связь клеток печени.Ланкастер, MTP Press, 1980, стр 121–127.
- Carobi C: Афферентная иннервация блуждающего нерва в регенерированной печени крысы. Experientia1990; 46: 50–53.
- Tadokoro F: Иммуногистохимическое исследование регенерации нервных волокон печени крысы после хирургического вмешательства (на японском языке).Acta Hepatol Jap 1994; 35: 29–38.
- Takahashi T, Kakita A, Sakamoto I., Takahashi Y, Hayashi K, Tadokoro F, Yamashita S: Иммуногистохимическое и электронно-микроскопическое исследование реиннервации внешней печени после ортотопической трансплантации печени у крыс. Печень 2001; 21: 300–308.
- Филлипс Р.Дж., Бароновски Е.А., Паули Т.Л.: Регенерирующие афференты блуждающего нерва реиннервируют гладкие мышцы желудочно-кишечного тракта крысы. J Comp Neuro1 2000; 421: 325–346.
- Johnston DG, Johnson GA, Alberti KG, Millward-Sadler GH, Mitchell J, Wright R: Регенерация печени и метаболизм после частичной гепатэктомии у нормальных крыс: эффекты инсулиновой терапии.Eur J Clin Invest 1986; 16: 384–390.
- Сакагути Т., Ямадзаки М., Тамаки М., Ниидзима А: Изменения в приеме пищи после печеночной ваготомии на стадии развития у крыс. Neurosci Lett 1985; 61: 317–320.
- Сакагути Т., Ямадзаки М.: Изменения в потреблении воды после печеночной ваготомии у молодых крыс.J Auton Nerv Syst 1986; 17: 243–246.
- Сакагути Т., Тамаки М.: На потерю массы тела молодых крыс, вызванную ваготомией по ветви печени, влияет температура окружающей среды. Physiol Behav 1988; 43: 673–675.
- Langhans W, Kunz U, Scharrer E: Печеночная ваготомия увеличивает потребление диеты с новым вкусом, предлагаемой сразу после операции.Physiol Behav 1989; 46: 671–678.
- Савченко П.Е., Фридман М.И.: Сенсорные функции печени. Am J Physiol 1979; 236: R5 – R20.
- Сакагути Т., Иванага М.: Влияние аномеров глюкозы D на афферентные выделения в печеночном блуждающем нерве.Experientia 1982; 38: 475–476.
- Torii K, Niijima A: Влияние лизина на афферентную активность печеночной ветви блуждающего нерва у нормальных крыс и крыс с дефицитом лизина L . Physiol Behav 2001; 72: 685–690.
- Randich A, Spraggins DS, Cox JE, Meller ST, Kelm GR: инфузии липидов в тощей кишке или воротной вене увеличивают афферентную активность печеночного блуждающего нерва.Нейроотчет 2001; 12: 3101–3105.
- Нидзима А: Афферентные выделения осморецепторов в печени морской свинки. Питание 1996; 12: 392–393.
- Ниидзима А. Уровни глюкозы в крови регулируют эфферентную активность блуждающего нерва в печени крысы.J. Physiol 1985; 364: 105–112.
- Jungermann K, Gardemann A, Beuers U, Balle C, Sannemann J, Beckh K, Hartmann H: Регулирование метаболизма печени печеночными нервами. Adv Enzyme Regul 1987; 26: 63–88.
- Лёвенштейн WR: Межклеточная связь и контроль роста.Biochim Biophys Acta 1979; 560: 1–65.
- Иваи М., Мияшита Т., Симадзу Т.: Ингибирование выработки глюкозы во время стимуляции печеночного нерва в регенерирующей печени крысы, перфузируемой in situ. Возможно вовлечение щелевых контактов в действие симпатических нервов. Eur J Biochem 1991; 200: 69–74.
- Лефферт Х.Л., Кох К.С., Моран Т., Рубальцава Б: Гормональный контроль регенерации печени крыс. Гастроэнтерология 1979; 76: 1470–1482.
- Goldfine ID: нужен ли инсулину второй мессенджер? Диабет 1977; 26: 148–155.
- Yamazaki M, Sakaguchi T: Функциональное распределение панкреатического блуждающего нерва в секреции инсулина, вызванной портальной инфузией глюкозы D- . Brain Res 1989; 484: 357–360.
- Като Х., Симадзу Т: Влияние вегетативной денервации на синтез ДНК во время регенерации печени после частичной гепатэктомии.Eur J Biochem 1983; 134: 473–478.
- Трабелси Ф, Хели Р., Лавуа Дж. М.: Влияние печеночной ваготомии на уровни инсулина в плазме во время голодания у крыс. Physiol Behav 1995; 58: 1111–1115.
- Lautt WW, Macedo MP, Sadri P, Takayama S, Duarte Ramos F, Legare DJ: Парасимпатический контроль печени (HISS) за чувствительностью к инсулину, определяемый кормлением и голоданием.Am J Physiol 2001; 281: G29 – G36.
- Отаке М., Сакагути Т., Ёсида К., Муто Т. Ваготомия по ветвям печени может подавить регенерацию печени у крыс с частичной гепатэктомией. HPB Surg 1993; 6: 277–286.
- Reilly FD, McCuskey PA, McCuskey RS, Kato H, Shimazu T: Внутрипеченочное распределение нервов у крысы.Anat Rec 1978; 191: 55–67.
- Мадрид JA, Салидо GM, Мартинес де Виктория E: Влияние антимускаринового агента пирензепина на секрецию желчевыводящих путей у собак in vivo в ответ на различные раздражители. Physiol Bohemoslov 1988; 37: 67–77.
- Kountouras J, Boura P, Lygidakis NJ: Регенерация печени после частичной гепатэктомии.Гепатогастроэнтерология 2001; 48: 556–562.
- Горц Л., Бьоркман А.С., Андерссон Х., Краль Дж. Г.: ваготомия туловища снижает потребление пищи и жидкости у человека. Physiol Behav 1990; 48: 779–781.
- Танака К., Окава С., Нишино Т., Нидзима А., Иноуэ С. Роль печеночной ветви блуждающего нерва в регенерации печени у крыс.Am J Physiol 1987; 253: G439 – G444.
- Kraly FS, Jerome C, Smith GP: Специфические послеоперационные синдромы после тотальных и выборочных ваготомий у крыс. Аппетит 1986; 7: 1–17.
- Houghton AD, Liepins P, Clarke SM, Mason RC: Влияние резекции желудка, отклонения Roux-en-Y и ваготомии на опорожнение желудка у крысы.Br J Surg 1994; 81: 75–80.
- Pietroletti R, Chamuleau RA, Speranza V, Lygidakis NJ: Иммуноцитохимическое исследование печеночной иннервации у крыс после частичной гепатэктомии. Histochem J 1987; 19: 327–332.
- Blumgart LH: Атрофия, гипертрофия и регенеративная гиперплазия печени у крыс: значение кровотока; in Porter R, Whelan J (eds): Ciba Found Symp 55 (NS): Hepatotrophic Factors.Амстердам, Elsevier Excerpta Medica, 1978, стр. 181–215.
- Морли К.Г., Ройз В.Л.: Адренергические агенты как возможные регуляторы регенерации печени. Int J Biochem 1981; 13: 969–973.
- Cruise JL, Knechtle SJ, Bollinger RR, Kuhn C, Michalopoulos G: Альфа-1-адренергические эффекты и регенерация печени.Гепатология 1987; 7: 1189–1194.
- Иваи М., Симадзу Т.: Преувеличение острого повреждения печени симпатическими нервами печени и циркулирующими катехоламинами в перфузированной печени крыс, получавших D- галактозамин. Гепатология 1996; 23: 524–529.
- Calvert DN, Brody TM: Роль симпатической нервной системы в гепатотоксичности CC14.Am J Physiol 1960; 198: 669–676.
- Berger ML, Bhatt H, Combes B, Estabrook RW: CC14-индуцированная токсичность в изолированных гепатоцитах: важность прямого повреждения растворителем. Гепатология 1986; 6: 36–45.
- Hsu CT: роль симпатической нервной системы в развитии цирроза печени, вызванного четыреххлористым углеродом, с использованием эссенциального гипертонического животного (SHR).J Auton Nerv Syst 1992; 37: 163–173.
- Иваи М., Симадзу Т.: Изменение активности симпатических нервов во время регенерации печени у крыс после частичной гепатэктомии. J Auton Nerv Syst 1992; 41: 209–214.
- Кнопп Дж., Джезова Д., Руснак М., Яроскакова И., Фаркас Р., Кветнанский Р.: Изменения уровней катехоламинов и кортикостерона в плазме и экспрессии генов ключевых ферментов биосинтеза катехоламинов у частично гепатэктомированных крыс.Endocr Regul 1999; 33: 145–153.
- Отаке М: роль симпатической нервной системы брюшной полости в регулировании кровотока в воротной вене и его функциональном распределении. Surg Today 1992; 22: 128–136.
- Minagawa M, Oya H, Yamamoto S, Shimizu T, Bannai M, Kawamura H, Hatakeyama K, Abo T: Интенсивное распространение естественных Т-клеток-киллеров на ранней фазе регенерации гепатоцитов после частичной гепатэктомии у мышей и его связь с активацией симпатического нерва .Гепатология 2000; 31: 907–915.
- Schemmer P, Enomoto N, Bradford BU, Bunzendahl H, Raleigh JA, Thurman RG: Автономная нервная система и эндотоксин кишечного происхождения: участие в активации клеток Купфера после манипуляции с органом in situ. Мировой журнал J Surg 2001; 25: 399–406.
- Локшин Р.А., Закери З.Ф .: Запрограммированная смерть клеток: новые мысли и актуальность для старения.Дж. Геронтол 1990; 45: B135 – B140.
- Андре С, Кутон Д., Гастон Дж., Эрраджи Л., Рениа Л., Варле П., Бриан П., Гийе Дж. Г.: селективный агонист бета-2-адренергических рецепторов кленбутерол предотвращает индуцированный Fas апоптоз печени и смерть мышей. Am J Physiol 1999; 276: G647 – G654.
- Hamasaki K, Nakashima M, Naito S, Akiyama Y, Ohtsuru A, Hamanaka Y, Hsu CT, Ito M, Sekine I. Симпатическая нервная система способствует индуцированному тетрахлорметаном циррозу печени у крыс, подавляя апоптоз и увеличивая кинетику роста регенерирующих гепатоциты.J Gastroenterol 2001; 36: 111–120.
- Андре С., Эрраджи Л., Гастон Дж., Гримбер Дж., Бриан П., Гийе Дж. Г.: Трансгенные мыши, несущие человеческий ген β 2 -адренергических рецепторов со своим собственным промотором, сверхэкспрессируют β 2 -адренергические рецепторы в печени. Eur J Biochem 1996; 241: 417–424.
- Oomura Y, Yoshimatsu H: Нейронная сеть системы мониторинга глюкозы. J Auton Nerv Syst 1984; 10: 359–372.
- Окамото К., Ямори Ю., Осима А., Танака Т.: Развитие субстратов у крыс со спонтанной гипертонией: генеалогия, изоферменты и эффект гиперхолестеринемической диеты.Jpn Circ J 1972; 36: 461–470.
- Ban T: волоконно-оптические связи в гипоталамусе и некоторые вегетативные функции. Pharmacol Biochem Behav 1975; 3 (приложение 1): 3–13.
- Нидзима А: Нервная регуляция обмена веществ.Прог Нейробиол 1989; 33: 135–147.
- Yoshimatsu H, Niijima A, Oomura Y, Katafuchi T: Боковое и вентромедиальное влияние гипоталамуса на активность вегетативного нерва печени у крыс. Brain Res Bull 1988; 21: 239–244.
- Ламар C-младший, Holloway LS Jr: Влияние ваготомии на регенерацию печени у крыс.Acta Hepatogastroenterol (Stuttg) 1977; 24: 7–10.
- Иваи М., Симадзу Т.: Влияние вентромедиальной и латеральной стимуляции гипоталамуса на химически вызванное повреждение печени у крыс. Life Sci 1988; 42: 1833–1840.
- Киба Т., Танака К., Иноуэ С., Эндо О., Такамура Ю.: Сравнение содержания ДНК висцеральных органов у крыс с вентромедиальными поражениями гипоталамуса и диетой с высоким содержанием жиров.Neurosci Lett 1991; 126: 127–130.
- Киба Т., Танака К., Эндо О., Иноуэ С. Роль блуждающего нерва в повышенном синтезе ДНК после вентромедиальных поражений гипоталамуса в печени крыс. Am J Physiol 1992; 262: G483 – G487.
- Киба Т., Танака К., Нумата К., Сайто С., Секихара Х: пролиферация гепатоцитов у крыс после вентромедиальных поражений гипоталамуса: модели иммунореактивности ядерного антигена пролиферирующих клеток.Дж. Гастроэнтерол 1998; 33: 523–528.
- Киба Т., Танака К., Нумата К., Хосино М., Иноуэ С. Облегчение регенерации печени после частичной гепатэктомии с помощью вентромедиальных поражений гипоталамуса у крыс. Pflügers Arch 1994; 428: 26–29.
- Киба Т., Танака К., Иноуэ С. Боковые поражения гипоталамуса способствуют регенерации печени после частичной гепатэктомии у крыс.Pflügers Arch 1995; 430: 666–671.
- Сакагути Т., Такахаши М., Брей Г.А.: Боковой гипоталамус и симпатическая скорость возбуждения. Am J Physiol 1988; 255: R507 – R512.
- Фукудо С., Судзуки Дж., Танака Ю., Ивахаши С., Номура Т.: Влияние стресса на алкогольное поражение печени: гистопатологическое исследование.J Psychosom Res 1989; 33: 515–521.
- Hsu CT, Schichijo K, Ito M, Sekine I. Влияние химической симпатэктомии на острое повреждение печени, вызванное четыреххлористым углеродом у спонтанно гипертонических крыс. J Auton Nerv Syst 1993; 43: 91–96.
- Калин Н.Х., Такахаши Л.К., Чен Ф.Л.: Сдерживающий стресс увеличивает содержание мРНК кортикотропин-рилизинг-гормона в миндалине и паравентрикулярном ядре.Brain Res 1994; 656: 182–186.
- Monnikes H, Raybould HE, Schmidt B, Tache Y: CRF в паравентрикулярном ядре гипоталамуса стимулирует двигательную активность толстой кишки у голодных крыс. Пептиды 1993; 14: 743–747.
- Monnikes H, Schmidt BG, Tebbe J, Bauer C, Tache Y: Микроинфузия кортикотропин-рилизинг-фактора в ядра голубого / подреберного пятна стимулирует моторную функцию толстой кишки у крыс.Brain Res 1994; 644: 101–108.
- Иокогама С., Йонеда М., Накамура К., Макино I. Влияние центрального высвобождающего кортикотропина фактора на острое повреждение печени у крыс, вызванное тетрахлорметаном. Am J Physiol 1999; 276: G622 – G628.
- Йонеда М., Тамори К., Сато И., Йокогама С., Накамура К., Коно Т., Макино I. Центральный тиреотропин-высвобождающий гормон стимулирует синтез ДНК в печени у крыс.Гепатология 1997; 26: 1203–1208.
- Минук Г.Ю., Готье Т.: Влияние гамма-аминомасляной кислоты на регенеративную активность печени после частичной гепатэктомии у крыс. Гастроэнтерология 1993; 104: 217–221.
- Biju MP, Pyroja S, Rajeshkumar NV, Paulose CS: Функциональная регуляция гипоталамического рецептора ГАМК и пролиферация клеток печени.Mol Cell Biochem 2001; 216: 65–70.
- Киба Т., Сайто С., Нумата К., Кон И., Мизутани Т., Секихара Х: Экспрессия апоптоза на печени крысы гиперактивностью блуждающего нерва после вентромедиального поражения гипоталамуса. Am J Physiol 2001; 280: G958 – G967.
- Фудзимото К., Ивакири Р., Утсуми Х., Кодзима М., Ишибаши С., Ву Б., Саката Х., Нода Т.: Влияние центральной нервной системы на рост слизистой оболочки и апоптоз в тонкой кишке.Пищеварение 2001; 63 (приложение 1): 108–111.
Автор Контакты
Такаёси Киба, доктор медицинских наук
Третье отделение внутренней медицины
Городской университет Йокогамы, медицинский факультет
3-9 Фукуура, Канадзава-ку, Йокогама 236-0004 (Япония)
Тел.+81 45 5741011, факс +81 45 5741075, электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 15 февраля 2002 г.
Принято: 6 июня 2002 г.
Опубликовано в Интернете: 20 ноября 2002 г.
Дата выпуска: 2002
Количество страниц для печати: 10
Количество рисунков: 3
Количество столов: 1
ISSN: 0012-2823 (печатный)
eISSN: 1421-9867 (онлайн)
Для дополнительной информации: https: // www.karger.com/DIG
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или какой-либо системой хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Функция вегетативной нервной системы — обзор
6.09.3.2.2 Биологическая обратная связь
Биологическая обратная связь — это регулирование функций вегетативной нервной системы, таких как артериальное давление, частота сердечных сокращений и потоотделение, субъектом, который постоянно контролирует эту функцию и получает вознаграждение (обычно просто осознанием своего успеха) за изменение этой деятельности в желаемом направлении. Обратная связь обычно передается либо звуковой высотой непрерывного тона, либо с помощью визуального отображения.
Идея о том, что тренированный человек может выборочно влиять на активность определенной вегетативной функции, особенно в направлении уменьшения возбуждения, существует уже давно и традиционно ассоциируется с восточными практиками, такими как медитация и йога. .Утверждается, что практикующие эти формы медитации обладают способностью в чрезвычайной степени ослаблять свои жизненно важные функции (например, частоту сердечных сокращений). Напротив, западный научный интерес к вегетативному контролю появился недавно и был стимулирован работой Миллера и его коллег по оперантному обусловливанию вегетативных реакций у животных, особенно у кураризованных крыс. Это исследование было значительным с теоретической точки зрения, потому что результаты показали, что вегетативные и висцеральные реакции, которые до сих пор считались поддающимися изменению только классическим условием, могут быть изменены положительным подкреплением в рамках инструментальной парадигмы или оперантно-обусловливающей парадигмы.Примерно в то же время также проявился интерес (Камия, 1969) к оперантному кондиционированию альфа-ритма ЭЭГ (как средству достижения измененных состояний сознания) и к изменениям проводимости кожи (Шапиро, Крайдер и Турский, 1964). и частота сердечных сокращений (Engel & Hansen, 1966). Однако эти исследования на людях подверглись критике со стороны Каткина и Мюррея (1968) за отсутствие контроля над опосредованными реакциями, такими как дыхание.
Несмотря на множество проблем, возникших при воспроизведении некоторых из вышеупомянутых лабораторных работ на животных, он оказался очень влиятельным, и с тех пор был исследован широкий спектр клинических применений, которые были сосредоточены в основном на двух типах проблем.Во-первых, тревожные и стрессовые расстройства, при которых целью биологической обратной связи является снижение общего уровня возбуждения; и, во-вторых, расстройства, проявляющиеся в виде соматических проблем (например, боль, головные боли напряжения и синдром раздраженного кишечника), которые могут быть спровоцированы или усугублены чрезмерным возбуждением, и где опять же биологическая обратная связь направлена либо на общее расслабление, либо более конкретно на пострадавшего. орган или функция для достижения саморегуляции.
Методы биологической обратной связи, связанные с общим снижением возбуждения, с самого начала включали обратную связь ЭЭГ с альфа-ритмом (Budzynski & Stoyva, 1973) и другие методы, такие как электродермальная (кожная проводимость) обратная связь (обычно от руки) и обратная связь по поверхностной ЭМГ, например, от лобной мышцы или в сочетании.Последние методы в настоящее время используются более широко и могут также использоваться для усиления систематической in vitro или in vivo десенсибилизации, обеспечивая более тщательный мониторинг фазы возврата к релаксации и тем самым помогая пациентам достичь этого (Стойва и Будзински , 1993).
Процедурно лечение с помощью биологической обратной связи начинается с оценки проблемы пациента и объяснения причин использования биологической обратной связи. Начальные тренировки с терапевтом позволяют пациенту лучше адаптироваться к познаниям и телесным событиям, которые связаны с усилением возбуждения.Сообщается, что этот тренинг является продуктивным в установлении вызывающих тревогу познаний в случае генерализованной тревоги (Budzynski & Stoyva, 1973). За этим этапом следует ежедневная домашняя практика (несколько коротких сеансов) до тех пор, пока не будет достигнут целевой ответ, и пациент не будет отлучен от устройства биологической обратной связи. Опять же, следует отметить, что биологическая обратная связь часто сочетается в лечении с другими методами саморелаксации, такими как аутогенная тренировка или прогрессивная релаксация (Lehrer et al., 1993).
Вегетативная нервная система при септическом шоке и ее роль в качестве будущей терапевтической мишени: повествовательный обзор | Annals of Intensive Care
Rhodes A, Evans LE, Alhazzani W., Levy MM, Antonelli M, Ferrer R, et al. Пережив кампанию сепсиса. Crit Care Med. 2017; 45: 486–552.
PubMed Статья PubMed Central Google ученый
Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al.Определения сепсиса и органной недостаточности и руководящие принципы использования инновационных методов лечения сепсиса. Грудь. 1992; 101: 1644–55.
CAS PubMed Статья PubMed Central Google ученый
Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Ранняя целенаправленная терапия в лечении тяжелого сепсиса и септического шока. N Engl J Med. 2001; 345: 1368–77.
CAS PubMed Статья PubMed Central Google ученый
Деллинджер Р.П., Леви М.М., Родос А., Аннан Д., Герлах Х., Опал С.М. и др. Кампания по выживанию после сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2012 г. Crit Care Med. 2013; 41: 580–637.
PubMed Статья PubMed Central Google ученый
Радаэлли А., Кастильони П., Серрито М.Г., Де Карлини С., Сориано Ф., Ди Риенцо М. и др. Инфузия липополисахаридного токсина Escherichia coli крысам вызывает раннее и серьезное нарушение функции барорефлекса при отсутствии изменений артериального давления.Шок. 2013; 39: 204–9.
CAS PubMed Статья PubMed Central Google ученый
Penn AH, Schmid-Schönbein GW. Тяжелая кишечная ишемия может вызвать сердечно-сосудистый коллапс и внезапную смерть через парасимпатический механизм. Шок. 2011; 36: 251–62.
CAS PubMed PubMed Central Статья Google ученый
Schmidt H, Müller-Werdan U, Hoffmann T., Francis DP, Piepoli MF, Rauchhaus M, et al.Вегетативная дисфункция позволяет прогнозировать летальность у пациентов с синдромом полиорганной недостаточности разных возрастных групп *. Crit Care Med. 2005; 33: 1994–2002.
PubMed Статья PubMed Central Google ученый
Pancoto JAT, Corrêa PBF, Oliveira-Pelegrin GR, Rocha MJA. Вегетативная дисфункция при экспериментальном сепсисе, вызванном перевязкой слепой кишки и пункцией. Auton Neurosci. 2008. 138: 57–63.
PubMed Статья PubMed Central Google ученый
Ши К-И, Шен Ф-М, Лю А-Дж, Чу З-Икс, Цао И-Л, Су Д-Ф. Время выживания после перевязки слепой кишки и пункции у денервированных синоаортальных крыс. J Cardiovasc Pharmacol. 2007; 50: 162–7.
CAS PubMed Статья PubMed Central Google ученый
Аннан Д., Трабольд Ф., Шаршар Т., Джаррин И., Блан А.С., Рафаэль Дж.С. и др. Несоответствующая симпатическая активация в начале септического шока: подход спектрального анализа. Am J Respir Crit Care Med.1999; 160: 458–65.
CAS PubMed Статья PubMed Central Google ученый
Пьеполи М., Гаррард С.С., Контояннис Д.А., Бернарди Л. Автономный контроль сердца и периферических сосудов при септическом шоке у человека. Intensive Care Med. 1995; 21: 112–9.
CAS PubMed Статья PubMed Central Google ученый
Корах М., Шаршар Т., Джаррин И., Фуйо Дж.П., Рафаэль Дж.К., Гайдос П. и др.Вариабельность сердца у взрослых в критическом состоянии: влияние сепсиса. Crit Care Med. 2001; 29: 1380–5.
CAS PubMed Статья PubMed Central Google ученый
Де Паскуале М., Мосс Т.Дж., Серутти С., Калланд Дж. Ф., Лейк, Делавэр, Мурман Дж. Р. и др. Модели прогнозирования кровотечений в хирургической интенсивной терапии: данные прикроватного мониторинга добавляют информацию к лабораторным значениям. IEEE J Biomed Heal Informatics IEEE. 2017; 21: 1703–10.
Артикул Google ученый
Мурман Дж. Р., Делос Дж. Б., Флауэр А. А., Цао Х., Ковачев Б. П., Ричман Дж. С. и др. Сердечно-сосудистые колебания у постели больного: ранняя диагностика неонатального сепсиса с использованием мониторинга характеристик сердечного ритма. Physiol Meas. 2011; 32: 1821–32.
PubMed PubMed Central Статья Google ученый
Пинский М.Р., Пайен Д. Функциональный гемодинамический мониторинг. Crit Care. 2005; 9: 566–72.
PubMed PubMed Central Статья Google ученый
Винсент Дж. Л., Родос А., Перель А., Мартин Г. С., Рокка Г. Д., Валле Б. и др. Клинический обзор: обновленная информация о мониторинге гемодинамики — консенсус 16. Crit Care. 2011; 15: 229.
PubMed PubMed Central Статья Google ученый
Мурман Дж. Р., Карло В. А., Каттвинкель Дж., Шелонка Р. Л., Порчелли П. Дж., Наваррете, Коннектикут и др. Снижение смертности с помощью мониторинга характеристик частоты сердечных сокращений у новорожденных с очень низкой массой тела при рождении: рандомизированное исследование.J Pediatr. 2011; 159: 900-906.e1.
PubMed PubMed Central Статья Google ученый
Хатиб Ф., Джиан З., Будди С., Ли С., Сеттелс Дж., Сиберт К. и др. Алгоритм машинного обучения для прогнозирования гипотонии на основе точного анализа кривой артериального давления. Анестезиология. 2018; 129: 663–74.
PubMed Статья PubMed Central Google ученый
Зал JE. Учебник медицинской физиологии Гайтона и Холла, тринадцатое издание. Эльзевир: Сондерс; 2011.
Google ученый
Беллетти А., Ландони Г., Ломиворотов В.В., Ориани А., Аджелло С. Адренергическое подавление в интенсивной терапии: молекулярные механизмы и терапевтические доказательства. J Cardiothorac Vasc Anesth. 2020; 34: 1023–41.
CAS PubMed Статья Google ученый
Васудеван Н.Т., Мохан М.Л., Госвами С.К., Прасад СВН. Регуляция функции β-адренорецепторов. Клеточный цикл. 2011; 10: 3684–91.
CAS PubMed PubMed Central Статья Google ученый
Rockman HA, Koch WJ, Lefkowitz RJ. Семь трансмембранных рецепторов и функция сердца. Природа. 2002; 415: 206–12.
CAS PubMed Статья Google ученый
Ferguson SSG. Развивающиеся концепции эндоцитоза рецепторов, связанных с G-белками: роль в десенсибилизации рецепторов и передаче сигналов. Pharmacol Rev.2001; 53: 1-24.
CAS PubMed PubMed Central Google ученый
Wu L-L, Yang S-L, Yang R-C, Hsu H-K, Hsu C, Dong L-W, et al. G Передача сигнала, опосредованная комплексом протеина и аденилатциклазы, в сердце крысы во время сепсиса. Шок. 2003; 19: 533–7.
CAS PubMed Статья PubMed Central Google ученый
Еленков IJ, Wilder RL, Chrousos GP, Vizi ES. Симпатический нерв — интегративный интерфейс между двумя суперсистемами: мозгом и иммунной системой. Pharmacol Rev.2000; 52: 595–638.
CAS PubMed PubMed Central Google ученый
Stolk RF, van der Pasch E, Naumann F, Schouwstra J, Bressers S, van Herwaarden AE, et al. Норэпинефрин нарушает регуляцию иммунного ответа и ставит под угрозу защиту хозяина во время сепсиса.Am J Respir Crit Care Med. 2020; 202: 830–42.
CAS PubMed Статья PubMed Central Google ученый
Болдт Дж., Менгес Т., Кун Д., Диридис К., Хемпельманн Г. Изменения в циркулирующих вазоактивных веществах у критически больных — сравнение выживших и не выживших. Intensive Care Med. 1995; 21: 218–25.
CAS PubMed Статья PubMed Central Google ученый
Островски С.Р., Гайни С., Педерсен С., Йоханссон П.И. Симпатоадреналовая активация и повреждение эндотелия у пациентов с различной степенью острого инфекционного заболевания: обсервационное исследование. J Crit Care. 2015; 30: 90–6.
PubMed Статья PubMed Central Google ученый
Schmittinger CA, Torgersen C, Luckner G, Schröder DCH, Lorenz I, Dünser MW. Неблагоприятные сердечные события во время терапии катехоламиновыми вазопрессорами: проспективное обсервационное исследование.Intensive Care Med. 2012; 38: 950–8.
CAS PubMed Статья PubMed Central Google ученый
Кенни М.Дж., Ганта СК. Взаимодействие вегетативной нервной системы и иммунной системы. В кн .: Комплексная физиология. США: Wiley; 2014. с. 1177–200.
Глава Google ученый
Сканцано А., Косентино М. Адренергическая регуляция врожденного иммунитета: обзор.Front Pharmacol. 2015; 6: 171.
PubMed PubMed Central Статья CAS Google ученый
Chapleau MW, Li Z, Meyrelles SS, Ma X, Abboud FM. Механизмы, определяющие чувствительность афферентов барорецепторов при здоровье и болезни. Ann N Y Acad Sci. 2001; 940: 1–19.
CAS PubMed Статья Google ученый
Chapleau MW. Барорецепторные рефлексы.В кн .: Учебник по вегетативной нервной системе. Нидерланды: Эльзевир; 2012. с. 161–5.
Глава Google ученый
Desai TH, Collins JC, Snell M, Mosqueda-Garcia R. Моделирование артериального и сердечно-легочного барорефлексного контроля частоты сердечных сокращений. Am J Physiol Circ Physiol. 1997; 272: h3343–52.
CAS Статья Google ученый
Crystal GJ, Салем MR.Бейнбриджские и «обратные» рефлексы Бейнбриджа. Anesth Analg. 2012; 114: 520–32.
CAS PubMed Статья Google ученый
Ватнер С.Ф., Цимпфер М. Рефлекс Бейнбриджа у сознательных, необузданных и успокоенных бабуинов. Am J Physiol Circ Physiol. 1981; 240: h264–7.
CAS Статья Google ученый
О’Реган Р.Г., Майчерчик С. Роль периферических хеморецепторов и центральная химиочувствительность в регуляции дыхания и кровообращения.J Exp Biol. 1982; 100: 23–40.
PubMed Статья Google ученый
Милсом В.К., Бурлесон М.Л. Хеморецепторы периферических артерий и эволюция каротидного тела. Respir Physiol Neurobiol. 2007; 157: 4–11.
CAS PubMed Статья Google ученый
Лахири С., Форстер РЭ. CO 2 / H + зондирование: периферическая и центральная хеморецепция.Int J Biochem Cell Biol. 2003. 35: 1413–35.
CAS PubMed Статья Google ученый
Halliwill JR, Morgan BJ, Charkoudian N. Взаимодействия периферических хеморефлексов и барорефлексов в регуляции сердечно-сосудистой системы у людей. J Physiol. 2003; 552: 295–302.
CAS PubMed PubMed Central Статья Google ученый
Somers VK, Mark AL, Abboud FM.Взаимодействие барорецепторного и хеморецепторного рефлекторного контроля активности симпатических нервов у нормальных людей. J Clin Invest. 1991; 87: 1953-7.
CAS PubMed PubMed Central Статья Google ученый
Dünser MW, Hasibeder WR. Сверхстимуляция симпатической нервной системы во время критического заболевания: побочные эффекты адренергического стресса. J Intensive Care Med. 2009. 24: 293–316.
PubMed Статья PubMed Central Google ученый
Ferreira JA, Bissell BD. Неверно направленная симпатия: роль симпатолиза при сепсисе и септическом шоке. J Intensive Care Med. 2018; 33: 74–86.
PubMed Статья PubMed Central Google ученый
Бенедикт ЧР, Роуз Дж.А. Изменения артериального норадреналина у пациентов с септическим шоком. Circ Shock. 1992; 38: 165–72.
CAS PubMed PubMed Central Google ученый
Brown SM, Lanspa MJ, Jones JP, Kuttler KG, Li Y, Carlson R, et al. Выживаемость после шока, требующего вазопрессорной терапии в высоких дозах. Грудь. 2013; 143: 664–71.
CAS PubMed Статья PubMed Central Google ученый
Рудигер А., Зингер М. Декатехоламинизация при сепсисе. Crit Care. 2016; 20: 309.
PubMed PubMed Central Статья Google ученый
Bucher M, Kees F, Taeger K, Kurtz A. Цитокины подавляют экспрессию α1-адренорецепторов во время эндотоксемии. Crit Care Med. 2003. 31: 566–71.
CAS PubMed Статья PubMed Central Google ученый
Бернардин Г., Стросберг А.Д., Бернард А., Маттей М., Марулло С. Зависимая и независимая от бета-адренорецепторов стимуляция аденилатциклазы нарушается при тяжелом сепсисе у людей. Intensive Care Med.1998; 24: 1315–22.
CAS PubMed Статья PubMed Central Google ученый
Кариу А., Пинский М.Р., Мончи М., Лоран И., Винсонно С., Чиче Дж. Д. и др. Снижается ли адренергическая реакция миокарда при септическом шоке у человека? Intensive Care Med. 2008; 34: 917–22.
PubMed Статья Google ученый
Рудигер А. Бета-блокада гнойного сердца.Crit Care Med. 2010; 38: S608–12.
PubMed Статья PubMed Central Google ученый
Schmidt C, Kurt B, Höcherl K, Bucher M. Ингибирование активности NF-kB предотвращает подавление альфа1-адренорецепторов и недостаточность кровообращения во время CLP-индуцированного сепсиса. Шок. 2009. 32: 239–46.
CAS PubMed Статья PubMed Central Google ученый
Акланд Г.Л., Казымов В, Марина Н, Певица М, Гурин А.В. Периферическое нейронное обнаружение связанных с опасностями и патогенами молекулярных паттернов. Crit Care Med. 2013; 41: e85-92.
CAS PubMed PubMed Central Статья Google ученый
Шмидт Х., Мюллер-Вердан У., Нудинг С., Хоффманн Т., Фрэнсис Д.П., Хойер Д. и др. Нарушение чувствительности к хеморефлексу у взрослых пациентов с синдромом полиорганной недостаточности? Потенциальная роль тяжести заболевания.Intensive Care Med. 2004. 30: 665–72.
PubMed Статья PubMed Central Google ученый
Годин П.Дж., Бухман Т.Г. Развязка биологических осцилляторов. Crit Care Med. 1996; 24: 1107–16.
CAS PubMed Статья PubMed Central Google ученый
Шаршар Т., Грей Ф, де ла Грандмезон Г.Л., Хопклинсон Н.С., Росс Э., Дорандеу А. и др.Апоптоз нейронов в вегетативных сердечно-сосудистых центрах, вызванный индуцибельной синтазой оксида азота, после смерти от септического шока. Ланцет. 2003; 362: 1799–805.
CAS PubMed Статья PubMed Central Google ученый
Шен Ф-М, Гуань И-Ф, Се Х-Х, Су Д-Ф. Функция артериального барорефлекса определяет время выживания крыс при шоке, вызванном липополисахаридами. Шок. 2004; 21: 556–60.
PubMed Статья PubMed Central Google ученый
Nardocci G, Martin A, Abarzúa S, Rodríguez J, Simon F, Reyes EP и др. Развитие сепсиса до полиорганной дисфункции у крыс, подвергшихся химиотерапии / бароденервации сонной артерии, получавших липополисахарид. J Neuroimmunol. 2015; 278: 44–52.
CAS PubMed Статья PubMed Central Google ученый
Li Z, Mao HZ, Abboud FM, Chapleau MW. Свободные радикалы, полученные из кислорода, способствуют дисфункции барорецепторов у атеросклеротических кроликов.Circ Res. 1996; 79: 802–11.
CAS PubMed Статья PubMed Central Google ученый
Нагано М., Накамура М., Сато К., Танака Ф., Сегава Т., Хирамори К. Связь между уровнями С-реактивного белка в сыворотке и скоростью пульсовой волны: популяционное поперечное исследование в общей популяции. Атеросклероз. 2005; 180: 189–95.
CAS PubMed Статья PubMed Central Google ученый
Sayk F, Vietheer A, Schaaf B, Wellhoener P, Weitz G, Lehnert H, et al. Эндотоксемия вызывает центральное подавление симпатического вазомоторного тонуса у здоровых людей. Am J Physiol Integr Comp Physiol. 2008; 295: R891–8.
CAS Статья Google ученый
Ramchandra R, Wan L, Hood SG, Frithiof R, Bellomo R, May CN. Септический шок вызывает отчетливые изменения активности симпатических нервов сердца и почек у овец в сознании.Am J Physiol Integr Comp Physiol. 2009; 297: R1247–53.
CAS Статья Google ученый
Vayssettes-Courchay C, Bouysset F, Verbeuren TJ. Симпатическая активация и тахикардия у крыс, получавших липополисахариды, коррелированы по времени и не связаны с барорефлексом. Auton Neurosci. 2005; 120: 35–45.
CAS PubMed Статья PubMed Central Google ученый
Pålsson J, Ricksten SE, Lundin S. Изменения центральной гемодинамики во время экспериментального септического шока у крыс в сознании. Circ Shock. 1987. 22: 65–72.
PubMed PubMed Central Google ученый
Миллс Э. Развитие реакции симпатической нервной системы на эндотоксикоз у крыс: важность небарорефлексных механизмов у новорожденных и взрослых. J Dev Physiol. 1990; 13: 99–103.
CAS PubMed PubMed Central Google ученый
Tracey KJ. Воспалительный рефлекс. Природа. 2002; 420: 853–9.
CAS PubMed Статья PubMed Central Google ученый
Павлов В.А., Трейси К.Дж. Холинергический противовоспалительный путь. Иммунное поведение мозга. 2005; 19: 493–9.
CAS PubMed Статья PubMed Central Google ученый
Fairchild KD, Srinivasan V, Randall Moorman J, Gaykema RPA, Goehler LE.Патоген-индуцированные изменения частоты сердечных сокращений, связанные с активацией холинергической нервной системы. Am J Physiol Integr Comp Physiol. 2011; 300: R330–9.
CAS Статья Google ученый
Боровикова Л.В., Иванова С., Чжан М., Ян Х., Бочкина Г.И., Уоткинс Л.Р. и др. Стимуляция блуждающего нерва ослабляет системную воспалительную реакцию на эндотоксин. Природа. 2000; 405: 458–62.
CAS PubMed Статья PubMed Central Google ученый
Павлов В.А., Ван Х., Чура С.Дж., Фридман С.Г., Трейси К.Дж. Холинергический противовоспалительный путь: недостающее звено в нейроиммуномодуляции. Mol Med. 2003. 9: 125–34.
CAS PubMed PubMed Central Статья Google ученый
Чен М., Ли X, Ян Х, Тан Дж, Чжоу С. Хайп или надежда: стимуляция блуждающего нерва против острого ишемического реперфузионного повреждения миокарда. Trends Cardiovasc Med. 2020; 30: 481–8.
PubMed Статья PubMed Central Google ученый
Nuntaphum W, Pongkan W, Wongjaikam S, Thummasorn S, Tanajak P, Khamseekaew J, et al. Стимуляция блуждающего нерва оказывает кардиозащитное действие против ишемии / реперфузионного повреждения миокарда, преимущественно через его эфферентные волокна блуждающего нерва. Basic Res Cardiol. 2018; 113: 22.
PubMed Статья CAS PubMed Central Google ученый
Stauss HM. Идентификация механизмов контроля артериального давления с помощью спектрального анализа мощности.Clin Exp Pharmacol Physiol. 2007; 34: 362–8.
CAS PubMed Статья PubMed Central Google ученый
Stauss HM. Изменчивость частоты сердечных сокращений. Am J Physiol Integr Comp Physiol. 2003; 285: R927–31.
CAS Статья Google ученый
Хаджи-Майкл П.Г., Винсент Дж.Л., Дегауте Дж. П., ван де Борн П. Спектральный анализ мощности сердечно-сосудистой вариабельности у критически больных нейрохирургических пациентов.Crit Care Med. 2000. 28: 2578–83.
CAS PubMed Статья PubMed Central Google ученый
Bravi A, Longtin A, Seely AJE. Обзор и классификация методов анализа вариабельности с клиническими приложениями. Биомед Рус Онлайн. 2011; 10: 90.
PubMed PubMed Central Статья Google ученый
Малик М., Биггер Дж. Т., Камм А. Дж., Клейгер Р. Э., Маллиани А., Мосс А. Дж. И др.Вариабельность сердечного ритма: стандарты измерения, физиологическая интерпретация и клиническое использование. Eur Heart J. 1996; 17: 354–81.
Артикул Google ученый
Понте Дж., Контрерас П., Курбело А., Медина Дж., Новери С., Бентанкур С. и др. Вариабельность сердечного ритма как ранний маркер синдрома полиорганной недостаточности у пациентов с сепсисом. J Crit Care. 2003. 18: 156–63.
PubMed Статья PubMed Central Google ученый
Jarkovska D, Valesova L, Chvojka J, Benes J, Sviglerova J, Florova B, et al. Вариабельность сердечного ритма при прогрессирующем сепсисе свиней, вызванном перитонитом. Front Physiol. 2016; 6: 412.
PubMed PubMed Central Статья Google ученый
Годин П.Дж., Флейшер Л.А., Эйдсат А, Вандивье Р.В., Преас Х.Л., Бэнкс С.М. и др. Экспериментальная эндотоксемия человека увеличивает регулярность сердечной деятельности. Crit Care Med. 1996; 24: 1117–24.
CAS PubMed Статья PubMed Central Google ученый
Fairchild KD, Saucerman JJ, Raynor LL, Sivak JA, Xiao Y, Lake DE, et al. Эндотоксин снижает вариабельность сердечного ритма у мышей: эффекты цитокинов и стероидов. Am J Physiol Integr Comp Physiol. 2009; 297: R1019–27.
CAS Статья Google ученый
Ван де Борн П., Монтано Н., Пагани М., Орен Р., Сомерс В. Отсутствие низкочастотной изменчивости активности симпатического нерва при тяжелой сердечной недостаточности. Тираж. 1997; 95: 1449–54.
PubMed Статья PubMed Central Google ученый
Каррара М., Херпейн А., Базелли Дж., Феррарио М. Сосудистая развязка при септическом шоке: комбинированная роль вегетативной нервной системы, жесткости артерий и тонуса периферических сосудов. Front Physiol. 2020; 11: 594.
PubMed PubMed Central Статья Google ученый
Каррара М., Бабини Дж., Базелли Дж., Ристаньо Дж., Пасторелли Р., Брунелли Л. и др.Вариабельность артериального давления, функциональность сердца и изменения ткани левого желудочка в протоколе тяжелого геморрагического шока и реанимации. J Appl Physiol. 2018; 125: 1011–20.
CAS PubMed Статья PubMed Central Google ученый
Каррара М., Боллен Пинто Б., Базелли Дж., Бенджелид К., Феррарио М. Чувствительность барорефлекса и вариабельность артериального давления могут помочь понять различный ответ на терапию во время острой фазы септического шока.Шок. 2018; 50: 78–86.
PubMed PubMed Central Статья Google ученый
Parker MM, Shelhamer JH, Natanson C, Alling DW, Parrillo JE. Серийные сердечно-сосудистые переменные у выживших и не выживших после септического шока человека. Crit Care Med. 1987; 15: 923–9.
CAS PubMed Статья PubMed Central Google ученый
Азими Дж., Винсент Дж. Л..Абсолютное выживание от септического шока. Реанимация. 1986; 14: 245–53.
CAS PubMed Статья PubMed Central Google ученый
Рудигер А., Сингер М. Сердце в сепсисе: от основных механизмов до клинического лечения. Curr Vasc Pharmacol. 2013; 11: 187–95.
CAS PubMed PubMed Central Google ученый
Suzuki T, Morisaki H, Serita R, Yamamoto M, Kotake Y, Ishizaka A, et al.Инфузия β-адреноблокатора эсмолола снижает дисфункцию миокарда у крыс с сепсисом *. Crit Care Med. 2005; 33: 2294–301.
CAS PubMed Статья PubMed Central Google ученый
Абоаб Дж., Себиль В., Журден М., Мангалабойи Дж., Гарби М., Мансарт А. и др. Влияние эсмолола на системную и легочную гемодинамику, а также на оксигенацию у свиней с гиподинамическим эндотоксиновым шоком. Intensive Care Med. 2011; 37: 1344–51.
CAS PubMed Статья PubMed Central Google ученый
Морелли А., Эртмер С., Вестфаль М., Реберг С., Кампмайер Т., Лиггес С. и др. Влияние контроля сердечного ритма с помощью эсмолола на гемодинамику и клинические исходы у пациентов с септическим шоком. ДЖАМА. 2013; 310: 1683.
PubMed Статья CAS PubMed Central Google ученый
Леви Б., Фриц С., Пиона С., Дуарте К., Морелли А., Гуэрчи П. и др. Гемодинамические и противовоспалительные эффекты раннего использования эсмолола при гиперкинетическом септическом шоке: пилотное исследование. Crit Care. 2021; 25:21.
PubMed PubMed Central Статья Google ученый
Hosokawa K, Su F, Taccone FS, Post EH, Pereira AJ, Herpain A, et al. Введение эсмолола для контроля тахикардии на модели перитонита у овец. Anesth Analg.2017; 125: 1952–199.
CAS PubMed Статья PubMed Central Google ученый
Kakihana Y, Nishida O, Taniguchi T., Okajima M, Morimatsu H, Ogura H, et al. Эффективность и безопасность ландиолола, β1-селективного антагониста ультракороткого действия, для лечения тахиаритмии, связанной с сепсисом (J-Land 3S): многоцентровое открытое рандомизированное контролируемое исследование. Ланцет Респир Мед. 2020; 8: 863–72.
CAS PubMed Статья PubMed Central Google ученый
Wei C, Al Kattani N, Louis H, Albuisson E, Levy B., Kimmoun A. Если ингибирование каналов ивабрадином не улучшает сердечную и сосудистую функцию при экспериментальном септическом шоке. Шок. 2016; 46: 297–303.
CAS PubMed Статья PubMed Central Google ученый
Чен А., Элия Н., Дунайцева Дж., Рудигер А., Уолдер Б., Боллен ПБ. Влияние ивабрадина на основные неблагоприятные сердечно-сосудистые события и смертность у пациентов в критическом состоянии: систематический обзор и метаанализ рандомизированных контролируемых исследований с последовательным анализом исследований.Br J Anaesth. 2020; 124: 726–38.
CAS PubMed Статья PubMed Central Google ученый
Aboab J, Mayaud L, Sebille V, de Oliveira R, Jourdain M, Annane D. Эсмолол косвенно стимулирует активность блуждающего нерва у свиней с эндотоксемией. Интенсивная терапия Med Exp. 2018; 6: 14.
PubMed PubMed Central Статья Google ученый
Сузуки Т., Иноуэ К., Игараси Т., Като Дж., Нагата Х., Ямада Т. и др.Терапия бета-блокаторами сохраняет нормальное количество Т-лимфоцитов в селезенке, сниженное пропорционально тяжести сепсиса в модели сепсиса. Crit Care Res Pract Hindawi. 2019; 2019: 1–5.
Google ученый
Hagiwara S, Iwasaka H, Maeda H, Noguchi T. Ландиолол, антагонист бета1-адренорецепторов ультракороткого действия, оказывает защитное действие на модели системного воспаления, индуцированного LPS. Шок. 2009; 31: 515–20.
CAS PubMed Статья PubMed Central Google ученый
Geloen A, Chapelier K, Cividjian A, Dantony E, Rabilloud M, May CN и др. Клонидин и дексмедетомидин усиливают прессорный ответ на норэпинефрин при экспериментальном сепсисе. Crit Care Med. 2013; 41: e431–8.
CAS PubMed Статья PubMed Central Google ученый
Pichot C, Géloën A, Ghignone M, Quintin L. Агонисты альфа-2 для снижения потребности в вазопрессорах при септическом шоке? Мед-гипотезы. 2010. 75: 652–6.
CAS PubMed Статья Google ученый
Морелли А., Санфилиппо Ф., Арнеманн П., Хесслер М., Кампмайер Т.Г., Д’Эджидио А. и др. Эффект седации пропофола и дексмедетомидина на потребность в норэпинефрине у пациентов с септическим шоком. Crit Care Med. 2019; 47: e89-95.
CAS PubMed Статья Google ученый
Чоккари Л., Луети Н., Бейли М., Шехаби Ю., Хоу Б., Мессмер А.С. и др.Влияние дексмедетомидина на потребность в вазопрессорах у пациентов с септическим шоком: анализ подгруппы исследования «Практика седации в интенсивной терапии» [SPICE III]. Crit Care. 2020; 24: 441.
PubMed PubMed Central Статья Google ученый
Czura CJ, Schultz A, Kaipel M, Khadem A, Huston JM, Павлов В.А. и др. Стимуляция блуждающего нерва регулирует гемостаз у свиней. Шок. 2010; 33: 608–13.
PubMed PubMed Central Статья Google ученый
Лю CY, Mueller MH, Grundy D, Kreis ME. Блуждающая модуляция афферентной чувствительности кишечника к системному LPS у крыс. Am J Physiol Liver Physiol. 2007; 292: G1213–20.
CAS Google ученый
Кохутова М., Хорак Дж., Ярковска Д., Мартинкова В., Тегл В., Налос Л. и др. Стимуляция блуждающего нерва ослабляет множественную дисфункцию органов при прогрессирующем сепсисе у реанимированных свиней. Crit Care Med. 2019; 47: e461–9.
CAS PubMed Статья Google ученый
Chen S-J, Wu C-C, Yang S-N, Lin C-I, Yen M-H. Аномальная активация K + каналов в гладкой мышце аорты крыс с эндотоксическим шоком: электрофизиологические и функциональные доказательства. Br J Pharmacol. 2000; 131: 213–22.
CAS PubMed PubMed Central Статья Google ученый
Бакли Дж., Певица MCL. Роль каналов КАТФ при сепсисе. Cardiovasc Res. 2006; 72: 220–30.
CAS PubMed Статья Google ученый
Bangash MN, Kong M-L, Пирс RM. Использование инотропов и вазопрессоров у пациентов в критическом состоянии. Br J Pharmacol. 2012; 165: 2015–33.
CAS PubMed PubMed Central Статья Google ученый
Айелло Э.А., Малкольм А.Т., Уолш М.П., Коул В. Активация β-адренорецепторов и PKA регулируют K + каналы замедленного выпрямления гладкомышечных клеток сосудов. Am J Physiol Circ Physiol. 1998; 275: h548–59.
CAS Статья Google ученый
Ландри Д.В., Оливер Дж. АТФ-чувствительный K + канал опосредует гипотензию при эндотоксемии и гипоксическом лактоацидозе у собак. J Clin Invest. 1992; 89: 2071–4.
CAS PubMed PubMed Central Статья Google ученый
Olofsson PS, Rosas-Ballina M, Levine YA, Tracey KJ. Переосмысление воспаления: нейронные цепи в регуляции иммунитета. Immunol Rev.2012; 248: 188–204.
PubMed PubMed Central Статья Google ученый
Вегетативная нервная система при функциональных расстройствах кишечника
Сводка
Связь вдоль оси мозг-кишечник включает нервные пути, а также иммунные и эндокринные механизмы.Две ветви вегетативной нервной системы анатомически и функционально интегрированы с висцеральными сенсорными путями и отвечают за гомеостатическую регуляцию функции кишечника. Вегетативная нервная система также является основным посредником висцеральной реакции на центральные воздействия, такие как психологический стресс и другие центральные факторы.
Согласно настоящему определению, функциональные расстройства представляют собой совокупность симптомов, некоторые из которых предполагают наличие измененного восприятия, в то время как другие симптомы указывают на нарушение функции желудочно-кишечного тракта как причину симптомов.Растет число сообщений, демонстрирующих нарушение вегетативной функции в подгруппах пациентов с функциональным кишечником.1-3 Хотя для оценки вегетативной функции использовался ряд различных методов, они, как правило, указывают на уменьшение вагусного (парасимпатического) оттока или повышение симпатической активности у пациентов. состояния, обычно связанные с медленной или сниженной перистальтикой желудочно-кишечного тракта. Другие исследования обнаружили либо повышенную холинергическую активность, либо снижение симпатической активности у пациентов с симптомами, совместимыми с повышенной двигательной активностью.3 4 При определенных условиях нарушение вегетативного баланса (включая низкий тонус блуждающего нерва и повышенную симпатическую активность) также может изменить висцеральное восприятие.
Вегетативная дисфункция также может представлять собой физиологический путь, объясняющий многие внекишечные симптомы, наблюдаемые у пациентов с синдромом раздраженного кишечника (СРК), и некоторые частые желудочно-кишечные жалобы, о которых сообщают пациенты с такими расстройствами, как хроническая усталость и фибромиалгия.
В последние годы мы претерпели существенные изменения в наших концептуальных определениях того, что составляет функциональные расстройства кишечника и СРК.В целом мы теперь рассматриваем эти состояния как группу расстройств или клинических состояний, характеризующихся наличием в той или иной степени хронической боли, дискомфорта и нарушенной функции желудочно-кишечного тракта. Хотя этот тип клинического определения соответствует тому, как эти пациенты проявляют себя, оказалось, что его трудно применить при поиске патофизиологического фактора (ов), потенциально вовлеченного в эти состояния. Хотя многое еще предстоит сделать в этом отношении, все более широко признается, что эти состояния являются многофакторными и что симптомы, испытываемые двумя отдельными пациентами, хотя и в некоторой степени схожи, на самом деле могут быть результатом ряда различных этиологий.
Нарушения моторной и секреторной функции, а также измененная нервная функция кишечника могут быть идентифицированы у многих пациентов с функциональными расстройствами (рис. 1). Однако у большинства пациентов нет очевидной двигательной дисфункции, а выявленные аномалии варьируются от исследования к исследованию, причем каждая из этих аномалий присутствует в небольших и очень специфических группах пациентов, которые не составляют большинство наблюдаемых в клинической практике. Представление о том, что эти состояния представляют собой в первую очередь моторику или кишечные нервные расстройства, в настоящее время также обычно рассматривается как неспособное учитывать многие другие характеристики, присутствующие у этих пациентов, в частности дискомфорт и боль, часто возникающие при наличии явно нормальной функции желудочно-кишечного тракта. .
Рисунок 1Предполагаемый патогенез диспепсии. ВНС, вегетативная нервная система; HP, Helicobacter pylori.
У многих пациентов с функциональными расстройствами кишечника было выявлено наличие измененного висцерального восприятия различных висцеральных стимулов, таких как вздутие живота. Эта проблема измененного висцерального восприятия при СРК широко обсуждается в другом месте. По-прежнему важно отметить, что, хотя первичное расстройство висцерального сенсорного восприятия дает правдоподобное объяснение многих симптомов, описываемых при функциональных расстройствах кишечника, на клиническом уровне это понятие остается в значительной степени недоказанным.В определенных ситуациях, таких как развитие хронических симптомов после острого воспалительного или инфекционного события (например, постинфекционного синдрома раздраженного кишечника), вероятно, возможно изменение функции нормальных сенсорных механизмов либо внутри стенки кишечника, либо вдоль висцеральных афферентных путей. , по крайней мере, в краткосрочной перспективе. На данном этапе сложнее вовлечь измененные висцеральные сенсорные пути в патогенез функциональных симптомов, таких как диарея или вздутие живота. Такие симптомы присутствуют у многих пациентов с постинфекционным СРК, но также и у пациентов, у которых не было в анамнезе каких-либо острых воспалительных или инфекционных провоцирующих факторов до развития симптомов.Точно так же гипотеза об изменении висцерального сенсорного восприятия как единственном факторе функциональных расстройств не может объяснить очень высокую связь стресса, психологически травматических переживаний и эмоционального дистресса с развитием и сохранением функциональных кишечных симптомов. Если не расширить концепцию измененного висцерального сенсорного восприятия, чтобы включить корковые центры, связанные с висцеральным восприятием, или модуляцию центральной нервной системы афферентных и спинномозговых путей, участвующих в восприятии висцеральных стимулов, довольно сложно построить концептуальную основу, способную к согласование корковых событий, таких как эмоции, с периферическими сенсорными путями, участвующими в висцеральной сенсорной функции.Если прагматический подход используется для согласования различных компонентов, выявленных в клиническом проявлении функциональных расстройств кишечника, с общей концепцией вовлеченных патофизиологических факторов, необходимо выполнить несколько условий. Во-первых, заболевание (СРК) затрагивает как центральные, так и периферические участки: боль в конечном итоге является корковым явлением, в то время как такие явления, как диарея и выделение слизи, подразумевают, что существует также дисфункция кишечника как такового. Следовательно, функциональные расстройства должны в некоторой степени затрагивать как мозг, так и кишечник.Во-вторых, если висцеральные факторы, такие как инфекционное событие в кишечнике, влияют на реакцию коры головного мозга на висцеральные стимулы, и, наоборот, психологические события могут изменить функцию кишечника, связи между кишечником и мозгом, а также между мозгом и кишечником, это должно быть одним из важных модуляторов. вовлеченный. Поэтому кажется логичным, что вегетативная нервная система, которая является основным путем, участвующим в коммуникации между мозгом и кишечником, играет важную роль в функциональных расстройствах кишечника (рис. 2).
фигура 2Автономная нервная система, альтернативный вид.
Вегетативная нервная система может быть просто каналом, через который центральная нервная система контролирует висцеральную функцию, или может оказаться, что первичные изменения висцеральной вегетативной функции являются одним из патофизиологических факторов, вовлеченных в эти состояния. В следующих разделах мы рассмотрим возможную роль вегетативной нервной системы в функциональных расстройствах и некоторые терапевтические возможности, которые модуляция вегетативной функции может предоставить при лечении функциональных расстройств.
Функциональные расстройства кишечника: мозг-кишечник, кишечник-мозг или и то, и другое?
При оценке роли вегетативной нервной системы в таких состояниях, как функциональные расстройства кишечника, важно помнить о гомеостатической природе вегетативной функции. В то время как многие местные желудочно-кишечные стимулы вызывают реакции и рефлексы, участие которых по существу ограничивается непосредственной областью, которая была первоначально стимулирована, при возникновении более интенсивных или потенциально вредных стимулов в дополнение к желудочно-кишечной системе также участвуют другие системы, включая центральную нервную систему. тракт.Передача информации в центральную нервную систему позволяет выработать интегрированный гомеостатический ответ, который может включать как поведенческий, так и физиологический ответ. В этом типе ответа важны как висцеральные, так и вегетативные нервные пути.
Многие системные ответы, вызываемые висцеральными стимулами, вызываются вегетативными рефлексами. Эти рефлексы, которые возникают в основном через ствол мозга, могут не быть связаны с сознательным восприятием сенсорного стимула.Однако другие висцеральные сенсорные стимулы будут достаточно интенсивными, чтобы их можно было почувствовать и вызвать боль или дискомфорт.
Тип и степень вегетативной рефлекторной реакции на определенный висцеральный стимул зависят от местоположения, типа и интенсивности стимула. Если предшествующая сенсибилизация висцеральных афферентных путей привела к состоянию гипералгезии или аллодинии, рефлекторный ответ может быть преувеличен, тогда как периферическая сенсорная нейропатия может быть связана со снижением рефлекторной реакции.Точно так же психологические факторы, такие как повышенная бдительность, беспокойство и депрессия, также могут влиять на вегетативные рефлексы.
Оценка вегетативной функции
Был разработан ряд методов для оценки конкретных аспектов вегетативной нервной функции. От некоторых старых подходов, которые были очень громоздкими и требовали довольно сложных измерений, в значительной степени отказались. В последние годы развитие методов, основанных на вегетативной модуляции функции сердечного ритма, в значительной степени вытеснило другие методы из-за их простоты и достоверности в качестве маркеров вагусной, а также симпатической функции.6 Использование таких методов, как спектральный анализ вариабельности сердечного ритма, теперь обеспечивает простое и точное измерение соответствующего оттока блуждающих и симпатических ветвей вегетативной нервной системы. можно делать практически в любых условиях.
Вегетативная функция и расстройства кишечника
В последние годы появился ряд сообщений, предполагающих, что функциональные расстройства кишечника связаны с вегетативными нарушениями.7 Однако ни одно из этих исследований не установило больше, чем связь, и на данном этапе не должно интерпретироваться как указание на то, что измененная вегетативная функция причинно связана с функциональными расстройствами.
У животных хирургическое удаление глютеновых или брыжеечных ганглиев оказывает сильное влияние на функцию желудочно-кишечного тракта.8 Кроме того, инвазия опухолью симпатических ганглиев может привести к кишечной и / или толстой псевдообструкции у пациентов с метастатическим раком.9 Состояния, влияющие на вегетативную функцию, такие как такие как паркинсонизм и вегетативные невропатии, также оказывают глубокое влияние на функцию кишечника, как и дегенеративные невропатии, связанные с диабетом и амилоидозом.10 Однако эти изменения явно не являются прямой причиной симптомов у большинства пациентов с функциональными симптомами.
Нарушение вегетативной функции также может быть связано с другими желудочно-кишечными заболеваниями, такими как гастроэзофагеальная рефлюксная болезнь и нейропатические нарушения моторики верхних отделов желудочно-кишечного тракта. 12 Более интересно то, что такие аномалии блуждающего нерва также были выявлены у пациентов с функциональными расстройствами кишечника, включая функциональную диспепсию и инерцию толстой кишки. 14
Совсем недавно Aggarwal et al убедительно показали, что в подгруппе пациентов с СРК также наблюдаются различные вегетативные аномалии.3 Однако результаты были разными и не у всех пациентов в их когорте. Пациенты с повышенной симпатической активностью и низким тонусом блуждающего нерва имели тенденцию к запорам, тогда как пациенты, склонные к диарее, в первую очередь демонстрировали повышенную парасимпатическую активность. Другая группа показала, что функциональная боль в животе без каких-либо нарушений моторики была связана с повышенной базальной парасимпатической активностью и более низкой симпатической активностью2. У пациентов с несердечной болью в груди мы обнаружили противоположное; Пациенты с повышенной висцеральной чувствительностью к инфузии пищеводной кислоты имели более высокий симпатический тонус в покое и сниженную активность блуждающего нерва, что позволяет предположить, что аномалии могут различаться в зависимости от пораженной области кишечника (передняя кишка v задняя кишка).1
Однако на основании этих ассоциаций трудно приписать определенную причинную роль какому-либо типу вегетативной дисфункции при функциональных расстройствах, пока исследования, направленные на восстановление более нормального базального вегетативного баланса, также не покажут, что изменяют измененное висцеральное восприятие и функцию, присутствующую в эти пациенты. Центральные и эмоциональные факторы, которые, как известно, связаны с функциональными симптомами кишечника, также способны изменять вегетативный баланс. Было бы наивно не учитывать, что в большом количестве случаев, когда задействованы как центральные, так и вегетативные факторы, именно эффекты первых могут привести к возникновению вторых и желудочно-кишечных симптомов (рис. 3).
Рисунок 3Функциональное заболевание кишечника.
Выводы
Все чаще соглашаются, что вегетативные аномалии часто могут быть связаны с функциональными расстройствами кишечника. Нам все еще нужно лучше понять механизмы, ответственные за симптомы и их судьбу с восстановлением вегетативной функции. До тех пор точная роль измененной вегетативной функции в патогенезе функциональных расстройств будет оставаться столь же плохо определенной, как и роль других предполагаемых механизмов, вовлеченных в эти расстройства.И снова очевидна острая необходимость в исследованиях, сфокусированных на механизмах заболевания, а не на его клинических проявлениях, и на патофизиологии, а не на симптоматологии.
Задание 1.3: Автономная нервная система
За день или более до демонстрации попросите студентов написать очень краткое описание ситуации, которая заставила их чувствовать себя очень злыми или испуганными. Описание недавнего события одним предложением будет служить, если оно позволяет им повторно пережить событие.Описания следует приносить в класс.
Чтобы начать демонстрацию, попросите учеников разделиться на пары и назначьте одного из них на роль испытуемого, а другого — на роль экспериментатора. Покажите экспериментаторам, как измерять радиальную частоту пульса на внутренней стороне запястья, используя только кончики пальцев, чтобы избежать эха большого пальца, и дайте им несколько минут на тренировку. Когда все экспериментаторы будут уверены в измерении пульса, попросите подготовить протокол с номерами от 1 до 10 с двумя дополнительными полями, отмеченными 15 и 20.Они соответствуют количеству минут, которые проходят после начала упражнения.
Первые 3 минуты называются периодом базовой скорости, следующие 3 — периодом возбуждения, а следующие 4 — периодом восстановления. Последние два периода по 5 минут каждый составляют окончательный период базовой ставки. В течение каждой минуты экспериментатор измеряет частоту пульса испытуемого только в течение первых 30 секунд, но он или она должен записать частоту после умножения ее на 2, чтобы создать и оценить количество ударов в минуту (BPM).Перед началом объясните, что вы будете изучать влияние ВНС на частоту сердечных сокращений. Испытуемые будут пытаться возбудить свои социальные сети, написав подробное эссе о событии, которое они выбрали ранее. Поощряйте испытуемых писать свободно, уверяя их, что вы не будете собирать эссе, и попросите их сфокусировать эссе на том, что именно произошло, что они чувствовали и что они с этим сделали. По окончании 6 -й минуты скажите студентам, чтобы они перестали писать; некоторые предметы очень вовлекаются, и о них нужно напоминать.Когда все перестанут писать, попросите их просто посидеть и расслабиться в течение следующих 4 минут. Последние две меры принимаются через 5 минут 10 минут после периода восстановления.
Процедура займет меньше времени, если вы сможете координировать действия всех. После объяснения того, что будет делать класс, и после того, как студенты подготовили протоколы, начинайте отсчет времени. Сообщите, когда истекли 30 секунд (например, «Время, пожалуйста, умножьте частоту пульса на 2 и запишите это»), когда истекут 30 секунд из 2 nd минут («Время, запишите, пожалуйста, частоту пульса для секунды период ») и так далее.Когда начнется 4 -я минута, попросите испытуемых начать писать. В конце 6 -й минуты попросите испытуемых остановиться. Процедура для последних 4 минут такая же, как и для первых 3; для 15 -го и 20 -го минут; вы можете установить будильник, чтобы напомнить экспериментаторам о необходимости снова начать запись на 30 секунд. Убедитесь, что все экспериментаторы записали BPM.
Затем попросите каждую пару учеников подготовить график, подобный показанному в конце этого упражнения.Данные, которые я нанес на график, являются средними для класса 25 человек; ваши студенты подготовят индивидуальные данные. Перед завершением упражнения постройте график на основе средних значений по классам, чтобы они увидели результаты, более приближенные к теоретически ожидаемым.
Что такое вегетативная нервная система?
Автор
Bradley C Gill, MD, MS Главный ординатор, отделение урологии, Институт урологии и почек им. Гликмана; Клинический инструктор по хирургии, Кливлендская клиника, Медицинский колледж Лернера, Образовательный институт; Персонал-консультант, Департамент биомедицинской инженерии, Исследовательский институт Лернера, Клиника Кливленда
Брэдли Гилл, доктор медицины, магистр медицины, является членом следующих медицинских обществ: Американского колледжа хирургов, Американской ассоциации урологов, Международного общества урологов
Раскрытие информации: ничего расскрыть.
Соавтор (ы)
Сандип П. Васавада, доктор медицины Адъюнкт-профессор хирургии, Кливлендская клиника Медицинский колледж Лернера; Врач Центра женской урологии и реконструктивной хирургии мочеполовой системы, Институт урологии и почек им. Гликмана; Совместное назначение с Женским институтом клиники Кливленда
Сандип П. Васавада, доктор медицины, является членом следующих медицинских обществ: Американского урогинекологического общества, Американской урологической ассоциации, Инженерного и урологического общества, Международного общества по борьбе с недержанием мочи, Общества уродинамики, женской тазовой медицины и урогенитальной медицины. Реконструкция
Раскрытие информации: Служить (г) в качестве директора, должностного лица, партнера, сотрудника, советника, консультанта или попечителя для: Medtronic, Axonics, BlueWind
Получил долю владения от NDI Medical, LLC для членства в экспертной комиссии; Получена плата за консультацию от аллергана за выступление и преподавание; Получил гонорар от компании medtronic за выступление и преподавание; Получил гонорар от boston Scientific за консультацию.для: Oasis Consumer Healthcare.
Фарзин Фирузи, доктор медицины Научный сотрудник Центра женской урологии и реконструктивной хирургии тазовых органов, Институт урологии Гликмана, Фонд клиники Кливленда
Фарзин Фирузи, доктор медицинских наук, является членом следующих медицинских обществ: Американской медицинской ассоциации, Американской ассоциации урологов
Раскрытие: нечего раскрывать.
Raymond R Rackley, MD Профессор хирургии клиники Кливленда Медицинский колледж Лернера; Штатный врач Центра невроурологии, женского тазового здоровья и женской реконструктивной хирургии, Урологического института Гликмана, клиники Кливленда, Центра семейного здоровья Бичвуд и Центра семейного здоровья Уиллоуби-Хиллз; Директор лаборатории биологии уротелия, Исследовательский институт Лернера, Клиника Кливленда
Раймонд Р. Ракли, доктор медицины, является членом следующих медицинских обществ: Американская урологическая ассоциация
Раскрытие информации: не подлежит разглашению.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Главный редактор
Эдвард Дэвид Ким, доктор медицины, FACS Профессор хирургии, отделение урологии, Высшая школа медицины Университета Теннесси; Консультант, Медицинский центр Университета Теннесси
Эдвард Дэвид Ким, доктор медицины, FACS является членом следующих медицинских обществ: Американского общества репродуктивной медицины, Американской ассоциации урологов, Общества сексуальной медицины Северной Америки, Общества мужской репродукции и урологии, Общество изучения мужской репродукции, Медицинская ассоциация Теннесси
Раскрытие информации: выступать (d) в качестве докладчика или члена бюро докладчиков для: Endo.
Дополнительные участники
Raymond R Rackley, MD Профессор хирургии клиники Кливленда Медицинский колледж Лернера; Штатный врач Центра невроурологии, женского тазового здоровья и женской реконструктивной хирургии, Урологического института Гликмана, клиники Кливленда, Центра семейного здоровья Бичвуд и Центра семейного здоровья Уиллоуби-Хиллз; Директор лаборатории биологии уротелия, Исследовательский институт Лернера, Клиника Кливленда
Раймонд Р. Ракли, доктор медицины, является членом следующих медицинских обществ: Американская урологическая ассоциация
Раскрытие информации: не подлежит разглашению.
Шломо Раз, доктор медицины Профессор отделения хирургии отделения урологии Калифорнийского университета в Лос-Анджелесе, медицинская школа Дэвида Геффена
Шломо Раз, доктор медицины, является членом следующих медицинских обществ: Американский колледж хирургов, Американский Медицинская ассоциация, Американская урологическая ассоциация, Калифорнийская медицинская ассоциация
Раскрытие: Ничего не разглашать.
Благодарности
Майкл С. Ингбер, доктор медицины Научный сотрудник, Институт урологии и почек Гликмана клиники Кливленда
Раскрытие: Ничего не нужно раскрывать.
ЧСС | Калифорнийский университет в Дэвисе, спортивная медицина
Более высокая частота сердечных сокращений может указывать на плохую работу сердца и более сильную, чем обычно, нагрузку на способность сердца циркулировать кровь. Это также может указывать на сердечные заболевания.
С точки зрения производительности знание конкретных тренировочных зон с частотой пульса может оптимизировать способность нашего тела адаптироваться к требованиям производительности. Определить эти зоны можно с помощью множества различных методов, включая тестирование VO2 или лактата, формулы и общие режимы тренировок.Затем становится необходимым контролировать интенсивность, чтобы оптимизировать ваши шансы на успех. Есть несколько доступных вам методов контроля своей интенсивности. Во-первых, это метод воспринимаемого напряжения, при котором вы оцениваете свое восприятие того, насколько сильно вы напрягаетесь во время тренировки. Акроним этого слова — RPE (рейтинг воспринимаемой нагрузки). Шкала, на которой основано ваше восприятие, варьируется от 1 до 10. См. Ниже.
Шкалу можно разбить следующим образом:
0: ничего
0.5: Очень, очень, просто
1: Очень легко
2: Легко
3: умеренный
4: Довольно сильная
5: Сильный
6:
7: Очень сильный
8:
9: Очень, очень, сильно
10: Максимальный
Как вы заметили, масштаб увеличивается нелинейно. Большая часть ваших тренировок должна проходить с оценкой воспринимаемого напряжения 3. Тренировки, предназначенные для повышения выносливости, будут иметь рейтинг 4, тренировки, предназначенные для повышения экономии, будут иметь рейтинг 5-6, а тренировки, предназначенные для увеличения скорости, будут иметь рейтинг.