Вегетативная нервная система: лечение
Расстройство вегетативной нервной системы: лечение
- Если Вас мучают изжога, отрыжки, боли в животе.
- Если у Вас гипергидроз и Вы не можете справиться с потоотделением никакими патентованными средствами
- Если у Вас – скачки артериального давления, или, напротив, эпизоды его падения,
- Если у Вас головные боли или периодически развиваются обмороки
- Если у Вас периодически возникают сердцебиения или перебои в работе сердца, Если у Вас непонятно, откуда взявшееся повышение температуры тела, длительное, не снимаемое лекарственными препаратами
Не исключено, что Вам требуется помощь вегетолога.
Запишитесь на прием и мы постараемся Вам помочь.
Записаться на прием
Вегетативная нервная система (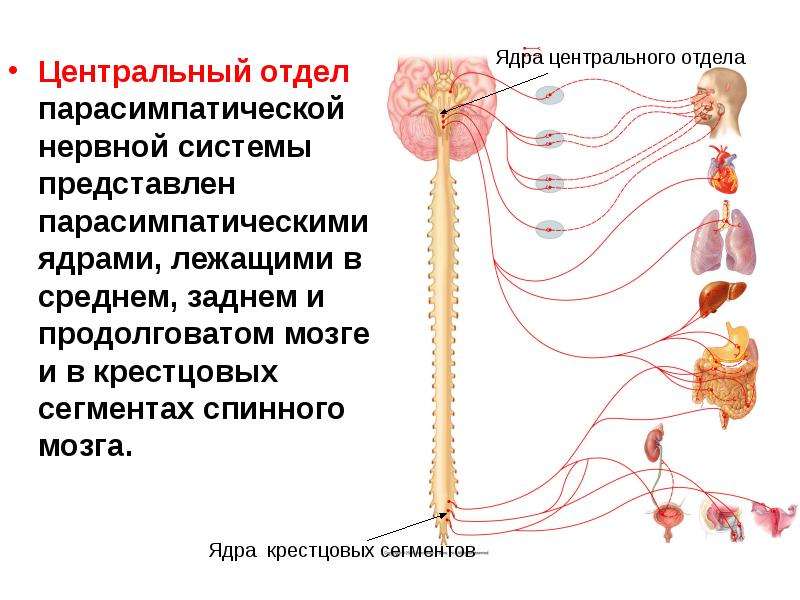 Как и другие системы человеческого организма, ВНС подвержена разнообразным патологиям. К сожалению, не все понимают, насколько важна нормально функционирующая вегетативная нервная система. Лечение дисфункции ВНС откладывают надолго. Чтобы сохранить на долгие годы хорошее самочувствие и высокую работоспособность, нужна здоровая вегетативная НС.
Как и другие системы человеческого организма, ВНС подвержена разнообразным патологиям. К сожалению, не все понимают, насколько важна нормально функционирующая вегетативная нервная система. Лечение дисфункции ВНС откладывают надолго. Чтобы сохранить на долгие годы хорошее самочувствие и высокую работоспособность, нужна здоровая вегетативная НС.
Иногда мы не подозреваем о нарушении вегетативной нервной системы. Симптомы вегетативной дисфункции таковы: учащенное дыхание, ощущение заложенности в груди, резкая приступообразная одышка. Подобные неприятные ощущения могут быть постоянными и пароксизмальными. Если Вы ощущаете частые колебания венозного и артериального давления, терморегуляторные нарушения, изжогу — вероятно, нарушена работа вегетативной нервной системы. Лечение необходимо начать, предварительно проконсультировавшись с вегетологом.
Лечение ВНС в МЦ «Пульс» дает хорошие результаты! Лучшие вегетологи Москвы, работающие у нас, позаботятся о том, чтобы Ваше лечение было эффективным, а пребывание в стационаре — комфортным и краткосрочным. Мы Вам поможем!
Мы Вам поможем!
Врачи МЦ «Пульс» применяют уникальные авторские методики, одобренные профессорами Академии медико-технических наук. Высокий уровень сервиса, заботливый персонал, передовые технологии терапии — вот почему все больше людей выбирают медицинский центр «Пульс»! Мы создали устойчивую систему управления здоровьем пациентов. Это позволяет сделать процесс терапии максимально результативным. Расстройство вегетативной нервной системы? Лечение в нашей клинике — Ваша возможность вернуться к счастливой жизни!
Звоните нам или записывайтесь онлайн прямо сейчас!
Статья «Вегетативная дистония у детей»
Все органы и системы организма находятся под регулирующим воздействием нервной системы, состоящим из центрального отдела (головной мозг) и вегетативного отдела.
«Синдром вегетативной дистонии» — это состояние, которое характеризуется нарушениями вегетативной (нервной) регуляции работы внутренних органов: сердечно-сосудистой системы, желудочно-кишечного тракта, органов дыхания, желез внутренней секреции. Изменения со стороны всех этих систем носят функциональный, т.е. обратимый характер и не представляют угрозы для жизни и здоровья ребенка. Причиной развития вегетативной дистонии являются наследственно — конституциональные факторы.
Дети с дистонией могут предъявлять самые разнообразные жалобы
Самые частые из них — головные боли, боли в области сердца и живота. Как правило, такие дети плохо переносят транспорт, душные помещения, могут быть головокружения и даже кратковременные потери сознания (обмороки). Нередко отмечается нестабильное артериальное давление, повышенная утомляемость, беспокойный сон, перемена настроения. Часто бывают внезапные ощущения проколов в левой половине грудной клетки, особенно на вдохе, сопровождающиеся чувством затрудненного дыхания, сердцебиения, бледностью.
Со стороны органов дыхания могут отмечаться приступы внезапной одышки, без видимых причин появляются глубокие «вздохи», так называемый «дыхательный невроз», приступы невротического, спазматического кашля.
При дистонии могут появляться боли и неприятные ощущения в области мышц ног, чувства онемения, преимущественно по вечерам, перед засыпанием — симптом «беспокойных ног».
Существует 2 варианта вегетативной дистонии:
- по ваготоническому типу
- по симпатикотоническому типу
При ваготоническом типе дети жалуются на частые головные боли, связанные с понижением артериального давления, боли в области сердца, редкий пульс, обморочные состояния в душных помещениях, чрезмерную потливость, зябкость, длительные сохранения субфебрильной (до 37.5) температуры после перенесенных инфекций. Часто бывают немотивированные боли в животе, тошнота, метеоризм. Такие дети быстро устают, у них повышенная тревожность, сонливость, утомляемость, склонность к депрессиям.
При симпатикотоническом типе дистонии у детей наоборот отмечаются сердцебиения, ускоренный пульс, склонность к повышенному давлению.
Верхние пределы артериального давления у детей:
- 7-9 лет 125/75
- 10-13 лет 130/80
- 14-17 лет 135/85
У таких детей часто бывают проявления «термоневроза» — повышение температуры тела на фоне стресса, колебания в течение суток, субфебрильная температура при отсутствии признаков заболевания.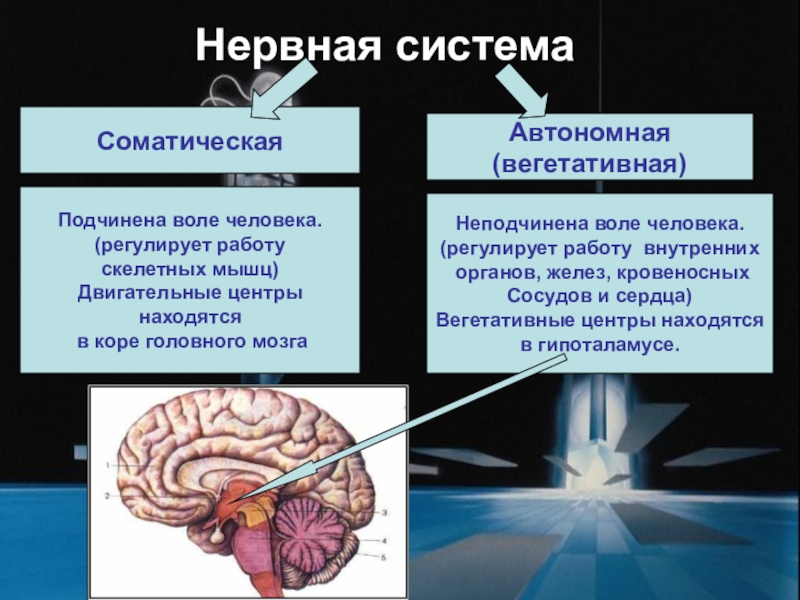 Такие дети обычно худые, несмотря на нормальный аппетит.
Такие дети обычно худые, несмотря на нормальный аппетит.
Рекомендации для родителей
В основе лечения вегетативной дистонии лежат немедикаментозные методы лечения.
Они включают в себя: правильную организацию труда и отдыха, соблюдение распорядка дня, занятия физической культурой, рациональное питание, водолечение и бальнеотерапию, физиотерапию, психотерапию. Необходимо устранить гиподинамию, так как физическая активность повышает тонус сердечно-сосудистой системы, улучшает обменные процессы и микроциркуляцию.
Прогулки на свежем воздухе должны быть не менее 2 часов в день. Освобождение от занятий физкультуры в школе не требуется.
Рекомендуемые занятия спортом: плавание, коньки, лыжи, игровые виды спорта, велосипед, легкая атлетика.
Не рекомендуется: бокс, все виды борьбы, тяжелая атлетика.
Ночной сон должен составлять не менее 8-10 часов, так как сон является основным регулятором циркадных биоритмов организма. Занятия за компьютером должны составлять не более 40 — 60 минут в день в зависимости от возраста ребенка.
Занятия за компьютером должны составлять не более 40 — 60 минут в день в зависимости от возраста ребенка.
Питание детей должно быть рациональным, с достаточным количеством минеральных веществ и витаминов. Нужно избегать избытка мучных продуктов, копченостей, животных жиров. При склонности к повышению АД необходимо ограничение соли, жидкости, высококалорийных продуктов. При ваготонической дистонии можно включать в рацион кофе, шоколад, крепкий чай, солености.
Очень эффективны водные процедуры:
- плавание
- лечебные ванны (солено — хвойные, кислородные, жемчужные)
- души (циркулярный, контрастный, подводный, душ Шарко, игольчатый)
В лечении дистонии широко используются физиотерапия и массаж. Занятия с психологом помогают детям снять излишнее напряжение, скоррегировать отношения с окружающими, снизить уровень тревоги.
Названы пять незаметных симптомов, требующих обращения к неврологу
Причину плохого самочувствия зачастую приходится выяснять у множества специалистов, сдавая разнообразные анализы, однако и это не приносит положительного результата.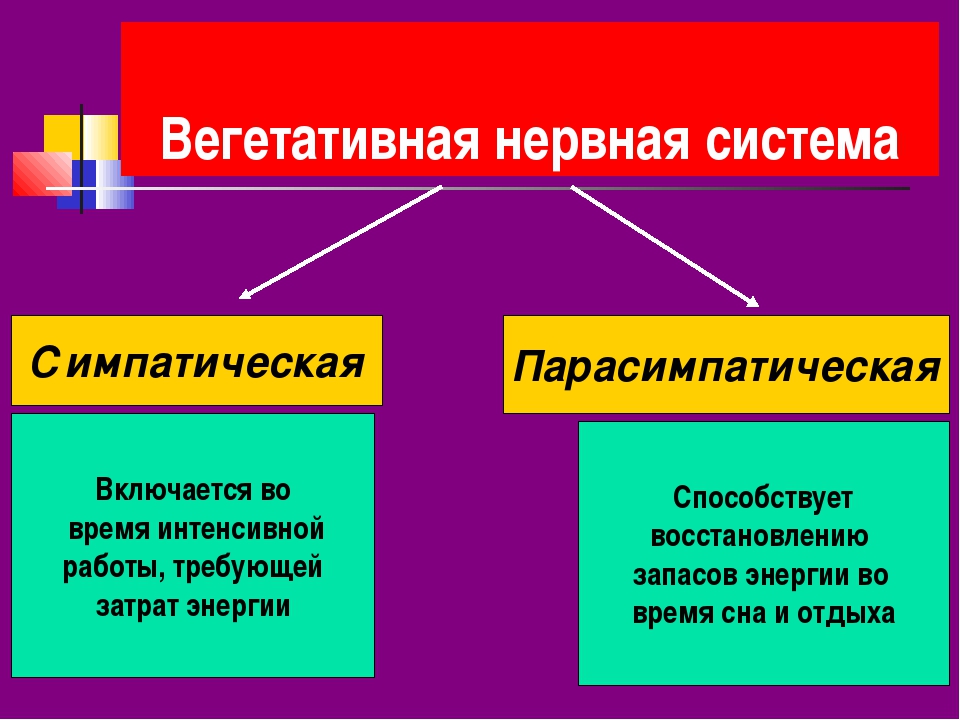 Помочь в таком случае, как рассказала невролог, кандидат медицинских наук Елена Беленко, могут врачи ее профиля, а именно узкой специализации — вегетологии. Эксперт перечислила пять состояний, которые требуют обращения именно к такому доктору.
Помочь в таком случае, как рассказала невролог, кандидат медицинских наук Елена Беленко, могут врачи ее профиля, а именно узкой специализации — вегетологии. Эксперт перечислила пять состояний, которые требуют обращения именно к такому доктору.
При ощущении сбоев в работе сердца нельзя исключать патологию, но кардиологи могут не найти существенных отклонений, а значит нарушено управление данной системой.
— Работой сердца управляют вегетативные узлы и сплетения, состоящие из симпатических и парасимпатических волокон. Точнее — три пары нервных симпатических узлов на уровне шеи и парасимпатические нервы — ветви шейной и грудиной частей блуждающего нерва. Симпатические нервы ускоряют работу сердца, либо усиливают сокращения. В норме это происходит в ответ на физическую нагрузку или в момент стресса, — цитирует Беленко KP.Ru.
У древнего человека, добавила врач, такая реакция обеспечивала выживание. У современного — стресса может не быть, а состояние возникать, что указывает на наличие заболевания и необходимость посетить невролога.
При чувстве неполного вдоха, усугубляющемся при разговорах и ходьбе, нужно сначала исключить проблемы с легкими и эндокринной системой. Если их не обнаружится, проконсультируйтесь с вегетологом.
— Дело в том, что работа легких обеспечивается двумя парами шейных симпатических узлов, бронхиальными ветвями блуждающего нерва, а также дыхательным центром головного мозга. Взаимоотношения у них достаточно сложные. Они регулируют работу гладкой мускулатуры и слизистой оболочки бронхов, тонус сосудов легких. Также оказывают влияние на объем и частоту дыхательных движений, — рассказала доктор.
Тяжесть в животе после еды или повышенное газообразование доставляют немало дискомфорта. Исследования ЖКТ могут не выявить значимых отклонений, значит дело в вегетативной нервной системе. По словам Беленко, ветви симпатических и парасимпатических нервов обеспечивают работу каждого отдела, от глотки и пищевода, до прямой кишки, и необходимо разобраться, что выводит их из строя.
Не стоит игнорировать и раннее пробуждение, а также нарушения сна. Работа вегетативной нервной системы подчинена фазам смены времени суток. При ее дисфункции возникает постоянно высокий тонус работы симпатического отдела, что и приводит к отсутствию полноценного, восстанавливающего сна.
Работа вегетативной нервной системы подчинена фазам смены времени суток. При ее дисфункции возникает постоянно высокий тонус работы симпатического отдела, что и приводит к отсутствию полноценного, восстанавливающего сна.
Хроническая усталость, ощущения упадка сил уже с самого утра могут свидетельствовать о недостатке витаминов и микроэлементов, а также о проблемах с щитовидной железой. Но вероятны и нарушения неврологического свойства.
Беленко отметила, что перечисленные симптомы не смертельны, но они серьезно снижают качество жизни.
— С такими проблемами можно прожить долго, только вопрос — насколько счастливо. Вегетативная нервная система обеспечивает работу всех внутренних органов, а также обеспечивает адаптацию организма к различным нагрузкам, воздействию окружающей внешней среды. При воздействии экстремальных стрессов, работа вегетативной нервной системы нарушается. Как следствие нарушается работа внутренних органов, — предупредила доктор.
Вегетативная нервная система
Центробежные нервные волокна делятся на соматические и вегетативные.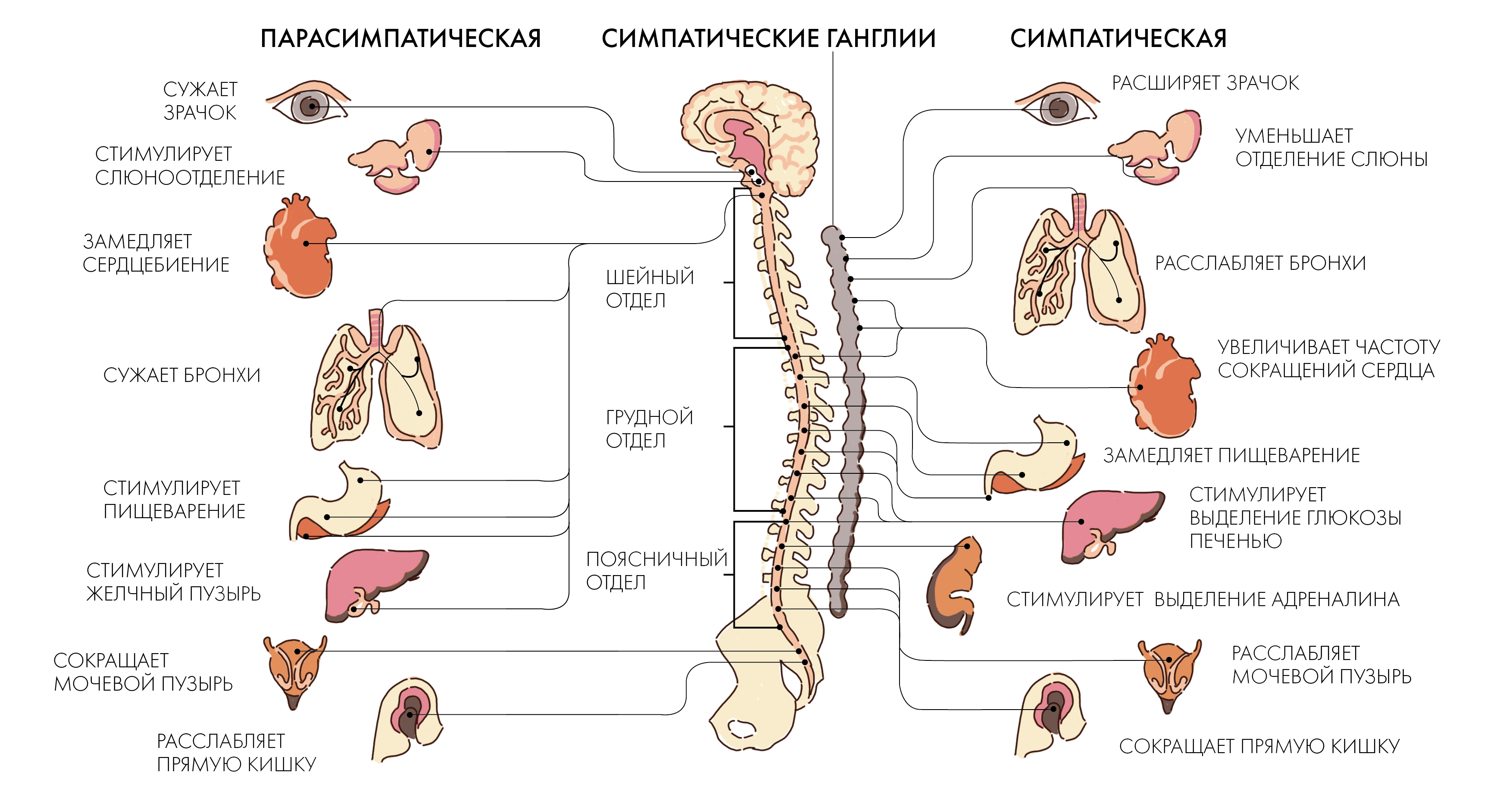
Соматические нервная система проводят импульсы к скелетным поперечнополосатым мышцам, вызывая их сокращение. Соматическая нервная система осуществляет связь организма с внешней средой: воспринимает раздражение, регулирует работу скелетных мышц и органов чувств, обеспечивает разнообразные движения в ответ на раздражения, воспринимаемые органами чувств.
Вегетативные нервные волокна являются центробежными и идут к внутренним органам и системам, ко всем тканям организма, образуя вегетативную нервную систему.
Функция вегетативной нервной системы заключается в регулировании физиологических процессов в организме, в обеспечении приспособления организма к меняющимся условиям среды. Центры вегетативной нервной системы расположены в среднем, продолговатом и спинном мозге, а периферическая часть состоит из нервных узлов и нервных волокон, иннервирующих рабочий орган.
Вегетативная нервная система состоит из двух частей: симпатической и парасимпатической.
Симпатическая часть вегетативной нервной системы связана со спинным мозгом, от 1-го грудного до 3-го поясничного позвонка.
Парасимпатическая часть залегает в среднем продолговатом отделе головного и крестцовом отделе спинного мозга.
Большинство внутренних органов получают двойную вегетативную иннервацию, так как к ним подходят как симпатические, так и парасимпатические нервные волокна, которые функционируют в тесном взаимодействии, оказывая на органы противоположный эффект. Если первые, например, усиливают какую-либо активность, то вторые ослабляют ее, что показано в таблице.
| Орган | Действие симпатических нервов | Действие парасимпатических органов |
| 1 | 2 | 3 |
| Сердце | Усиление и учащение сердечных сокращений | Ослабление и замедление сердечных сокращений |
| Артерии | Сужение артерий и повышение кровяного давления | Расширение артерий и понижение кровяного давления |
| Пищеварительный тракт | Замедление перистальтики, уменьшение активности | Ускорение перистальтики, повышение активности |
| Мочевой пузырь | Расслабление пузыря | Сокращение пузыря |
| Мускулатура бронхов | Расширение бронхов, облегчение дыхания | Сокращение бронхов |
| Мышечные волокна радужной оболочки | Расширение зрачка | Сужение зрачка |
| Мышцы, поднимающие волосы | Поднятие волос | Прилегание волос |
| Потовые железы | Усиление секреции | Ослабление секреции |
Симпатическая нервная система усиливает обмен веществ, повышает возбудимость большинства тканей, мобилизует силы организма на активную деятельность.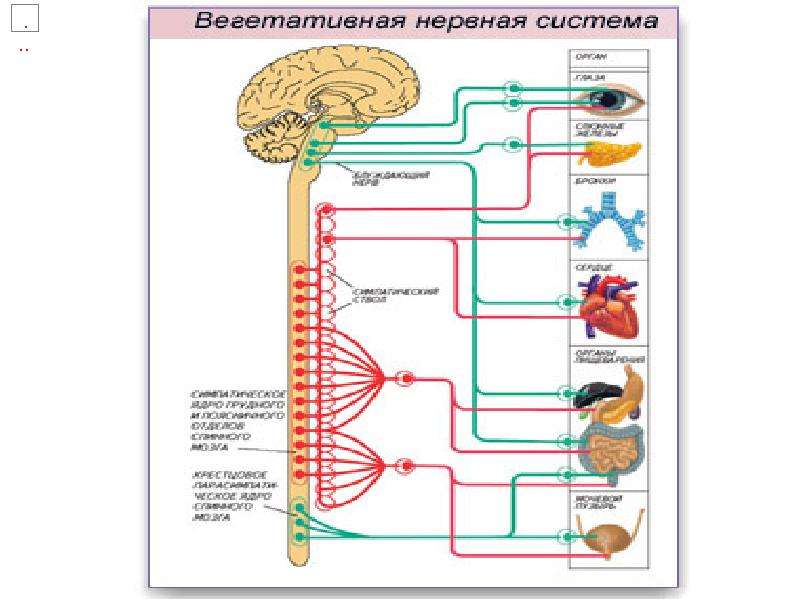 Парасимпатическая нервная система способствует восстановлению израсходованных запасов энергии, регулирует жизнедеятельность организма во время сна.
Парасимпатическая нервная система способствует восстановлению израсходованных запасов энергии, регулирует жизнедеятельность организма во время сна.
Вся деятельность вегетативной (автономной) нервной системы регулируется подбугровой областью — гипоталамусом промежуточного мозга, связанного со всеми отделами центральной нервной системы и с железами внутренней секреции.
Гуморальная регуляция функций организма — древнейшая форма химического взаимодействия клеток организма, осуществляемая продуктами обмена веществ, которые разносятся кровью по всему телу и оказывают влияние на деятельность других клеток, тканей, органов.
Основными факторами гуморальной регуляции являются биологически активные вещества — гормоны, которые выделяются эндокринными железами (железами внутренней секреции), образующими в организме эндокринную систему. Эндокринная и нервная системы тесно взаимодействуют в регуляторной деятельности, отличаясь лишь тем, что эндокринная система контролирует процессы, протекающие сравнительно медленно и длительно.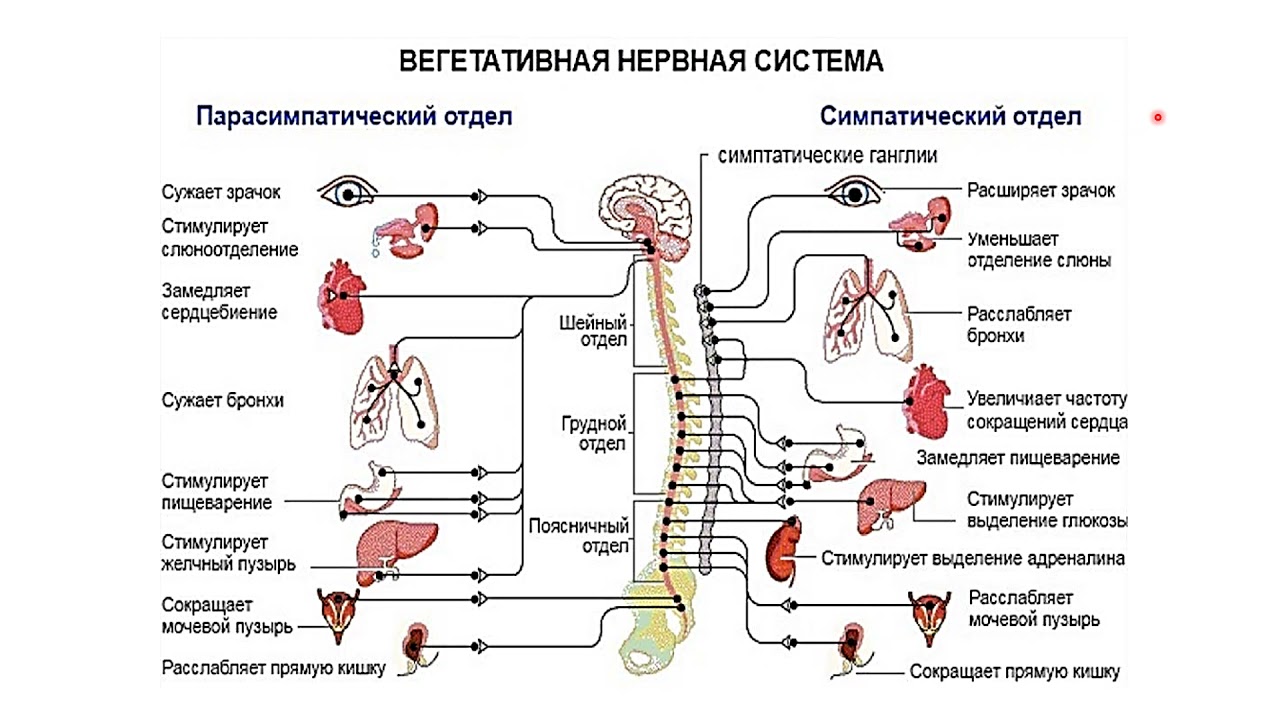 Нервная система управляет быстрыми реакциями, чья длительность может измеряться миллисекундами.
Нервная система управляет быстрыми реакциями, чья длительность может измеряться миллисекундами.
Гормоны вырабатываются особыми железами, богато снабженными кровеносными сосудами. Эти железы не имеют выводных протоков, и их гормоны поступают непосредственно в кровь, а затем разносятся по всему телу, осуществляя гуморальную регуляцию всех функций: они возбуждают или угнетают деятельность организма, влияют на его рост и развитие, изменяют интенсивность обмена веществ. В связи с отсутствием выводных протоков эти железы называются железами внутренней секреции, или эндокринными, в отличие от пищеварительных, потовых, сальных желез внешней секреции, имеющих выводные протоки.
К железам внутренней секреции относятся: гипофиз, щитовидная железа, околощитовидные железы, над почечники, эпифиз, островковая часть поджелудочной железы, внутрисекреторная часть половых желез.
Железы внутренней секреции
Гипофиз — нижний мозговой придаток, одна из центральных желез внутренней секреции.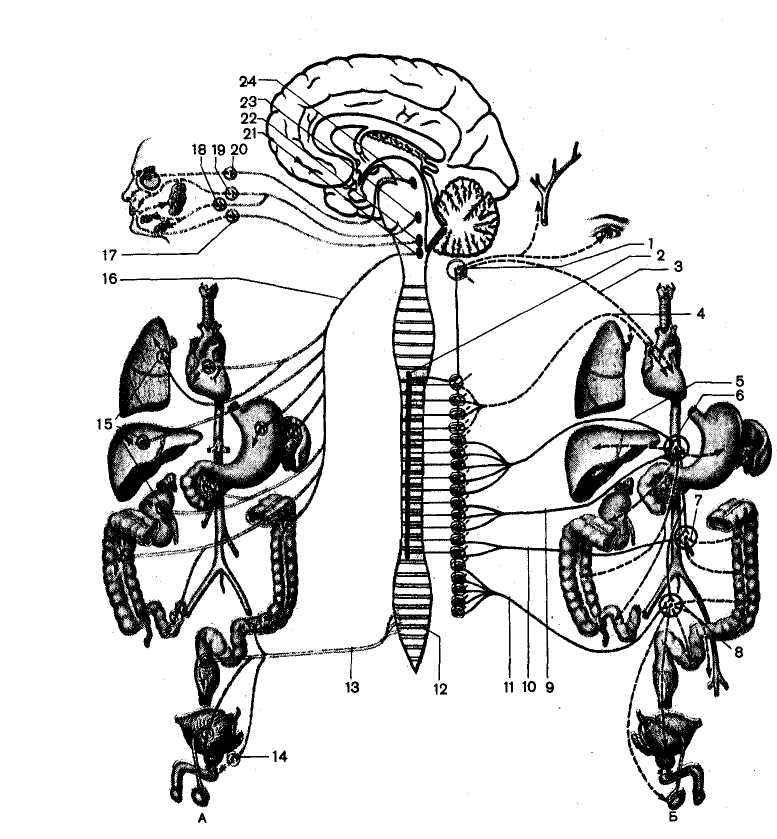 Гипофиз состоит из трех долей: передней, средней и задней, окруженных общей капсулой из соединительной ткани.
Гипофиз состоит из трех долей: передней, средней и задней, окруженных общей капсулой из соединительной ткани.
Один из гормонов передней доли оказывает влияние па рост. Избыток этого гормона в молодом возрасте сопровождается резким усилением роста — гигантизм, а при повышенной функции гипофиза у взрослого, когда рост тела прекращается, наступает усиленный рост коротких костей: предплюсны, плюсны, фаланг пальцев, а также мягких тканей (языка, носа). Такая болезнь называется акромегалией. Повышенная функция передней доли гипофиза приводит к карликовому росту. Гипофизарные карлики пропорционально сложены и нормально умственно развиты. В передней доле гипофиза образуются также гормоны, влияющие на обмен жиров, белков, углеводов. В задней доле гипофиза вырабатывается гормон, снижающий скорость образования мочи и изменяющий водный обмен в организме.
Щитовидная железа лежит поверх щитовидного хряща гортани, выделяет в кровь гормоны, в состав которых входит йод. Недостаточная функция щитовидной железы в детском возрасте задерживает рост, умственное и половое развитие, развивается болезнь кретинизм.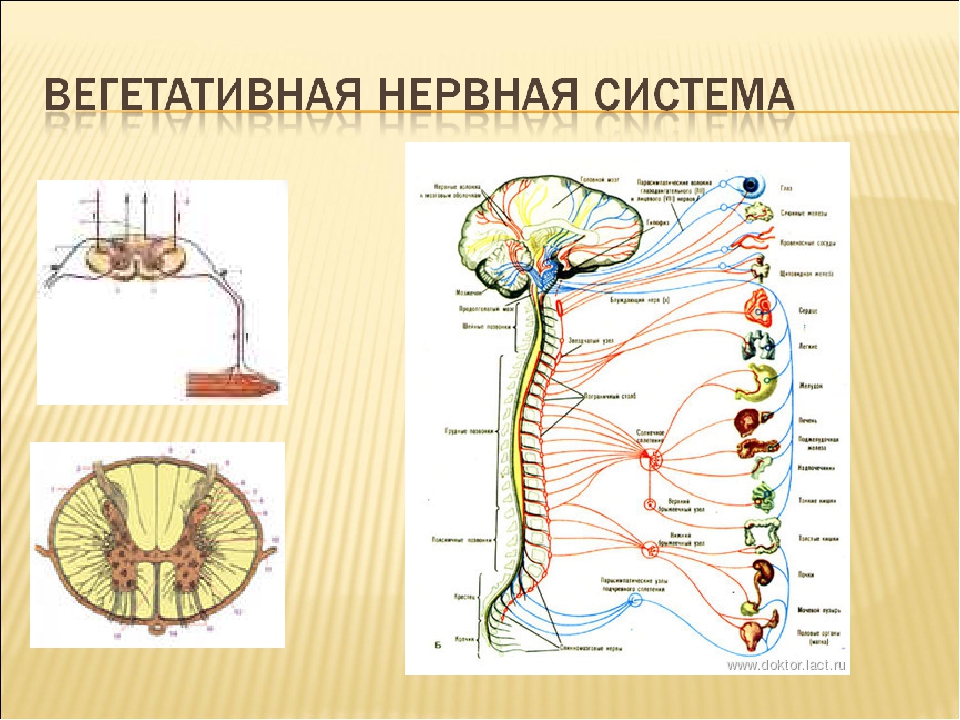 В другие периоды это приводит к снижению обмена веществ, при этом нервная деятельность замедляется, развиваются отеки, проявляются признаки тяжелого заболевания, называемого микседемой. Избыточная деятельность щитовидной железы приводит к базедовой болезни. Щитовидная железа при этом увеличивается в объеме и выступает на шее в виде зоба.
В другие периоды это приводит к снижению обмена веществ, при этом нервная деятельность замедляется, развиваются отеки, проявляются признаки тяжелого заболевания, называемого микседемой. Избыточная деятельность щитовидной железы приводит к базедовой болезни. Щитовидная железа при этом увеличивается в объеме и выступает на шее в виде зоба.
Эпифиз (шишковидная железа) — мелких размеров, расположен в промежуточном мозге. Изучен еще недостаточно. Предполагается, что гормоны эпифиза тормозят выделение гормонов роста гипофизом. Ее гормон — мелатонин влияет на пигменты кожи.
Надпочечники — парные железы, расположенные у верхнего края почек. Их масса около 12 г каждая, вместе с почками они покрыты жировой капсулой. В них различают корковое, более светлое вещество, и мозговое, темное. Они вырабатывают несколько гормонов. В наружном (корковом) слое образуются гормоны — кортикостероиды, оказывающие влияние на солевой и углеводный обмен, способствующие отложению гликогена в клетках печени и поддерживающие постоянную концентрацию глюкозы в крови.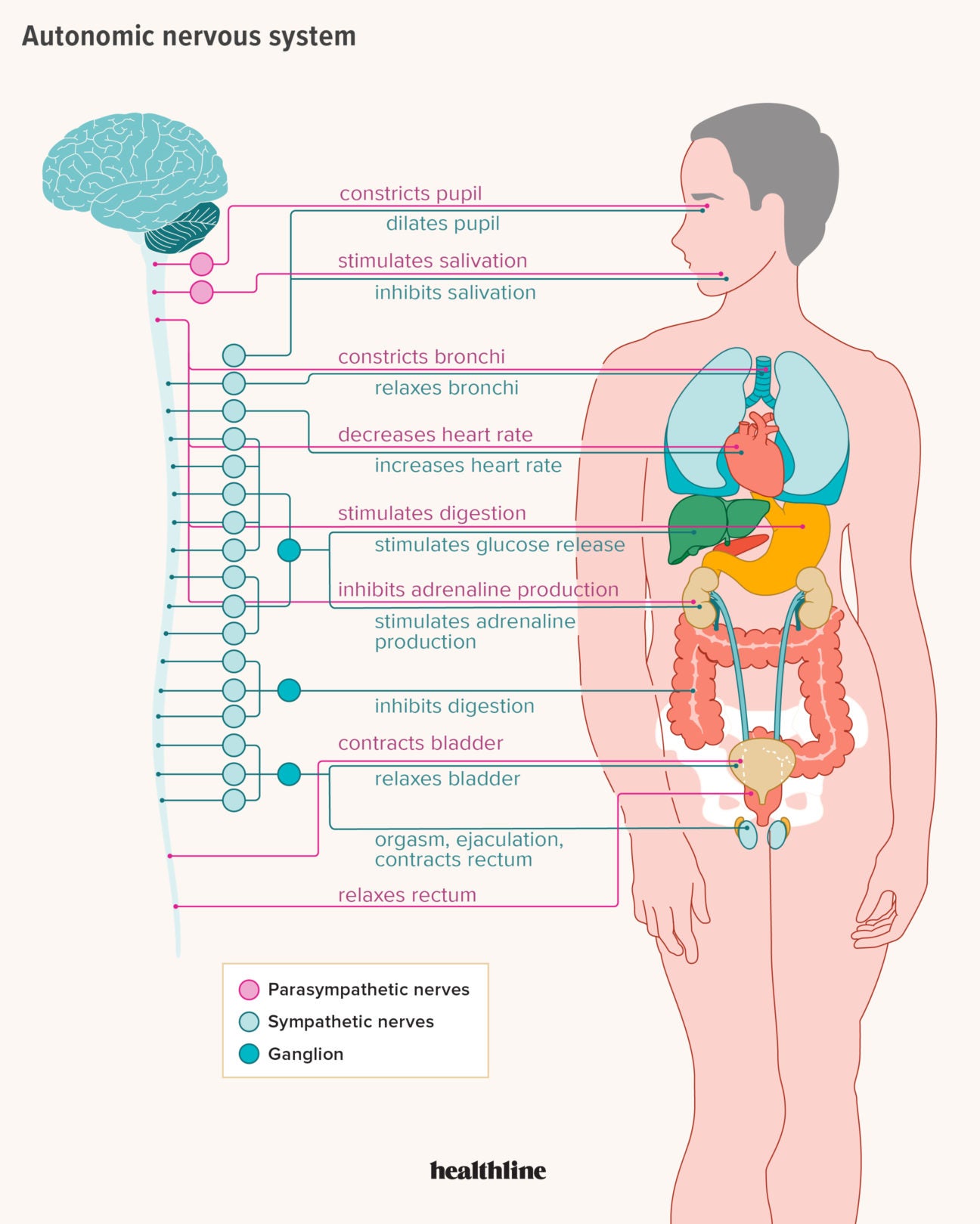 При недостаточной функции коркового слоя развивается Аддисонова болезнь, сопровождающаяся мышечной слабостью, одышкой, потерей аппетита, уменьшением концентрации в крови сахара, понижением температуры тела. Характерный признак такого заболевания — бронзовый оттенок кожи.
При недостаточной функции коркового слоя развивается Аддисонова болезнь, сопровождающаяся мышечной слабостью, одышкой, потерей аппетита, уменьшением концентрации в крови сахара, понижением температуры тела. Характерный признак такого заболевания — бронзовый оттенок кожи.
В мозговом слое надпочечников вырабатывается гормон — адреналин. Его действие многообразно: он увеличивает частоту и силу сердечных сокращений, повышает кровяное давление, усиливает обмен веществ, особенно углеводов, ускоряет превращение гликогена печени и работающих мышц в глюкозу, в результате чего работоспособность мыши восстанавливается.
Поджелудочная железа функционирует как смешанная железа. Вырабатываемый ею поджелудочный сок по выводным протокам попадает в двенадцатиперстную кишку и принимает участие в процессе расщепления питательных веществ. Это внешнесекреторная функция. Внутрисекреторную функцию выполняют особые клетки (островки Лангерганса), не имеющие выводных протоков и выделяющие гормоны прямо в кровь. Один из них — инсулин — превращает избыток глюкозы в крови в животный крахмал гликоген и понижает уровень сахара в крови. Другой гормон — глюкоген — действует на углеводный обмен противоположно инсулину. При его действии происходит процесс превращения гликогена в глюкозу. Нарушение процесса образования инсулина в поджелудочной железе вызывает болезнь — сахарный диабет.
Один из них — инсулин — превращает избыток глюкозы в крови в животный крахмал гликоген и понижает уровень сахара в крови. Другой гормон — глюкоген — действует на углеводный обмен противоположно инсулину. При его действии происходит процесс превращения гликогена в глюкозу. Нарушение процесса образования инсулина в поджелудочной железе вызывает болезнь — сахарный диабет.
Половые железы являются также смешанными железами, образующими половые гормоны.
В мужских половых железах — семенниках — развиваются мужские половые клетки — сперматозоиды и вырабатываются мужские половые гормоны (андрогены, тестостерон). В женских половых железах — яичниках — содержатся яйцеклетки, вырабатывающие гормоны (эстрогены).
Под действием гормонов, выделяемых в кровь семенниками, происходит развитие вторичных половых признаков, характерных для мужского организма (волосяной покров на лице — борода, усы, развитый скелет и мускулатура, низкий голос).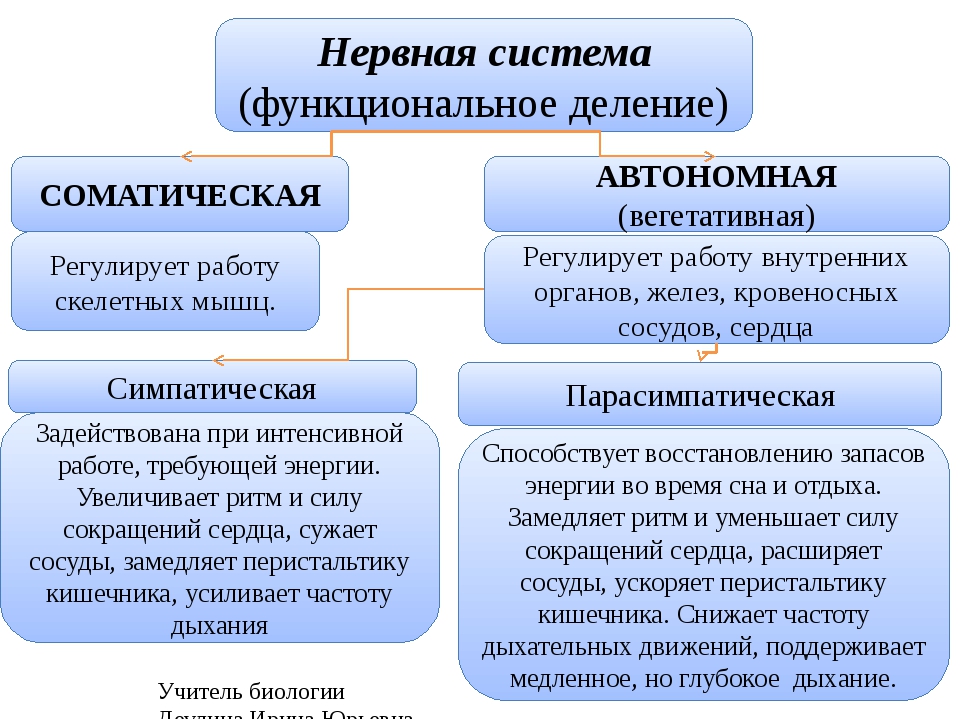
Гормоны, образующиеся в яичниках, влияют на формирование вторичных половых признаков, характерных для женского организма (отсутствие волосяного покрова на лице, более тонкие, чем у мужчины, кости, отложение жира под кожей, развитые молочные железы, высокий голос).
Деятельность всех желез внутренней секреции взаимосвязана: гормоны передней доли гипофиза способствуют развитию коркового вещества надпочечников, усиливают секрецию инсулина, влияют на поступление в кровь тироксина и на функцию половых желез.
Работу всех желез внутренней секреции регулирует центральная нервная система, в которой находится ряд центров, связанных с функцией желез. В свою очередь гормоны влияют на деятельность нервной системы. Нарушение взаимодействия этих двух систем сопровождается серьезными расстройствами функций органов и организма в целом.
Следовательно, взаимодействие нервной и гуморальной системы следует рассматривать как единый механизм нейрогуморальной регуляции функций, обеспечивающей целостность человеческого организма.
Саморегуляция в условиях стресса
ГлавнаяО проектеНовостиСаморегуляция в условиях стресса24.08.2020
Наша жизнь проходит в условиях неопределенности, риска, давления времени и обстоятельств. Поэтому управление своим стрессом, эмоциональным состоянием и жизненным тонусом — это ключевой навык, определяющий профессиональную эффективность личности. На вебинаре с преподавателем тибетской йоги и цигун Алексеем Щавелёвым мы изучили технологии саморегуляции и практики для поддержания биологической молодости. Основные итоги вебинара собрали для вас в этом материале.
ПОЧЕМУ СТРЕСС — НАШ ДРУГ И КАК ОН МОЖЕТ НАС УБИТЬ
Полюбите стресс. Это адаптивная реакция организма, которая дает нам доступ к энергетическим ресурсам. Благодаря стрессу мы спасаемся от опасности, в критической ситуации он сохраняет жизнь. А во время среднего стресса мы достигаем максимальной эффективности.
При это на стресс мы тратим огромное количество биологических ресурсов и нервной энергии. Если мы не можем им управлять, он превращается в нашего убийцу. Да, от психосоматических заболеваний, которые порождает хронический стресс, можно умереть! Но мы научимся оборачивать стресс в свою пользу, восстанавливать энергетические ресурсы и всю энергию мобилизации направлять на достижение цели.
Если вы руководитель, держать стресс под контролем особенно важно. Есть такой анекдот. Полковники никогда не бегают: в мирное время это смешно, а в военное — приводит к панике подчиненных. Так и с любым лидером: он должен продуктивно и целесообразно действовать, использовать стресс для решения проблемы, а не для пустых эмоций.
Никогда не верьте первой стрессовой реакции! Выбор мозга — что опасно, а что неопасно — ненадежен. Нужно проверить информацию, понять свои цели в ситуации и определить ресурсы. Конечно, в сложной ситуации хочется опустить руки и просто паниковать. Но стресс поможет, только если волевым усилием направить его куда-то. Если вы этого не сделаете, реакции организма будут примитивными: бей, беги или замри. Но большинство современных стрессовых ситуаций требуют совсем другого! Для них важно присутствие духа — умение не отключать те зоны мозга, которые отвечают за рациональный контроль ситуации и волевые действия.
БИОЛОГИЯ СТРЕССА
Стресс опасен для здоровья, так как в нем участвует весь организм. Независимо от того, боретесь ли вы за жизнь на корабле в шторм или переживаете из-за квартального отчета в теплом офисе.
Стресс — это автоматика мозга. В нейронной сети гиппокампа — одной из частей лимбической системы головного мозга — хранится информация обо всех опасностях в нашей жизни. Причем и та, которую мы лично не пережили, а о которой просто услышали, прочитали и которую увидели. Когда возникает стимул внешней среды, мозг прогоняет его по этой базе данных. Если мозг распознал ситуацию как опасную, он передает информацию в миндалевидное тело. Оно запускает стрессовую реакцию, дает организму сигнал о мобилизации. Через 250 миллисекунд об этом узнаем и мы.
Представьте: вы сидите на работе, приходит важное письмо. Вы открыли его и вдруг насторожились. Ваш взгляд что-то заметил, и вам стало тревожно, хотя еще даже не прочитали письмо. Это ваш мозг заметил какую-то знакомую деталь и распознал ее как опасность. Когда вы прочитаете письмо, в нем может не оказаться ничего плохого, это была просто негативная ассоциация мозга.
Наш мозг управляет внутренними органами через цепи автономной нервной системы. Все органы окружены двумя типами нервов: симпатическими и парасимпатическими.
Симпатическая нервная система — это педаль газа вашего организма. Она активизируется во время стресса, помогает быстро что-то сделать, увеличивает скорость обменных процессов.
Парасимпатическая нервная система — педаль тормоза в организме. Она поддерживает гомеостаз.
Чем сильнее вы газуете, тем лучше у вас должен быть тормоз! Если дисбаланс между газом и тормозом длительный, возникнет состояние нервного истощения.
Вот мозг определил, что стимул стрессовый, и запустил работу миндалевидного тела. Тут же выделяется мозговой норадреналин — передается нейрохимический импульс и запускается обвальная реакция по организму. Начинает работу симпатическая нервная система.
- моментально расширяется зрачок,
- уменьшается выделение слюны,
- расширяются бронхи,
- дыхание становится интенсивным,
- увеличивается частота сокращений сердца,
- стимулируется выделение глюкозы печенью,
- стимулируется выделение адреналина,
- замедляется пищеварение — желудок временно перестает переваривать пищу,
- расслабляется мочевой пузырь,
- сокращается прямая кишка.
Организм уже не тратит энергию на процессы гомеостаза. Он готов отразить опасность или убежать от нее.
Если стресс разовый, эти процессы проходят нормально. А если хронический?
Страдает желудок. В нашем желудке находится соляная кислота. Чтобы он не переварил себя, специальные клетки в слизистой выделяют защитный гель. При хроническом стрессе спазмируются микрокапилляры, пронизывающие слизистую, клетки работают плохо, гель получается разбавленным. Развивается неинфекционный гастрит и затем — язва. При хроническом стрессе пища уже не обрабатывается соляной кислотой, не всасывается через стенки кишечника и превращается в каловые камни. Может начаться дивертикулез кишечника.
ГОРМОНЫ
Импульс по нервным волокнам доходит до органов эндокринной системы — надпочечников. Они вырабатывают большое количество гормонов, которые участвуют в стрессовой мобилизации.
В отличие от нейротрансмиттеров, которые передают электрохимический сигнал через нервное волокно от нейрона к нейрону, гормоны выделяются прямо в кровь, как жидкость.
Три из них стоит запомнить:
Адреналин отвечает за реакцию «беги».
Сердце начинает выпрыгивать из груди. Резко и неравномерно спазмируются сосуды — в них увеличивается давление. Микрокапилляры, пронизывающие внутренние органы, — в спазме, им не хватает крови, ведь она направлена туда, где другой тип рецепторов, — в большие мышцы. Ощущаете жар внутри во время стресса? Это кровь эвакуировалась в большие мышцы, чтобы дать вам быстро отреагировать и убежать.
Начинается гипоксия (кислородное голодание) органов. Когда вы набираете в легкие воздуха — это еще не дыхание, это газообмен. Дыхание — это когда кровь доставляет эритроциты с молекулами кислорода в митохондрии клеток и там происходит цикл Кребса и производство аденозинтрифосфата.
Внутренние органы начинают сигналить в мозг, чтобы он увеличил давление. После этого сосуды еще больше сжимаются, становятся твердыми, наращивают плотность оболочки. Результат — гипертония. Это частое заболевание современных управленцев.
Слышали про адреналиновую зависимость? Это миф. Если человеку вколоть адреналин, он почувствует холод в руках и ногах, сильно застучит его сердце. Повторения точно не захочется. Почему же возникает зависимость в экстремальных видах спорта? Во время предельного стресса мозг начинает готовить нас к тому, что у нас будет травма. Чтобы мы не умерли от болевого шока, выделяются анальгетики — эндогенные опиоиды. Например, эндорфин. Когда вы прыгнули с парашютом и чувствуете эйфорию — это работают анальгетики. Зависимость наступает вовсе не от адреналина, а от анальгетиков.
Норадреналин отвечает за реакцию «нападай», мобилизует мускулатуру.
Кортизол отвечает за реакцию «замри».
Этот гормон резко увеличивает глюкозу в крови — он переводит в сахар гликоген. Когда гликоген заканчивается, он берется за жировые и мышечные ткани.
Кортизол держит наш сахар высоким, что рано или поздно приводит к сахарному диабету. Также постоянно выделяется инсулин. Клетки рано или поздно убирают рецепторы, которые реагируют на инсулин; теперь глюкоза не попадает в клетки, ее много в крови, и возникает гликированный гемоглобин, который разрушает сосуды.
При длительном стрессе кортизол уничтожает органы, отвечающие за иммунитет: например, вилочковую железу, которая производит тимусзависимые лимфоциты, маркирующие клетки, зараженные вирусом. Во время долгого стресса человек теряет иммунитет. При разовом стрессе иммунитет, наоборот, повышается.
После стресса организм включает парасимпатику. Вы в безопасности, мозг оттормаживается, выделяет специальный нейротрансмиттер — ацетилхолин.
- зрачки сужаются,
- стимулируется слюноотделение и пищеварение,
- дыхание приходит в норму,
- мышцы расслабляются,
- давление падает,
- стабилизируется уровень стрессовых гормонов.
Организм постепенно уходит в грезоподобное состояние и затем — в глубокий сон. Нам кажется, что во время сна мы просто выключены. Нет, у нас нажата педаль тормоза. Специальные нейрогормоны обеспечивают восстановление сил. Один из них наверняка вам известен — это мелатонин.
НАРУШЕНИЕ БАЛАНСА
Все наши состояния зависят от выброса определенных веществ мозгом и железами эндокринной системы. Например, наша вовлеченность и мотивация связаны с выбросом дофамина. Когда его мало, наступает апатия.
Помните: если вы не переключаетесь, не нажимаете «тормоз», то доводите себя до нервного истощения: нейроны мозга перестают выделять нужные вещества в нужном количестве, а вы не получаете удовольствия от жизни и теряете мотивацию в работе.
Эмоциональное выгорание внесено в список заболеваний ВОЗ. Но это скорее не заболевание, а синдром! За ним могут стоять и психоэмоциональные травмы, и истощение от хронического стресса. Человек медленно думает, плохо принимает решения и кричит на людей? Нет, это не эмоциональное выгорание, это неврастения. Те, кому не нравится этот термин, говорят про эмоциональное выгорание. Для более крупных руководителей придумали еще один термин: стратегическая усталость. И ее тоже не существует. Принимаете неправильные решения, срываетесь на людей? Это не усталость, это неврастения.
ЧТО ДЕЛАТЬ И КАК НАЙТИ БАЛАНС
Лучший способ восстановления — дыхательная гимнастика на основе гиперкапнии. Например, растянутое дыхание, когда уровень кислорода не падает, но уровень СО2 в крови растет. Мозг воспринимает это как угрозу и дает команду гладкой мускулатуре расширяться и спасать организм. Уже через пять минут растянутого дыхания у вас согреваются руки и ноги, розовеет лицо.
Для расслабления гладкой мускулатуры подходит добавка — аминокислота L-аргинин. В концентрированном виде в печени она быстро метаболизируется в оксид азота, который расширяет гладкую мускулатуру. Чтобы снять хронический спазм, достаточно принять на ночь три грамма L-аргинина на пустой желудок. Можно начать с одного грамма и довести до трех. Особенно важно принимать L-аргинин в период стрессовых нагрузок.
Если вы испытали стресс, сделайте дыхательную гимнастику и уберите спазмы L-аргинином. После нервного напряжения обязательна физическая нагрузка.
Можно ли расслабиться с помощью алкоголя?
Если вы не израсходовали гормоны стресса по назначению, они вас убивают. Худший вариант: понервничать на работе и выпить дома алкоголя. Физиологическая норма, которую может переработать организм, — 30-40 граммов в пересчете на чистый спирт. Это два бокала вина. Основная проблема — вовремя остановиться. От нескольких бокалов может наступить временное расслабление, и нам захочется еще.
После алкоголя капилляры и правда расширяются, но фермента в печени может не хватить на то, чтобы переработать алкоголь. Он попадает в кровь. Высокая концентрация спирта в крови обезжиривает эритроциты. Они лишаются оболочек и начинают склеиваться. В крови двигаются уже сгустки эритроцитов, которые кровь не переносит. Наутро нам плохо, ведь всю ночь организм пребывал в состоянии кислородного голодания.
Да, сосуды ненадолго расширились, но организм все равно пострадал. Так что не больше двух бокалов вина за ужином! За любую внешнюю поддержку организма приходится расплачиваться. Лучше полагаться на методы саморегуляции.
СИМПТОМЫ ХРОНИЧЕСКОГО ВЕГЕТАТИВНОГО НАПРЯЖЕНИЯ
Как понять проблему? Разовый стресс заметить легко. А вот к хроническому мы привыкаем, психика больше его не замечает, человек забывает, что такое жить без стресса.
Оцените, насколько каждый из этих симптомов характерен для вас за последние две недели. Поставьте 3 балла, если симптом ярко проявлялся; 2 балла — был, но в средней степени; 1 балл — проявлялся слабо; 0 — не было симптома.
- Спазм сосудов и капилляров: холод в руках и ногах, бледные кожные покровы, гипертония. Особенно обращайте внимание на нижнее давление: если оно высокое, сосуды находятся в спазме.
- «Мышечная броня». Напряжена поперечно-полосатая мускулатура: бицепсы, трицепсы. При нажатии на мышцы вы чувствуете боль, не можете расслабиться перед сном.
- Хроническая усталость, низкий уровень энергии. Нормальная усталость накапливается к вечеру, но когда вы поели, поспали, отдохнули — она проходит. Если вы устали уже с утра — это звоночек.
- Головокружение, плохая концентрация и память.
- Плохое пищеварение, гастрит, язва. Когда вы съели правильную пищу, не фаст-фуд, а в желудке все равно тяжесть — это признак стресса.
- Снижение иммунитета. Измерьте его за три месяца. Болезни длятся долго, развиваются хронические заболевания, может появиться герпес.
- Снижение качества сна. Более 20 минут не можете заснуть, сон неглубокий, есть ощущение работающей головы, утром тяжело просыпаться.
- Ангедония — неспособность получить удовольствие от простых вещей: развлечений, еды, сна.
- Дисфория — длительное беспричинное расстройство настроения, тревожность, раздражение на других людей, агрессия.
- Аддиктивное, или зависимое, поведение — уход от реальности с помощью искусственного изменения психического состояния. Например, табакокурение, алкоголизм, переедание, интернет-зависимость и т. д.
(Как оценить, что у вас есть зависимость. Что будет, если лишить вас этого объекта: алкоголя, компьютерной игры, табака, кофе? Изменится ли ваше настроение, поведение, сможете ли вы провести без этого долгое время?)
Если вы набрали до 10 баллов, баланс между газом и тормозом у вас есть.
Если у вас от 10 до 20 баллов, вы тратите больше энергии, чем способны восстановить.
Если вы набрали более 20 баллов, то у вас хронический стресс, парасимпатика не работает.
- Сдайте тест на стрессовые гормоны. Например, повышенный кортизол говорит либо о стрессе, либо о синдроме Кушинга.
- Обращайте внимание на изменение вариабельности сердечного ритма. У здорового человека временные интервалы между ударами сердца всегда разные на миллисекунды. Если ваше сердце застучало, как метроном, — организм истощился или заболел.
ДЫХАТЕЛЬНАЯ ГИМНАСТИКА
Дышите через нос. Закройте глаза. Положите одну руку на живот, вторую — на грудь. Начните дышать животом, плавно наполните воздухом низ легких, затем раскройте грудную клетку и заполните воздухом все легкие под ключицы. Так вы опустите диафрагму и наполните кровь углекислотой. Сделайте плавный долгий выдох. Сразу же вдыхайте снова.
Сконцентрируйте внимание на дыхании. Не дышите на автомате. Пусть ум мгновение за мгновением распознает, как происходит дыхание. Отпустите внешний стимул или внутренние мысли, возвращайте внимание на дыхание.
Как только начала двигаться диафрагма, стимулировался блуждающий нерв, который переключает вас на парасимпатическое управление. Растянутый вдох и выдох наполняют кровь кислородом и одновременно — углекислотой.
Наберите в легкие воздуха и задержите дыхание. Голову уроните безвольно на грудь, перекатите назад, сделайте круг головой. Откиньте голову назад, сделайте акцент на прогибе в грудных позвонках, поднимайте голову и медленно выдыхайте.
Так перекрывается ток крови в мозг, и он начинает выделять эндогенные опиоиды. Достаточно сделать так 3-4 раза, и опиоиды восстановятся.
МЕДИТАТИВНАЯ ПРАКТИКА ДЛЯ ЕЖЕДНЕВНОЙ САМОРЕГУЛЯЦИИ
Сядьте, выпрямите спину, почувствуйте устойчивость тела. Положите руки на колени ладонями кверху. Тяните макушку кверху: должно быть ощущение, что между позвонками будто увеличивается расстояние. Тело расслаблено, спина прямая.
Закройте глаза. Перенесите свое внимание на ступни. Какой температуры ваши ноги? Как они чувствуют поверхность? Не думайте про стопы, а просто наблюдайте за тем, что чувствуете.
Плавно перенесите свое внимание на кисти рук. Что чувствуют ваши кончики пальцев, середина ладоней?
Захватите вниманием все свое тело. Чувствуйте ноги, руки, туловище и голову. Почувствуйте скелет и внутренние органы. Как меняются ощущения под вашим наблюдением? Тело начинает тяжелеть, мышцы расслабляются. Непрерывно наблюдайте свое тело. Если вы заметили мысль, сразу возвращайтесь от нее к наблюдению.
Направьте внимание в свой ум. Замечайте появление мысли, образа, картинки и отпустите. Если одна мысль ушла, а второй нет, оставайтесь в паузе. Не давите свои мысли, вам не удастся от них избавиться. Просто возвращайтесь к наблюдению, и ум сам успокоится. Чтобы успокоить воду в стакане, не нужно раскачивать его в руке. Просто не трогайте стакан, и жидкость сама успокоится.
Как понять, что вы медитируете:
- Луч внимания направлен на один объект.
- Вы осознаете объект мгновение за мгновением непрерывно.
- Вы всегда понимаете, в каком тонусе ваше внимание. Вы можете его возвращать и усиливать.
- Постепенно исчезает ментальная активность — между мыслями появляются паузы.
- Наступает физическая и психическая расслабленность.
Возврат к списку
Вегетативная нервная система – Анатомия, физиология и гигиена человека – Kaz-Ekzams.ru
admin 23.07.2010
Вегетативная нервная система регулирует деятельность внутренних органов и процессов обмена веществ. Ее центры расположены в среднем, продолговатом и спинном мозге, а периферическая часть состоит из нервных узлов и нервных волокон, иннервирующих рабочий орган. Характерной особенностью вегетативных нервов является их двухнейронное строение.
От тела первого нейрона, расположенного в центральной нервной системе, отходит длинный отросток (аксон), образующий предузловое волокно. Оно переключается на второй нейрон, находящийся в периферическом нервном узле, от которого отходит послеузловое волокно к иннервируемым органам. Особенностями вегетативных нервов является также и то, что они образованы безмякотными, т. е. лишенными изолирующей жироподобной оболочки, очень тонкими волокнами, которые проводят возбуждение во много раз медленнее, чем другие периферические нервы. Кроме того, деятельность вегетативной нервной системы не зависит от воли человека. В вегетативной нервной системе различают две части — симпатическую и парасимпатическую.
Симпатическая часть вегетативной нервной системы связана со средней частью спинного мозга, где находятся тела первых нейронов, отростки которых заканчиваются в нервных узлах двух симпатических цепочек, расположенных по обе стороны спереди позвоночника. В симпатических нервных узлах находятся тела вторых нейронов, отростки которых непосредственно иннервируют рабочие органы.
Парасимпатическая часть вегетативной нервной системы образована несколькими нервами, отходящими от продолговатого мозга и от нижнего отдела спинного мозга. Парасимпатические узлы, где находятся тела вторых нейронов, расположены в органах, на деятельность которых они влияют. Большинство органов иннервирует как симпатическая, так и парасимпатическая нервная система.
Симпатическая нервная система усиливает обмен веществ, повышает возбудимость большинства тканей, мобилизует силы организма на активную деятельность и осуществляет адаптационно-трофическую функцию. Парасимпатическая нервная система способствует восстановлению израсходованных запасов энергии, регулирует жизнедеятельность организма во время сна.
Орган | Влияние симпатического отдела | Влияние парасимпатического отдела |
| Сердце | Учащает ритм и увеличивает силу сокращений | Урежает ритм и уменьшает силу сокращений |
| Сосуды сердца | Расширяет | Сужает |
| Артерии | Сужает, повышает кровяное давление | Расширяет, понижает давление |
| Пищеварительный тракт | Замедляет перистальтику | Ускоряет перистальтику |
| Селезенка | Сокращает и изгоняет из нее кровь | Не влияет |
| Печень | Расслабляет желчные протоки и желчный пузырь, сужает сфинктер, что способствует накоплению желчи | Сокращает желчные протоки и расслабляет сфинктер, что способствует выходу желчи из желчного пузыря |
| Почки | Сужает сосуды и уменьшает диурез | Не влияет |
| Мочевой пузырь | Расслабляет пузырь и сокращает сфинктер | Сокращает пузырь и расслабляет сфинктер |
| Потовые железы | Усиливает секрецию | Не влияет |
| Мышечные волокна радужной оболочки глаза | Расширяет зрачок | Сужает зрачок |
| Мышцы, поднимающие волосы | Сокращает (волосы поднимаются) | Расслабляет (волосы прилегают к коже) |
Роль вегетативной нервной системы заключается в регуляции обмена веществ, возбудимости и автоматии периферических органов, а также самой центральной нервной системы. Вегетативная нервная система регулирует и изменяет физиологическое состояние тканей и органов, приспосабливая их к деятельности организма в условиях окружающей среды.
Органы чувств обеспечивают восприятие различных раздражений, действующих на организм, служат ему для взаимосвязи и приспособления к постоянно меняющимся условиям окружающего мира, для его познания. На основе показания органов чувств строятся разнообразные ощущения, они являются источниками наших представлений об окружающем мире.
Основными элементами, определяющими специфику органов зрения, слуха, обоняния, вкуса, кожной чувствительности, равновесия, являются специализированные рецепторы, преобразующие энергию определенных раздражителей в процесс возбуждения, который передается по соответствующим нервам в центральную нервную систему. В соответствующих каждому органу чувств зонах коры больших полушарий происходит окончательное различение, анализ раздражений, воспринимаемых особенно чувствительными к ним рецепторами.
Нервные аппараты, воспринимающие и анализирующие раздражения, поступающие из внешней и внутренней среды организма, И. П. Павлов назвал анализаторами. Рецепторы являются периферическим звеном анализатора. Центростремительные нейроны и проводящие пути от рецептора до коры больших полушарий составляют проводниковый отдел анализатора. Участки коры больших полушарий мозга, воспринимающие и анализирующие информацию от соответствующих рецепторов, составляют центральную часть анализатора. Все части анализатора действуют как единое целое. Нарушение деятельности одной из них вызывает нарушение функций всего анализатора.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Просмотров: 1 939
2.Основные структуры нервной системы. Нейрон как структурная единица нервной системы
Лекция. Структура нервной системы. Связь структуры с функциями. Когнитивные выходы. Теоретические основы. И. А. Мартынов.
Говоря о когнитологии и обсуждая вопросы познания, невозможно избежать затрагивания тех самых тонких аспектов деятельности нервной системы (физиологического субстрата как такового), ответственных за обеспечение процессов восприятия, хранения и анализа информации.
Но давайте разбираться во всём по порядку. Нервная система настолько сложное структурное образование, что существует большое множество классификаций, описывающих саму систему. В последние годы большинством авторов для удобства изучения нервная система подразделяется на центральную (головной и спинной мозг) и периферическую (черепно — и спинномозговые нервы, их сплетения и узлы), а также соматическую и вегетативную (или автономную).
Соматическая нервная система осуществляет преимущественно связь организма с внешней средой: восприятие раздражений, регуляцию движений поперечнополосатой мускулатуры скелета и др.
Вегетативная — регулирует обмен веществ и работу внутренних органов: биение сердца, перистальтическое сокращение кишечника, секрецию различных желез и т. п. Обе они функционируют в тесном взаимодействии, однако вегетативная система обладает некоторой самостоятельностью (автономностью), управляя многими непроизвольными функциями.
<?!> В действительности, со стороны природы было очень мудро пойти по такому пути, при котором функции регулирования внутренних органов и систем контролируются автоматически, не выходя на уровень сознательного контроля. Например, человек совсем не в состоянии сознательно регулировать тонкие мышечные сокращения в желудочно-кишечном тракте, сокращения сердца, или тонус сосудов стопы. Несомненно, здесь есть и свои исключения. Так, некоторые йоги действительно могут изменять (с помощью сознательного расслабления) тонус сосудов конечностей. С этим связан известный эффект отсутствия пульса на руке у йогов, породивший множество разговоров о том, что йоги умеют останавливать сердце. Йоги на самом деле могут управлять вегетативными процессами, но всё же до некоторых пределов. Это достигается многолетними тренировками по принципу обратной биологической связи, когда человек обучается получать активно сигнал от каждой части тела, от каждого органа и выводить эту информацию на уровень сознания. Но даже для таких людей существуют пределы — ограничения, установленные самой природой. На сегодняшний день нет научно засвидетельствованных фактов, говорящих о том, что йог или кто-либо другой может останавливать своё сердце, а потом запускать его. Таким образом, можно сказать, что вегетативная нервная система всё же является автоматической частью нервной системы и регулируется организмом без участия сознания. Единственный активный механизм воздействия на вегетативную систему — это дыхание. Именно с помощью дыхания можно влиять (косвенно) на вегетативные функции. К примеру, вполне возможно с помощью учащения дыхания изменить количество сердечных сокращений в минуту. Тогда получается, что вегетативная система не настолько уж и самостоятельна. Это вторая правда о нервной системе. Нервная система вообще весьма парадоксальна в своей физиологии. С помощью дыхания можно влиять на работу нервной системы, но всё равно в некоторых пределах. Поэтому тут нет противоречий.
Мне видится чрезвычайно важным для современного педагога понимание того, как тесно связано осознание работы вегетативной нервной системы с работой процессов сознания.
Говоря проще, важно понимать, что например, плотно поевший ученик совершенно не пригоден для обучения, поскольку происходит перераспределение тонуса мышц сосудов, кровь оттекает от головного мозга к пищеварительному тракту. Как следствие, мозг работает в экономичном режиме (некоторое время после приёма пищи) и не может организовать той интенсивности мыслительных процессов, которые так необходимы на уроке. Таким образом, не очень разумно ставить контрольные или другие варианты форм аттестации поле обеда в школе. Но зато уже где-то через 1,5 часа к мозговым структурам поступает достаточно большое количество глюкозы, и кровоток постепенно становится более интенсивным в самой нервной системе. Более того, также неразумно ставить первыми уроки физической культуры. Представьте себе ситуацию, в которой плотно позавтракавший школьник (большинство школьников до 8 класса принимают первый завтрак дома по настоянию родителей) побежит тройку – другую кругов в спортзале. Нормальное пищеварение сложно обеспечить в таких условиях. Как следствие возникает нарушение усвоения необходимых мозгу веществ, затем следует снижение физиологической активности мозга. В конечном итоге, дорогие коллеги, мы получаем не только несварение желудка у детей, но и отсутствие адекватной мыслительной деятельности из-за снижения активности мозговых структур. Конечно, многие из вас могут отшутиться и сказать, что есть ученики, на которых это никак не сказывается, они всегда плохо усваивают новый материал. Но давайте всё же отбросим нотки циничного юмора, и порассуждаем здраво на эту тему. Ведь на месте такого школьника могут оказаться и очень старательные дети. Выводы напрашиваются сами: необходимо очень внимательно относиться к выстраиванию расписания уроков для каждого конкретного класса, не только с учётом возраста обучающихся, но и с учётом приёмов пищи, уроков физической культуры, прогулок (если таковые имеются). Это может значительно облегчить жизнь и вам и вашим воспитанникам.
Другой не менее важной проблемой, связанной с деятельностью вегетативной нервной системы является проблема вегетативных расстройств у современных школьников. Речь идёт в первую очередь о вегетососудистой дистонии (или нейроциркуляторной дистонии, сосудистой дистонии). Диагноз вегетососудистая дистония ставится почти каждому городскому школьнику. В настоящее время ведутся активные обсуждения того, насколько вообще правомерно ставить такие диагнозы в клинике. По сути, это набор нарушений со стороны деятельности вегетативной нервной системы выражающийся в полисимптоматическом комплексе из более чем 100 различных симптомов. Не будем вдаваться в медицинские подробности вопроса, но лишь отметим, что подобные нарушения могут представлять из себя нарушение сна, головокружения, головные боли, повышенную утомляемость, беспричинную тошноту, расстройства пищеварения и др. симптомокомплесы. Отсюда напрашивается закономерный вопрос – а что с этим делать?
В действительности, эти проблемы только могут казаться ерундой и пустяками. Часто родители говорят детям, что это у всех, не переживай. Но на самом деле такие нарушения могут быть спровоцированы не только огромными умственными нагрузками в школе, но и серьёзными нарушениями со стороны систем органов, например, позвоночника. Было показано, что нарушения в области шейного отдела позвоночникамогут вызывать сужения артерий шеи, питающих головной мозг. Отсюда может возникать ощущение головокружения, скачки давления, бессонница и прочие неприятные симптомы. Обратите внимание: в таком случае дети не симулируют, им действительно плохо. Вот почему все учителя должны следить за правильной осанкой у школьников. Именно от осанки во многом зависит здоровье позвоночника и вегетативной нервной системы. Очень важными факторами, провоцирующими вегетативные расстройства, являются факторы умственного и психического напряжения. Это наводит на мысль, что 2-3 минутные перерывы во время самих уроков (например, с использованием разминки для пальцев пишущей руки) являются вполне оправданным. Стимулирование тонкой моторики пальцев рук позволяет в некоторой степени снять подобное напряжение. Это также может быть полезно и для самих учителей. Не пренебрегайте этими рекомендациями со стороны врачей.
Но что же делать, если ребёнку стало нехорошо во время урока? Именно здесь могут помочь техники правильного дыхания, успокаивающие вегетативную нервную систему в случае её перенапряжения. Такое может случиться, например, если ребёнок перенервничал. В моей практике была ученица, которая начинала делать сухие всхлипывания, то есть она как бы плакала, но без слёз, ей было тяжело остановиться. Это была реакция нервной системы на стресс. Такое с ней часто случалось перед контрольными работами. В таких ситуациях рекомендуется вывести ребёнка в рекреацию или в проветриваемое помещение. Затем попросите ребёнка сделать глубокий вдох и как будто протолкнуть воздух в живот — это будет вариантом активного брюшного дыхания. Ребёнок как бы выпячивает живот на вдохе и втягивает на выдохе. Так нужно сделать, сохраняя спокойное дыхание, 10 -15 вдохов. Это активирует парасимпатический отдел вегетативной нервной системы, который снижает частоту сердечных сокращений и успокаивает дыхание. После чего наступает успокоение. Если это не помогает, то, конечно же, отведите ребёнка в медицинский кабинет. Можно также дать рекомендации всем учителям прерываться на 2-3 минуты и предлагать детям спокойно подышать таким образом. Такие техники подробно описаны на многих медицинских порталах в Интернете. Это поможет успокоиться как вам, так и вашим ученикам. Для того, чтобы мотивировать учеников, объясните им, зачем это делается. Объясните, что это также способствует хорошему сну и улучшению мозгового кровообращения. Сначала ученики будут подшучивать над этим, но, как показывает практика, эффект не заставит себя ждать. Через две недели это может стать обыденным вариантом 2-3 минутного перерыва. Так, к примеру, когда-то делала моя учительница по английскому, занимавшаяся этим регулярно.
Но давайте всё же вернём к строению нервной системы и продолжим наш экскурс.
Мозг человека
Итак, головной мозг состоит из нескольких отделов: продолговатый мозг, задний мозг, средний мозг, промежуточный, конечный мозг.
Продолговатый мозг является продолжением спинного мозга. Он управляет вегетативными функциями организма, такими как дыхание, сердечная работа, пищеварение. В ядрах продолговатого мозга расположены центры пищеварительных рефлексов — слюноотделения, глотания, отделения желудочного или поджелудочного сока, и защитных рефлексов — кашля, рвоты, чихания. Также в продолговатом мозге находятся центры дыхания и сердечной деятельности.
Задний мозг состоит из варолиева моста и мозжечка. Мозжечок и мост являются единой структурой. Мост состоит из волокон, соединяющих полушария мозжечка. Мозжечок находится позади продолговатого мозга и моста, в затылочной части головы и отвечает за координацию движений, поддержание позы и равновесия тела.
Средний мозг — наименьший из всех пяти отделов. Средний мозг является продолжением моста. Средний мозг выполняет следующие функции: двигательную, сенсорную, его еще называют зрительным центром, и регулирующую продолжительности актов жевания и глотания.
Промежуточный мозг расположен впереди среднего мозга. Основной его функцией является участие в возникновении ощущений. Его части согласуют работу внутренних органов и регулируют вегетативные функции: обмен веществ, температуру тела, кровяное давление, дыхание, гомеостаз. Через него проходят все чувствительные пути к большим полушариям мозга. Промежуточный мозг подразделяется на:
• Таламический мозг;
• Гипоталамус;
• Третий желудочек, который является полостью промежуточного мозга.
Конечный мозг — самый крупный и развитый отдел головного мозга. Состоит из двух полушарий большого мозга(покрытых корой), мозолистого тела, полосатого тела и обонятельного мозга.
Поверхность конечного мозга складчата из-за массы борозд. Полушария разделяют на 4 основные доли (лобная, теменная, затылочная и височная).
Лобная доля связана с определением личностных качеств человека, а ее задней части подчинены все двигательные центры ствола и спинного мозга. Поэтому при ее поражении появляются параличи мышц. В теменной доле, в основном, формируются ощущения тепла, холода, прикосновения, положения частей тела в пространстве. Затылочная доля содержит зрительные центры, височная — слуховые и обонятельные.
Всю кору полушарий принято разделять на 4 типа: древняя (палеокортекс), старая (архикортекс), новая (неокортекс) и межуточная кора(состоящая из промежуточной древней и промежуточной старой коры). Поверхность неокортекса у человека занимает 95,6%, старой 2,2%, древней 0,6%, межуточной 1,6%.
Сама кора больших полушарий, в общем-то, и обеспечивает все когнитивные процессы на высших уровнях обработки информации. Именно в коре выделяют высшие корковые ассоциативные центры, где происходит анализ и систематизирование информации на высшем уровне. Таким образом, продвигаясь по коре, мы можем смело сказать, что важнейшие ассоциативные функции, связанные с социальными процессами, выполняются лобными долями полушарий.
Цитоархитектонические поля Бродмана
Поля Бродмана – отделы коры больших полушарий головного мозга, отличающиеся по своей цитоархитектонике (строению на клеточном уровне). Выделяется 52 (53) цитоархитектонических поля Бродмана.
1-я зона — двигательная — представлена центральной извилиной и лобной зоной впереди нее — 4, 6, 8, 9 поля Бродмана. При ее раздражении — различные двигательные реакции; при ее разрушении — нарушения двигательных функций
2-я зона — чувствительная — участки коры головного мозга сзади от центральной борозды (1, 2, 3, 4, 5, 7 поля Бродмана). При раздражении этой зоны — возникают ощущения, при ее разрушении — выпадение кожной, проприо-, интерочувствительности. 1-я и 2-я зоны тесно связаны друг с другом в функциональном отношении. В двигательной зоне много афферентных нейронов, получающих импульсы от рецепторов — это мотосенсорные зоны. В чувствительной зоне много двигательных элементов — это сенсомоторные зоны — отвечают за возникновение болевых ощущений.
3-я зона — зрительная зона — затылочная область коры головного мозга (17, 18, 19 поля Бродмана). При разрушении 17 поля — выпадение зрительных ощущений (корковая слепота). при разрушении 17 поля выпадает видение окружающей среды, которое проецируется на соответствующие участки сетчатки глаза. При поражении 18 поля Бродмана страдают функции, связанные с распознаванием зрительного образа и нарушается восприятие письма. При поражении 19 поля Бродмана — возникают различные зрительные галлюцинации, страдает зрительная память и другие зрительные функции.
4-я — зона слуховая — височная область коры головного мозга (22, 41, 42 поля Бродмана). При поражении 42 поля — нарушается функция распознавания звуков. При разрушении 22 поля — возникают слуховые галлюцинации, нарушение слуховых ориентировочных реакций, музыкальная глухота. При разрушении 41 поля — корковая глухота.
5-я зона — обонятельная — располагается в грушевидной извилине (11 поле Бродмана).
6-я зона — вкусовая — 43 поле Бродмана.
7-я зона — речедвигательная зона — у большинства людей (праворуких) располагается в левом полушарии.
Эта зона состоит из 3-х отделов.
Речедвигательный центр Брока — расположен в нижней части лобных извилин — это двигательный центр мышц языка.
Сенсорный центр Вернике — расположен в височной зоне — связан с восприятием устной речи. .
Центр восприятия письменной речи располагается в зрительной зоне коры головного мозга.
Клеточный уровень организации нервной системы
Сама же нервная система как таковая складывается из миллиардов клеток – нейронов.Нейрон(от др.-греч.νεῦρον — волокно, нерв) — это структурно-функциональная единица нервной системы. Эта клетка имеет сложное строение, высокоспециализирована и по структуре содержит ядро, тело клетки и отростки. В организме человека насчитывается более ста миллиардов нейронов.
Сложность и многообразие функций нервной системы определяются взаимодействием между нейронами, которое, в свою очередь, представляет собой набор различных сигналов, передаваемых в рамках взаимодействия нейронов с другими нейронами или мышцами и железами. Сигналы испускаются и распространяются с помощью ионов, генерирующих электрический заряд (потенциал действия), который движется по телу нейрона.
Дендриты и аксон
Аксон — обычно длинный отросток, приспособленный для проведения возбуждения и информации от тела нейрона или от нейрона к исполнительному органу. Дендриты — как правило, короткие и сильно разветвлённые отростки, служащие главным местом образования влияющих на нейрон возбуждающих и тормозных синапсов (разные нейроны имеют различное соотношение длины аксона и дендритов), которые передают возбуждение к телу нейрона. Нейрон может иметь несколько дендритов и обычно только один аксон. Один нейрон может иметь связи со многими (до 20-и тысяч) другими нейронами. Дендриты делятся дихотомически, аксоны же дают коллатерали. В узлах ветвления обычно сосредоточены митохондрии. Дендриты не имеют миелиновойоболочки, аксоны же могут её иметь. Местом генерации возбуждения у большинства нейронов является аксонный холмик — образование в месте отхождения аксона от тела. У всех нейронов эта зона называется триггерной.
Для понимания того, как происходят взаимодействия между нейронами, целесообразно ввести понятие синапса. Си́напс(греч.σύναψις, от συνάπτειν — обнимать, обхватывать, пожимать руку) — место контакта между двумя нейронамиили между нейроном и получающей сигнал эффекторнойклеткой. Служит для передачи нервного импульсамежду двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Одни синапсывызывают деполяризацию нейрона, другие — гиперполяризацию; первые являются возбуждающими, вторые — тормозными. Обычно для возбуждения нейрона необходимо раздражение от нескольких возбуждающих синапсов.
Функциональная классификация
Афферентные нейроны(чувствительный, сенсорный, рецепторный или центростремительный). К нейронам данного типа относятся первичные клетки органов чувств и псевдоуниполярные клетки, у которых дендриты имеют свободные окончания.
Эфферентные нейроны(эффекторный, двигательный, моторный или центробежный). К нейронам данного типа относятся конечные нейроны — ультиматные и предпоследние — не ультиматные.
Ассоциативные нейроны(вставочные или интернейроны) — группа нейронов осуществляет связь между эфферентными и афферентными, их делят на интризитные, комиссуральные и проекционные.
Секреторные нейроны — нейроны, секретирующие высокоактивные вещества (нейрогормоны). У них хорошо развит комплекс Гольджи (сереторный аппарта клетки), аксон заканчивается аксовазальными синапсами.
Понимание структуры нейрона и межнейронных связей потребуется нам в дальнейшем, когда мы будем говорить о механизмах памяти.
Резюмируя вышеизложенный материал, уже на данном этапе можно сделать некоторые выводы о том, что понимание структуры и физиологи нервной системы могут облегчить процесс обучения учеников. Именно законы функционирования нервной системы диктуют особенности познавательных процессов в мозге.
<?!> Важно отметить, что сущесвтует такое понятие как сила синапса. Она связана с так называемой синаптической пластичностью, т.е. возможностью изменения силы самого синапса (величины изменения трансмембранного потенциала) в ответ на активацию постсинаптических рецепторов. Именно синаптическая пластичность считается основным механизмом, с помощью которого реализуется феномен памяти и обучения.
Это фундаментальное знание позволяет наиболее оптимальным способом организовывать процесс запоминания новой информации. Например, вы хотите, чтобы обучающиеся хорошо усвоили кто такой Михаил Васильевич Ломоносов. Для этого нам нужно, чтобы на одном нейроне, который, скажем, условно говоря, будет собирающим, конвергировалась ( сходилась) информация о М. В. Ломоносове. Таким образом, будет целессообразно рассказывать об учёном на истории, на химии, на рисовании и т.д. Это будет увеличивать силу синапса и упрочнять его и, как следствие, мы получим наиболее устойчивые и уверенные знания о материале, связанном с Ломоносовым. То есть, чем чаще через синапс будет проходить инфрмация об учёном, тем сильнее будет становиться сила данного синапса.
Вот почему так важна синхронизация программ обучения различных предметов. Не стоит забывать и о том, что разделение на отдельные науки весьма условно.
Задания
Первое задание является обязательным для выполнения. Вы можете также выбрать другие задания, трудоёмкостью не менее 70 минут. Общая трудоёмкость должна быть не менее 120 минут.
1. В тексте говориться о том, что с помощью дыхания можно регулировать как работу вегетативной нервной системы, так и эмоциональное состояние ученика. Отыщите другие варианты процессов в организме человека, которые можно регулировать с помощью дыхания. Оформите таблицу, в которой отразите технику, её название (если имеется), её функциональный смысл. Будьте готовы представить не менее 3-х различных дыхательных техник. Опробуйте такие техники на себе. Отразите в отчёте под таблицей результаты, свои ощущения.
(Трудоёмкость 50 минут)
2.Заполните таблицу строения нервной системы. Отметьте основные функциональные структуры. Используйте дополнительные материалы.
Пример заполнения таблицы.
Структура | Локализация | Функции | Комментарии |
Периферические ганглии | Располагаются по ходу спинного мозга. Относятся к спинному мозгу. | Отвечает за переработку информации на локальном уровне, частично регулирует простейшие функции (например, тонус мочевого пузыря) | Количество таких ганглиев должно быть равно количеству сегментов в спинном мозге. Такие ганглии есть звенья вегетативной нервной системы. |
|
|
|
|
|
|
|
|
(Трудоёмкость 60 минут)
3. В лекции упоминается о существовании так называемых синапсов. Подготовьте презентацию, в которой создайте слайды, посвящённые различным видам синапсов и их функциям.
(Трудоёмкость 50 минут)
4. В лекции говориться о том, что соматическая нервная система осуществляет преимущественно связь организма с внешней средой: восприятие раздражений, регуляцию движений поперечнополосатой мускулатуры скелета. Дополните этот раздел текста. Сделайте расширение в формате гипертекста. Сопроводите материалы рисунками, схемами или графиками.
(Трудоёмкость 40 минут)
5. Напишите эссе на тему “Зачем изучать мозг?” Объём эссе должен быть не менее 700 слов.
(Трудоёмкость 35 – 40 минут)
Анатомия, автономная нервная система — StatPearls
Введение
Автономная нервная система — это компонент периферической нервной системы, который регулирует непроизвольные физиологические процессы, включая частоту сердечных сокращений, кровяное давление, дыхание, пищеварение и сексуальное возбуждение. Он состоит из трех анатомически различных отделов: симпатического, парасимпатического и кишечного.
Симпатическая нервная система (СНС) и парасимпатическая нервная система (ПНС) содержат как афферентные, так и эфферентные волокна, которые обеспечивают сенсорный ввод и двигательный выход, соответственно, в центральную нервную систему (ЦНС).Как правило, моторные пути SNS и PNS состоят из серии из двух нейронов: преганглионарного нейрона с клеточным телом в ЦНС и постганглионарного нейрона с клеточным телом на периферии, которое иннервирует ткани-мишени. Кишечная нервная система (ENS) представляет собой обширную сетевидную структуру, способную функционировать независимо от остальной нервной системы. [1] [2] Он содержит более 100 миллионов нейронов более 15 морфологии, что превышает сумму всех других периферических ганглиев, и в основном отвечает за регуляцию пищеварительных процессов.[3] [4]
Активация SNS приводит к общему состоянию повышенной активности и внимания: реакции «сражайся или беги». При этом повышается артериальное давление и частота сердечных сокращений, наступает гликогенолиз, прекращается перистальтика желудочно-кишечного тракта и т. Д. [5] SNS иннервирует почти каждую живую ткань в организме. PNS способствует процессам «отдыха и усвоения пищи»; частота сердечных сокращений и артериальное давление снижаются, возобновляется перистальтика желудочно-кишечного тракта / пищеварение и т. д. [5] [6] PNS иннервирует только голову, внутренние органы и наружные гениталии, особенно свободные в большей части опорно-двигательного аппарата и кожи, что делает их значительно меньше, чем SNS.[7] ENS состоит из рефлекторных путей, которые контролируют пищеварительные функции сокращения / расслабления мышц, секреции / абсорбции и кровотока. [3]
Пресинаптические нейроны как SNS, так и PNS используют ацетилхолин (ACh) в качестве своего нейромедиатора. Постсинаптические симпатические нейроны обычно продуцируют норэпинефрин (NE) в качестве своего эффекторного передатчика для воздействия на ткани-мишени, в то время как постсинаптические парасимпатические нейроны используют ACh повсюду. [1] [5] Известно, что кишечные нейроны используют несколько основных нейромедиаторов, таких как ACh, закись азота и серотонин, и это лишь некоторые из них.[8]
Структура и функции
Симпатическая нервная система
Симпатические нейроны имеют клеточные тела, расположенные в промежуточно-боковых столбах или боковых рогах спинного мозга. Пресинаптические волокна выходят из спинного мозга через передние корешки и входят в передние ветви спинномозговых нервов T1-L2 и попадают в симпатические стволы через белые коммуникантные ветви. Отсюда волокна могут подниматься или опускаться по симпатическому стволу к верхнему или нижнему паравертебральному ганглию, соответственно, проходить к соседним ветвям передних спинномозговых нервов через серые коммуникантные ветви или пересекать ствол без синапсов и продолжаться через брюшно-тазовый внутренностный нерв, чтобы достичь превертебральные ганглии.Из-за центрального расположения симпатических ганглиев пресинаптические волокна имеют тенденцию быть короче, чем их постсинаптические аналоги. [2] [9]
Паравертебральные ганглии существуют в виде узелков по всему симпатическому стволу, прилегающих к позвоночнику, где находятся синапсы пре- и постганглионарных нейронов. Хотя количество может варьироваться в зависимости от человека, обычно существует три шейных, 12 грудных, четыре поясничных и пять крестцовых ганглиев. Из них только шейные имеют названия верхних, средних и нижних шейных ганглиев.Нижний шейный ганглий может срастаться с первым грудным ганглием, образуя звездчатый ганглий. [2] [9]
Все нервы дистальнее паравертебральных ганглиев являются внутренними нервами. Они передают афферентные и эфферентные волокна между ЦНС и внутренними органами. Сердечно-легочные чревные нервы несут постсинаптические волокна, предназначенные для грудной полости.
Нервы, которые иннервируют внутренние органы брюшной полости и таза, проходят через паравертебрально без синапсов, становясь брюшно-тазовыми внутренними нервами.Эти нервы включают больший, малый, наименьший и пояснично-чревные нервы. Пресинаптические нервы, наконец, синапсы в превертебральных ганглиях, которые находятся ближе к их органу-мишени. Превертебральные ганглии — это часть нервных сплетений, окружающих ветви аорты. К ним относятся глютеновые, аортекоренальные, а также верхние и нижние брыжеечные ганглии. Чревный ганглии получает входной сигнал от большого чревного нерва, аортекоренальный от малого и наименее чревного нервов, а верхний и нижний брыжеечные нервы от нижнего и поясничного внутренних нервов.Чревный ганглий иннервирует органы, происходящие из передней кишки: дистальный отдел пищевода, желудок, проксимальный отдел двенадцатиперстной кишки, поджелудочную железу, печень, билиарную систему, селезенку и надпочечники. Верхний брыжеечный ганглий иннервирует производные средней кишки: дистальный отдел двенадцатиперстной кишки, тощую кишку, подвздошную кишку, слепую кишку, аппендикс, восходящую ободочную кишку и проксимальный поперечный отдел ободочной кишки. Наконец, нижний брыжеечный ганглий обеспечивает симпатическую иннервацию структурам, развивающимся из задней кишки: дистальному поперечному, нисходящему и сигмовидному отделам толстой кишки; прямая кишка и верхний анальный канал; а также мочевой пузырь, наружные гениталии и гонады.[10] [11] [12] Для получения дополнительной информации см. Соответствующую статью StatPearls по этой ссылке. [13]
Общее правило двух нейронов для цепей SNS и PNS имеет несколько заметных исключений. Симпатические и парасимпатические постганглионарные нейроны, которые синапсируют с ENS, функционально являются частью цепи из трех или более нейронов. Пресинаптические симпатические волокна, предназначенные для мозгового вещества надпочечников, проходят через чревные ганглии и синапсы непосредственно на хромаффинные клетки. Эти уникальные клетки функционируют как постганглионарные волокна, которые выделяют адреналин непосредственно в венозную систему.[1] [2] [14]
Постганглионарные симпатические нейроны выделяют NE, который действует на адренергические рецепторы в ткани-мишени. Подтип рецептора, альфа-1, альфа-2, бета-1, бета-2 или бета-3, и ткани, в которых они экспрессируются, влияют на сродство NE к рецептору. [15] Для получения дополнительной информации см. Статьи StatPearls, посвященные адренергическим рецепторам, по следующим ссылкам. [16] [17] [18]
Как уже говорилось, SNS позволяет организму справляться со стрессорами посредством реакции «бей или беги».Эта реакция в первую очередь регулирует кровеносные сосуды. Сосуды тонически иннервируются, и в большинстве случаев усиление симпатических сигналов приводит к сужению сосудов, а не к расширению сосудов. Исключение составляют коронарные сосуды и сосуды, снабжающие скелетные мышцы и наружные гениталии, для которых происходит обратная реакция [2]. Этот противоречивый эффект опосредован балансом активности альфа- и бета-рецепторов. В физиологическом состоянии стимуляция бета-рецепторов увеличивает расширение коронарных сосудов, но есть притупление этого эффекта за счет опосредованной альфа-рецепторами вазоконстрикции.В патологическом состоянии, например при ишемической болезни сердца, активность альфа-рецепторов усиливается, и происходит приглушение бета-активности. Таким образом, коронарные артерии могут сужаться за счет симпатической стимуляции. [19] Активация симпатической нервной системы увеличивает частоту сердечных сокращений и сократительную силу, что, однако, увеличивает потребность в метаболизме и, таким образом, пагубно влияет на сердечную функцию у людей с ограниченными возможностями [20].
Социальная сеть постоянно активна, даже в нестрессовых ситуациях. В дополнение к вышеупомянутой тонической стимуляции кровеносных сосудов СНС активен во время нормального дыхательного цикла.Активация симпатической нервной системы дополняет ПНС, действуя во время вдоха, расширяя дыхательные пути, обеспечивая соответствующий приток воздуха. [2] [21]
Кроме того, SNS регулирует иммунитет посредством иннервации иммунных органов, таких как селезенка, тимус и лимфатические узлы. [15] [22] Это влияние может усиливать или подавлять воспаление. [23] Клетки адаптивной иммунной системы в основном экспрессируют рецепторы бета-2, тогда как клетки врожденной иммунной системы экспрессируют их, а также адренергические рецепторы альфа-1 и альфа-2.[15] [24] Макрофаги активируются при стимуляции альфа-2 и подавляются активацией бета-2-адренергических рецепторов.
Большинство постганглионарных симпатических нейронов являются норадренергическими, а также выделяют один или несколько пептидов, таких как нейропептид Y или соматостатин. Нейроны NE / нейропептида Y иннервируют кровеносные сосуды сердца, таким образом регулируя кровоток [25], в то время как нейроны NE / соматостатин глютеновых и верхних брыжеечных ганглиев снабжают подслизистые ганглии кишечника и участвуют в контроле моторики желудочно-кишечного тракта.Считается, что эти пептиды служат для модуляции реакции постсинаптического нейрона на первичный нейромедиатор. [1]
Пептиды также связаны с холинергическими симпатическими постганглионарными нейронами. Эти нейроны чаще всего иннервируют потовые железы и прекапиллярные резистивные сосуды в скелетных мышцах и продуцируют вазоактивный кишечный полипептид вместе с ACh. Пептид, связанный с геном кальцитонина, мощный вазодилататор, также был обнаружен в паравертебральных симпатических нейронах.[26] [27] [28] [29]
Парасимпатическая нервная система
Парасимпатические волокна выходят из ЦНС через черепные нервы (CN) III, VII, IX и X, а также через нервные корешки S2-4. Парасимпатических ганглиев четыре пары, и все они расположены в голове. CN III через ресничный узел иннервирует радужную оболочку и цилиарные мышцы глаза. CN VII иннервирует слезные, носовые, небные и глоточные железы через крылонебный узел, а также подъязычные и подчелюстные железы через поднижнечелюстной узел.CN IX иннервирует околоушные железы через слуховой ганглий. [4] Все остальные синапсы пресинаптических парасимпатических волокон в ганглии рядом или на стенке ткани-мишени; это приводит к тому, что пресинаптические волокна становятся значительно длиннее постсинаптических. Расположение этих ганглиев дает ПНС название: «пара-» означает «прилегающий к, следовательно,« парасимпатический ». [2]
Блуждающий нерв, CN X, составляет около 75% ПНС и обеспечивает парасимпатический вход в большая часть грудных и брюшных внутренних органов, с крестцовыми парасимпатическими волокнами, иннервирующими нисходящую и сигмовидную кишку и прямую кишку.Блуждающий нерв состоит из четырех клеточных тел в продолговатом мозге. К ним относятся следующие [2] [4] [30] [31]:
Дорсальное ядро: обеспечивает парасимпатический выход внутренних органов
Nucleus ambiguus: производит моторные волокна и преганглионарные нейроны, которые иннервируют сердце
Nucleus solitarius: получает афференты вкусовых ощущений и внутренних органов и, наконец,
Ядро тройничного нерва спинного мозга: получает информацию о прикосновении, боли и температуре наружного уха, слизистой оболочки гортани и части твердой мозговой оболочки
Кроме того, блуждающий нерв передает сенсорную информацию от барорецепторов каротидного синуса и дуги аорты к мозговому веществу.[32]
Как упоминалось во введении, блуждающий нерв отвечает за процессы «отдыха и переваривания». Блуждающий нерв способствует расслаблению сердца в нескольких аспектах функции. Это снижает сократимость предсердий и, в меньшей степени, желудочков. В первую очередь это снижает скорость проведения через атриовентрикулярный узел. Именно благодаря этому механизму массаж каротидного синуса ограничивает повторный вход при синдроме Вольфа-Паркинсона-Уайта. [2] Другая ключевая функция PNS сосредоточена вокруг пищеварения.Парасимпатические волокна головы способствуют слюноотделению, тогда как те, которые синапсируют с ENS, приводят к усилению перистальтической и секреторной активности. [4] [33] Блуждающий нерв также оказывает значительное влияние на дыхательный цикл. В непатологическом состоянии парасимпатические нервы срабатывают во время выдоха, сокращаясь и напрягая дыхательные пути для предотвращения коллапса. Эта функция вовлекает ПНС в начало послеоперационного острого респираторного дистресс-синдрома. [2] [21]
Из-за обширной природы блуждающего нерва он был описан как идеальная «система раннего предупреждения» для инородных захватчиков, а также для мониторинга восстановления организма.До 80% волокон блуждающего нерва являются сенсорными и иннервируют почти все основные органы. Было обнаружено, что парасимпатические ганглии экспрессируют рецепторы интерлейкина-1, ключевого цитокина воспалительного иммунного ответа [34]. Это, в свою очередь, активирует ось гипоталамус-гипофиз-надпочечники и SNS, что приводит к высвобождению глюкокортикоидов и NE соответственно. [2] Исследования коррелировали между ингибированием вагусного действия при ваготомии и холинергическими ингибиторами со значительным снижением, если не устранением, аллергическими, астматическими и воспалительными реакциями.[7]
Постганглионарные парасимпатические нейроны высвобождают ACh, который действует на мускариновые и никотиновые рецепторы, каждый с различными субъединицами: M1, M2 и M3, а также N1 и N2, где «M» и «N» обозначают мускарин и никотин соответственно. . [5] Постганглионарные рецепторы ACh и рецепторы на мозговом веществе надпочечников относятся к N-типу, в то время как парасимпатические эффекторы и потовые железы относятся к M-типу. [2] Как и в симпатических нейронах, некоторые пептиды, такие как вазоактивный кишечный пептид (VIP), нейропептид Y (NPY) и пептид, связанный с геном кальцитонина (CGRP), экспрессируются в парасимпатических нейронах и высвобождаются из них.[27] [28] [35] [36] Для получения дополнительной информации см. Статью StatPearls о холинергических рецепторах здесь. [37]
Кишечная нервная система (ENS)
ENS состоит из двух ганглиозных сплетений: мышечно-кишечного (Auerbach) и подслизистого (Meissner). Миэнтерическое сплетение находится между продольными и круговыми гладкими мышцами желудочно-кишечного тракта, в то время как подслизистое сплетение находится внутри подслизистой основы. ENS является автономным, функционирует за счет локальной рефлекторной активности, но часто получает входные данные и обеспечивает обратную связь с SNS и PNS.ENS может получать входные данные от постганглионарных симпатических нейронов или преганглионарных парасимпатических нейронов. [1] [38]
Подслизистое сплетение управляет движением воды и электролитов через стенку кишечника, а мышечно-кишечное сплетение координирует сократимость циркулярных и продольных мышечных клеток кишечника для обеспечения перистальтики [39].
Подвижность вырабатывается в ENS посредством рефлекторной цепи, включающей круговые и продольные мышцы. Никотиновые синапсы между интернейронами опосредуют рефлекторные цепи.[39] Когда цепь активируется присутствием болюса, возбуждающие нейроны в круговой мышце и тормозящие нейроны в продольной мышечной огне образуют узкую секцию кишечника проксимальнее болюса; это известно как движущий сегмент. Одновременно возбуждающие нейроны в продольной мышце и тормозящие нейроны в круговой мышце образуют «принимающий сегмент» кишечника, в котором будет продолжаться болюс. Этот процесс повторяется с каждым последующим отделом кишечника.[40]
ENS сохраняет некоторые сходства с CNS. Как и в ЦНС, кишечные нейроны могут быть биполярными, псевдоуниполярными и мультиполярными, между которыми происходит нейромодуляция посредством возбуждающей и тормозящей связи [1]. Точно так же нейроны ENS используют более 30 нейротрансмиттеров, аналогичных нейромедиаторам ЦНС, из которых наиболее распространены холинергические и нитрергические передатчики [39].
Хотя большая часть этого обсуждения была сосредоточена на эфферентных функциях ВНС, афферентные волокна отвечают за многочисленные рефлекторные действия, которые регулируют все, от частоты сердечных сокращений до иммунной системы.Обратная связь от ВНС обычно обрабатывается на подсознательном уровне, чтобы вызвать рефлекторные действия во внутренних или соматических частях тела. Сознательное ощущение внутренних органов часто интерпретируется как диффузная боль или спазмы, которые могут коррелировать с голодом, чувством сытости или тошнотой. Эти ощущения чаще всего возникают в результате внезапного вздутия / сокращений, химических раздражителей или патологических состояний, таких как ишемия. [41]
Хирургические аспекты
Синдром Хорнера — это легкое, редкое заболевание, часто проявляющееся односторонним птозом, миотическим, но реактивным зрачком и лицевым ангидрозом, вторичным по отношению к повреждению симпатического нерва в окулосимпатическом пути.[46] Это повреждение может иметь центральную причину, такую как инфаркт латерального продолговатого мозга, или периферическую, например, в результате вторичного повреждения торакальной хирургии или частичной / полной резекции щитовидной железы. [46] [47] Более централизованные поражения, как правило, коррелируют с набором симптомов, включая синдром Хорнера. [46] Для получения дополнительной информации см. Соответствующие статьи StatPearls здесь. [48] [49]
Гипергидроз — распространенное заболевание, характеризующееся повышенным потоотделением, в первую очередь лица, ладоней, подошв и / или подмышек.Хотя причина первичного гипергидроза до конца не изучена, ее связывают с повышенной холинергической стимуляцией. Лечение может быть клиническим или хирургическим. [50] Клиническое лечение сосредоточено на антихолинергических средствах, таких как местный гликопирролат или пероральный оксибутинин, или, реже, на альфа-адренергических агонистах, таких как клонидин, блокаторы кальциевых каналов или габапентин. [50] [51] Наиболее распространенной и постоянной хирургической техникой является резекция, абляция или клипирование грудной симпатической цепи.Несмотря на то, что эта процедура носит постоянный характер, у небольшого числа людей она может привести к компенсаторному гипергидрозу. Эти симптомы гипергидроза такие же, если не более серьезные, чем до процедуры, из-за возможной гиперкомпенсации со стороны гипоталамуса. Исследования показали, что хирургическая реконструкция симпатической цепи может уменьшить этот компенсаторный ответ [52].
Клиническая значимость
Из-за обширного характера вегетативной нервной системы на нее может влиять широкий спектр состояний.Некоторые из них включают [53] [54] [55]
Приобретенный
Сахарный диабет
Уремическая невропатия / хронические заболевания печени
Дефицит витамина B12
/ лекарственно-индуцированные: алкоголь, амиодарон, химиотерапия
Инфекции: ботулизм, болезнь Шагаса, ВИЧ, проказа, болезнь Лайма, столбняк
Аутоиммунные: миастенический синдром Гийена-Барре, Ламберта-Итона, ревматоидный артрит, Sjj системная красная волчанка
Неврология: множественная системная атрофия / синдром Шай-Драгера, болезнь Паркинсона, деменция с тельцами Леви
Неоплазия: опухоли головного мозга, паранеопластические синдромы
, почти любой автономный невропат система.Ортостатическая гипотензия — наиболее распространенная вегетативная дизавтономия, но могут быть представлены многочисленные другие, менее изученные данные [53]
Сердечно-сосудистые
Фиксированная частота сердечных сокращений
Постуральная гипотензия
Тахикардия в покое
Желудочно-кишечный тракт
Мочеполовой
Зрачковый
Половой
Эректильная дисфункция
4
4 Эректильная дисфункцияАнгидроз
Вкусное потоотделение
Вазомоторное
Наиболее распространенными симптомами ортостатической гипотонии являются головокружение, туннельное зрение и дискомфорт в мышцах. e голова, шея или грудь.Это может сопровождаться гипертензией в положении лежа на спине из-за повышенного периферического сопротивления, которое вызывает натрийурез, усугубляя ортостатическую гипотензию. Существует множество других, более доброкачественных стимулов, которые могут либо понижать кровяное давление (стояние, еда, Вальсальва, обезвоживание, упражнения, гипервентиляция и т. Д.), Либо повышать кровяное давление (лежа на спине, прием воды, кофе, наклон головы вниз, гиповентиляция и т. Д.) и т. д.). [53]
Оценка ортостатической гипотензии обычно выполняется с помощью ортостатического тестирования с помощью повторных измерений артериального давления и частоты сердечных сокращений в положении лежа на спине и стоя, а также с помощью теста с наклонным столом.Однако преимущество этого последнего теста минимально по сравнению с ортостатическим, а главное преимущество заключается в безопасности и удобстве для пациента. [53]
Пациенты с дизавтономией склонны к гипотонии во время анестезии [56]. Эту проблему можно надлежащим образом решить с помощью низких доз фенилэфрина, агониста альфа-1. Аналогичным образом гипертензию в положении лежа на спине можно контролировать с помощью трансдермальных или внутривенных нитратов. [53] [57] [58]
Симпатическая нервная система, как хорошо известно, играет роль в ноцицепции.Есть предположения, что ВНС оказывает регулирующее ингибирующее действие на боль, потеря которого создает цепь положительной обратной связи, ведущую к повышенной возбудимости ноцицептивных нервных волокон. Тот факт, что эффект симпатической блокады часто сохраняется после продолжительности введенных анестетиков, подтверждает эту гипотезу. [59] Локальные блокады симпатических нервов использовались для лечения множества менее распространенных болевых состояний, включая комплексный региональный болевой синдром, фантомную боль в конечностях и герпетическую боль.Точно так же висцеральную боль можно лечить с помощью более центрального подхода через блокаду чревного сплетения. В связи с широким спектром функций, выполняемых ВНС, блоки предназначены для лечения трудноизлечимой боли, не контролируемой более традиционными анальгетиками. [59] См. Соответствующие статьи StatPearls для получения дополнительной информации здесь. [60] [61] [62]
Большинство состояний, связанных с ENS, имеют врожденное происхождение и проявляются в раннем детстве. [44] Кишечные нейроны расслабляют гладкие мышцы кишечника. Их отсутствие приводит к тоническому сокращению кишечника, что приводит к его непроходимости.Жалобы часто включают гастроэзофагеальный рефлюкс, диспептические синдромы, запоры, хронические боли в животе и синдром раздраженного кишечника. Заметным опасным для жизни заболеванием ENS является болезнь Гиршпрунга. Это состояние является неспособностью эмбриологических клеток ENS колонизировать дистальный отдел кишечника. Когда ENS отсутствует (аганглионоз) или плохо развит, у детей возникают ранние запоры, рвота, возможная задержка роста и возможная смерть. [3] [44] Исследования выявили шесть генов, имеющих причинную связь с болезнью Гиршпрунга.[44] Синдром Дауна — наиболее распространенное генетическое заболевание, предрасполагающее человека к болезни Гиршпрунга, несмотря на то, что на хромосоме 21 не были идентифицированы гены, связанные с развитием ENS. [3]
Неврология для детей — вегетативная нервная система
Вегетативная нервная система
Вегетативная нервная система (ВНС) (ВНС) регулирует функции наших внутренних органов (внутренностей), таких как сердце, желудок и кишечник. ВНС является частью периферической нервной системы. а также контролирует некоторые мышцы тела.Мы часто не осознает ВНС, потому что он функционирует непроизвольно и рефлекторно. Для Например, мы не замечаем, когда кровеносные сосуды меняют размер или когда наше сердце бьет быстрее. Однако некоторых людей можно научить контролировать некоторые функции ВНС, такие как частота сердечных сокращений или артериальное давление.
ANS наиболее важен в двух ситуациях:
- В экстренных случаях, которые вызывают стресс и требуют от нас звонка «борись» или «беги» (убегай)
- В нештатных ситуациях, которые позволяют нам «отдохнуть» и «переваривать.»
ANS регулирует:
— в коже (вокруг волосяных фолликулов; гладкие мышцы
— вокруг кровеносных сосудов (гладкие мышцы)
— в глазу (радужная оболочка; гладкие мышцы)
— в желудке, кишечнике и мочевом пузыре (гладкие мышцы)
— сердца (сердечной мышцы)
ANS состоит из трех частей:
- Симпатическая нервная система
- Парасимпатическая нервная система
- Кишечная нервная система
| Симпатическая нервная система | |
Хороший солнечный день…. вы прогуливаетесь по парку. Вдруг сердитый появляется медведь на вашем пути. Вы остаетесь и сражаетесь ИЛИ поворачиваетесь и убегаете? Эти это ответы «Сражайся или беги». В таких ситуациях ваш симпатическая нервная система задействуется — она использует энергию — ваш повышается артериальное давление, ваше сердце бьется быстрее, а пищеварение замедляется вниз. Обратите внимание на картинке слева, что симпатическая нервная система берет начало в спинном мозге. В частности, тела клеток первого нейрон (преганглионарный нейрон) расположены в грудном и поясничном отделах спинной мозг.Аксоны от этих нейронов проецируются в цепочку ганглиев. расположен рядом со спинным мозгом. В большинстве случаев этот нейрон образует синапс с другим нейроном (постганглионарный нейрон) в ганглии. Несколько преганглионарных нейронов переходят в другие ганглии вне симпатической цепи и синапсов нет. Постганглионарный Затем нейрон проецируется на «цель» — мышцу или железу. Еще два факта о симпатической нервной системе: синапс в симпатический ганглий использует ацетилхолин в качестве нейромедиатора; синапс постганглионарного нейрон с органом-мишенью использует нейротрансмиттер, называемый норадреналин .(Конечно, есть одно исключение: симпатический постганглионарный нейрон, который заканчивается на потовых железах использует ацетилхолин.) |
| Парасимпатическая нервная система | |
Хороший солнечный день … Вы прогуливаетесь по парку. Однако на этот раз вы решаете расслабиться в удобном кресле, которое у вас есть. принес с собой. Это требует ответов «Отдыхай и дайджест». Сейчас пора парасимпатической нервной системе поработать для экономии энергии.Это когда артериальное давление может снизиться, частота пульса может замедлиться, а пищеварение может Начните. Обратите внимание на изображение слева, что тела клеток парасимпатическая нервная система расположена в спинном мозге (крестцовый область) и в мозговом веществе . В мозговом веществе черепные нервы III, VII, IX и X образуют преганглионарные парасимпатические волокна. Преганглионарное волокно из мозговой или спинной мозг проецируется на ганглии очень близко к целевому органу и делает синапс.Этот синапс использует нейротрансмиттер, называемый ацетилхолин . Из этого ганглия постганглионарный нейрон проецируется на целевой орган и использует ацетилхолин снова на своем Терминал. |
Вот краткое изложение некоторых эффектов симпатического и парасимпатическая стимуляция. Обратите внимание, что эффекты обычно противостояние друг другу.
Вегетативная нервная система
| Структура | Симпатическая стимуляция | Парасимпатическая Стимуляция |
|---|---|---|
| Радужка (глазная мышца) | Расширение зрачка | Зрачок сужение |
| Слюнные железы | Производство слюны снижено | Производство слюны увеличено |
| Слизистая оболочка полости рта / носа | Производство слизи снижено | Производство слизи увеличено |
| Сердце | Частота и сила пульса увеличено | Частота сердечных сокращений и сила уменьшились |
| Легкое | Бронхиальная мышца расслаблена | Бронхиальная мышца Контракт |
| Желудок | Перистальтика снижена | Желудок выделяемый сок; моторика увеличена |
| Тонкий кишечник | моторика снижено | Пищеварение повышено |
| Толстый кишечник | Подвижность снижена | Секреция и подвижность увеличены |
| Печень | Повышенная конверсия
из гликогена в глюкозу | |
| Почки | Снижение количества мочи секреция | Повышенная секреция мочи |
| Мозговое вещество надпочечников | Норэпинефрин и адреналин секретный | |
| Мочевой пузырь | Стенка расслаблена Сфинктер закрыто | Стена сокращена Сфинктер расслаблен |
Следует отметить, что вегетативная нервная система всегда работает.Он активен НЕ только во время «борьбы или бегства» или «отдыха и переваривания». ситуации. Скорее, вегетативная нервная система поддерживает нормальное состояние. внутренние функции и работает с соматической нервной системой.
Кишечный нерв система — это третье подразделение вегетативной нервной системы, которое вы мало о чем слышите. Кишечная нервная система представляет собой сеть нервные волокна, иннервирующие внутренние органы (желудочно-кишечный тракт, поджелудочная железа, и желчный пузырь).
Авторские права © 1996-2020, Эрик Х.Чудлер, Университет Вашингтон
Централизованный контроль вегетативной нервной системы и терморегуляции (Раздел 4, Глава 3) Нейронауки в Интернете: Электронный учебник для нейронаук | Кафедра нейробиологии и анатомии
Рисунок 3.1 |
3.1 Определение центральной автономной сети
Поскольку многие студенты были убеждены, что вегетативная нервная система относительно примитивна, большинство из них пришли к выводу, что нормальная регуляция этой системы происходит на ганглиозном или, в лучшем случае, спинномозговом уровне.Таким образом, они часто очень удивляются, обнаружив, что дисфункция мозга обычно сопровождается вегетативной дисфункцией, которая может быть опасной для жизни. Например, у пациентов с перерезкой позвоночника могут быть тяжелые гипертонические кризы, спровоцированные переполнением мочевого пузыря, пораженной толстой кишкой или даже поглаживанием кожи. Это не означает, что спинной мозг и вегетативные ганглии не играют важной роли в вегетативной регуляции. Но, что организация вегетативной выработки происходит на надспинальных уровнях.
Обширная взаимосвязь происходит между сайтами, получающими висцеральные входные сигналы и контролирующими вегетативные эфферентные выходы, между сайтами, контролирующими выход симпатической и парасимпатической нервной системы, и между сайтами вегетативного контроля и соматической, эндокринной и лимбической схемами. В совокупности этот набор взаимосвязей называется центральной автономной сетью.
3.2 Структура центральной автономной сети
Центральная вегетативная сеть состоит как из гипоталамических, так и внегипоталамических ядер.Некоторые из этих участков регулируют симпатический отток, тогда как другие регулируют парасимпатический отток. Эта структура была впервые обнаружена в исследованиях поражений, которые выявили мультисинаптические связи, идущие от гипоталамуса и среднего мозга к преганглионарным нейронам в стволе и спинном мозге. Аналогичным образом были продемонстрированы связи различных лимбических структур мозга, особенно миндалины, через гипоталамус. Конечным результатом полной работы этой сети является индукция вегетативных реакций на стимулы висцерального и соматического стресса, такие как повышение частоты сердечных сокращений и артериального давления с началом боли.В качестве альтернативы, хроническая гипертензия у лиц типа «А» или у лиц, находящихся в стрессе, представляет собой усиленный отток центральной вегетативной нервной системы в ответ на усиление воздействия лимбической системы. Иерархия в вегетативной сети приводит к тому, что петли от ствола головного мозга к спинному мозгу отвечают за быструю краткосрочную регуляцию вегетативной нервной системы, пути гипоталамус-ствол-спинной мозг, обслуживающие более долгосрочную, метаболическую и репродуктивную регуляцию, и, наконец, лимбическую систему. петли гипоталамуса-ствола головного мозга-спинного мозга, служащие упреждающей вегетативной регуляции.
- Гипоталамические структуры. Единственным наиболее важным ядром гипоталамуса центральной вегетативной сети является паравентрикулярное ядро (ПВЯ). PVN имеет два морфологических класса нейронов, которые делятся на три функциональные категории. Первый морфологический класс — это крупноклеточные нейроны. Эти нейроны содержат вазопрессин и окситоцин и проецируют свои аксоны в задний гипофиз, где эти гормоны выбрасываются непосредственно в кровоток.Второй морфологический класс состоит из парвоцеллюлярных (малых) нейронов. Парвоцеллюлярные нейроны PVN также включают нейроэндокринную функциональную подгруппу, которая проецируется на срединное возвышение и выделяет рилизинг-гормоны в портальный кровоток гипофиза для контроля секреции гормона передней доли гипофиза. Подробнее об этих двух функциональных группах будет рассказано в следующей главе. Наконец, группа парвоцеллюлярных нейронов составляет третью функциональную группу нейронов PVN, которые участвуют в центральном вегетативном контроле.
Существует три типа преавтономных парвоцеллюлярных нейронов (типы A, B и C), которые можно разделить на основании анатомических и физиологических критериев, а также на основании субядерного расположения в PVN. Преавтономные нейроны PVN проецируются непосредственно на преганглионарные вегетативные нейроны в дорсальном моторном ядре блуждающего нерва, автономные ретрансляционные ядра ствола мозга (A5, рострально-вентрально-латеральное мозговое вещество) и даже непосредственно в промежуточно-латеральные позвоночные столбы. Эти выступы спускаются ипсилатерально через ствол мозга и спинной мозг с четырьмя точками перекреста (супраммиллярная, покрытая мостиком, комиссуральная часть ядра единственного тракта (основная), пластинка X спинного мозга), так что в конечном итоге иннервация двусторонняя, но с ипсилатеральным преобладанием.Таким образом, PVN, в отличие от любого другого участка мозга, имеет прямое влияние как на симпатический, так и на парасимпатический отток. Кроме того, PVN получает прямые симпатические и парасимпатические афферентные сигналы от тройничного нерва хвостового отдела (симпатического) и ядра единственного тракта (парасимпатического). Таким образом, PVN является единственным участком мозга в замкнутой эфферентно-афферентной рефлекторной петле с симпатической и парасимпатической нервными системами.
Другие ядра гипоталамуса в центральной вегетативной сети включают дорсомедиальное ядро, латеральную область гипоталамуса, заднее ядро гипоталамуса и мамиллярное ядро.Эти ядра отправляют и получают проекции от PVN, дорсального моторного ядра блуждающего нерва, центрального серого вещества, парабрахиального ядра, ядра единственного тракта, латерального и вентрального мозгового слоя и промежуточно-латеральных позвоночных столбов. Боковой гипоталамус особенно участвует в контроле сердечно-сосудистой системы, а также в контроле кормления, насыщения и высвобождения инсулина.
- Экстрагипоталамические структуры. Многочисленные структуры мозга были перечислены выше как мишени иннервации гипоталамических структур центральной вегетативной сети. Эти внегипоталамические участки можно условно разделить на те, которые связаны с контролем двух компонентов вегетативной нервной системы. Сайты, связанные с контролем симпатического оттока, включают нейроны, содержащие норэпинефрин, дорсального среднего мозга (locus ceruleus) и рострального и каудального вентролатерального мозгового вещества (области A5 и A1), а также серотонинсодержащие нейроны ядра моста и мозгового шва.Внегипоталамические участки, связанные с контролем парасимпатического оттока, включают центральное ядро миндалины, дорсальное моторное ядро блуждающего нерва, неоднозначное ядро, ядра шва, периакведуктальное серое и парабрахиальное ядро. Наконец, лимбическая кора, в том числе поясная, орбитофронтальная, островковая и ринальная кора, а также гиппокамп влияют на оба набора вегетативного оттока.
Рисунок 3.2 |
3.3 Схема для гипоталамического контроля вегетативной нервной системы
Гипоталамус связан с остальной частью центральной вегетативной сети тремя основными путями: дорсальным продольным пучком, медиальным пучком переднего мозга и маммиллотегментарным трактом.
Главный путь гипоталамуса в центральной вегетативной сети — это дорсальный продольный пучок (DLF). DLF берет начало в области паравентрикулярного ядра и спускается по самой медиальной стороне третьего желудочка через периакведуктальную серую и мезэнцефалическую ретикулярную формацию. DLF продолжается каудально по средней линии около дна четвертого желудочка до закрытия открытого продолговатого мозга, где он становится интернализованным около остатка центрального канала.Это положение оставляет DLF в идеальном положении для иннервации периакведуктального серого, парабрахиального ядра, ядер мезэнцефалического шва и голубого пятна рострально, а также дорсального моторного ядра блуждающего нерва, ядра неоднозначного и медуллярного шва более каудально. Централизованное расположение DLF по мере того, как он продолжается в нижнем мозговом слое, а затем в спинной мозг, делает его идеальным местом для иннервации парасимпатических и симпатических нейронов промежуточно-бокового спинного мозга.Как подробно описано выше, проекции DLF двусторонние, хотя и с ипсилатеральным преобладанием из-за нескольких точек пересечения. Афферентные входы от периакведуктального серого, парабрахиального ядра и голубого пятна восходят через DLF к гипоталамусу.
Медиальный пучок переднего мозга (MFB) является основным путем входа в гипоталамус от ядер перегородки и базальных лимбических структур переднего мозга. Входы из миндалины и гиппокампа, хотя сначала поступают в гипоталамус через stria terminalis, вентральный миндалевидный путь и свод, в конечном итоге соединяются с MFB и, таким образом, получают доступ к паравентрикулярному ядру.MFB также имеет волокна паравентрикулярного ядра, которые нисходят, чтобы иннервировать по существу те же ядра, что и DLF. Висцеральные афференты из ядра солитарного тракта восходят от ствола мозга в гипоталамус посредством MFB. MFB, как и DLF, имеет несколько точек пересечения, так что есть вход в двусторонние структуры, но с ипсилатеральным доминированием.
Маммиллотегментарный тракт менее заметен, чем DLF или MFB, тем не менее, этот путь, который берет начало в маммиллярном ядре, посылает проекции в мезэнцефалические и мостовые ретикулярные образования, которые, в свою очередь, влияют на активность вышеперечисленных вегетативных ядер ствола мозга.
Соматические афференты восходят к гипоталамусу по спиногипоталамическому тракту.
Рисунок 3.3 |
3.4 Нарушения центрального вегетативного контроля
- Вегетативная дисрефлексия — это состояние, наблюдаемое примерно у 85 процентов пациентов после травмы спинного мозга выше C6.Повышенные вегетативные рефлексы, особенно резкое резкое повышение артериального давления, вызываются неподходящими раздражителями, такими как давление на мочевой пузырь.
- Синдром Райли-Дея (семейная дизавтономия) — аутосомно-рецессивное заболевание у евреев ашкенази, связанное с уменьшением слезотечения и чувствительностью к боли и отсутствием грибовидных сосочков на языке. Очень распространены эпизодические абдоминальные кризы и лихорадка, равно как и ортостатическая гипотензия.
- Синдром Шай-Драгера — прогрессирующее дегенеративное состояние неизвестного происхождения, поражающее клетки центральной вегетативной сети в стволе мозга, промежуточно-латеральный столбец клеток, голубое пятно, дорсальное моторное ядро блуждающего нерва и другие ядра, включая хвостатое ядро черной субстанции и мозжечок. .Присутствие тельцов Леви во многих из этих областей предполагает, что этот синдром может быть связан с болезнью Паркинсона, при которой также часто наблюдается высокая степень вегетативной дисфункции. Отличительный признак — глубокая ортостатическая гипотензия без компенсаторного увеличения частоты сердечных сокращений.
- Синдром внезапной детской смерти считается пороком развития центральной вегетативной сети ствола мозга, участвующей в респираторном влечении. Резкое повышение температуры кожи лица, связанное с началом периодов апноэ, предполагает, что может быть более широкий дефект развития центрального вегетативного контроля.
- Синдром Хорнера обычно возникает после повреждения дорсолатерального моста или мозгового вещества и характеризуется глубоким нарушением функции симпатической нервной системы. Распространенной причиной этого типа поражения является тромбоз задней нижней мозжечковой артерии или последующее повреждение белого вещества шейного отдела спинного мозга, где спускается гипоталамо-спинномозговой тракт. Наиболее частыми признаками синдрома Хорнера являются ипсилатеральный миоз, птоз, ангидроз и эритема.
3.5 Центральная вегетативная сеть и контроль температуры тела
Как отмечалось выше, центральная вегетативная сеть состоит из трех иерархически упорядоченных цепей или петель: кратковременных петель ствол мозга-спинной мозг и петель лимбический мозг-гипоталам-ствол-спинной мозг, опосредующих упреждающие реакции и реакции на стресс, и гипоталамические петли промежуточной длины. — петли ствола головного мозга и спинного мозга, обеспечивающие долгосрочные вегетативные рефлексы. Здесь мы сосредоточимся на этой более поздней петле в ее роли в терморегуляции.В следующей главе мы сосредоточимся на этом цикле регулирования кормления.
Гипоталамическая основа заданного значения температуры. Регулирование внутренней температуры очень важно, потому что большинство метаболических процессов, необходимых для жизни, сильно зависят от температуры. Нормальная уставка температуры тела в первую очередь определяется активностью нейронов в медиальном преоптическом и переднем ядрах гипоталамуса, а также нейронами в соседних ядрах медиальной перегородки. В совокупности эту область часто называют преоптическим передним гипоталамусом (ПОАГ).Вторая область, которая также играет критическую, хотя и подчиненную роль POAH в регуляции температуры, — это задний гипоталамус.
3.6 Температурно-чувствительные нейроны
Ранее упоминалось, что гипоталамус — одна из немногих областей мозга, где находятся нейроны ЦНС, которые сами напрямую чувствительны к физическим или химическим переменным, таким как температура, осмоляльность плазмы, глюкоза плазмы и различные гормоны. POAH имеет три типа нейронов, участвующих в определении заданного значения температуры, чувствительные к теплу нейроны, чувствительные к холоду нейроны и нечувствительные к температуре нейроны, которые определяются изменениями скорости разряда после локального нагревания или охлаждения POAH.Чувствительные к теплу нейроны составляют около 30% нейронального пула в ПОАГ. Эти нейроны имеют зависимость скорости возбуждения от температуры, как показано на рисунке 3.4. Изменение температуры ниже 37 градусов мало влияет на скорость разряда. Однако, когда температура поднимается выше 37 градусов, скорость разряда этих нейронов резко возрастает. Активация чувствительных к теплу нейронов приводит к активации нейронов паравентрикулярного ядра (ПВЯ) и бокового гипоталамуса, что приводит к усиленному парасимпатическому оттоку, способствующему рассеиванию тепла.Чувствительные к холоду нейроны, составляющие лишь около 5% популяции клеток в ПОАГ, но более распространенные в заднем ядре гипоталамуса, обладают характеристиками разряда, противоположными свойствам чувствительных к теплу нейронов. Чувствительные к холоду нейроны показывают низкую скорость разряда при температуре выше 37 градусов, но резко увеличивают скорость возбуждения при понижении температуры ниже 37 градусов. Повышенные разряды в чувствительных к холоду нейронах приводят к активации нейронов в PVN и заднем гипоталамусе, что увеличивает симпатический отток, способствуя выработке и сохранению тепла.Относительная концентрация теплочувствительных нейронов в ПОАГ, которые способствуют потере тепла, и чувствительных к холоду нейронов в заднем гипоталамусе, которые способствуют генерации тепла, привела к тому, что ПОАГ часто называют центром рассеивания тепла, а задний гипоталамус обозначают как центр рассеяния тепла. центр производства / сохранения тепла. Последняя группа нейронов, обнаруженных в ПОАГ и заднем гипоталамусе, — это нейроны, нечувствительные к температуре. Это, безусловно, самые многочисленные нейроны в этих ядрах, составляющие более 60 процентов нейронов в ПОАГ.Хотя по определению они не чувствительны к изменениям температуры, эти нейроны играют решающую роль в генерации / сохранении тепла, как обсуждается ниже.
Рисунок 3.4. |
3.7 Нейронные механизмы заданного значения температуры
Главный контур регулирования температуры тела — отвод тепла.Теплочувствительные нейроны POAH имеют внутренние мембранные рецепторы, которые чувствительны к изменениям температуры мозга и крови выше 37 градусов. Это неспецифические катионные каналы, которые, скорее всего, связаны с семейством терморецепторов ваниллоидных (капсаицин-чувствительных). Чувствительные к теплу нейроны также получают возбуждающие сигналы от кожных и спинных терморецепторов. Как показано на Рисунке 3.4, входные данные от кожных рецепторов вызывают смещение влево в скорости возбуждения теплочувствительных нейронов гипоталамуса, так что базовая скорость разряда значительно повышается.Интересно, что хотя скорость активации этих клеток продолжает увеличиваться с повышением температуры тела, наклон этого увеличения уменьшается. Таким образом, стремление к рассеиванию тепла активно осуществляется за счет входных сигналов от тепловых рецепторов. Неясно, относится ли это к производству и сохранению тепла. Чувствительные к холоду нейроны, по-видимому, не имеют внутренних термочувствительных рецепторов. Скорее, увеличение разряда, наблюдаемое в чувствительных к холоду клетках с охлаждением, является результатом уменьшения разряда чувствительных к теплу нейронов и последующего растормаживания, так что чувствительные к холоду нейроны теперь управляются тоническими сигналами от термочувствительных нейронов.Таким образом, заданная температура в основном является функцией активности теплочувствительных нейронов POAH. Кратковременные эффекты воздействия чувствительных к теплу и холоду нейронов на температуру тела возникают в результате изменений вегетативного тонуса кожных артериол и, следовательно, количества кожного кровотока. Изменения симпатического оттока к потовым железам и жировой ткани являются дополнительными мишенями для рассеивания и генерации тепла. Долгосрочные эффекты этих групп нейронов в ответ на устойчивые изменения температуры окружающей среды включают индукцию поведенческих и нейроэндокринных реакций на изменения температуры окружающей среды.
Рисунок 3.5 |
3.8 Нарушения терморегуляции
Лихорадка. Приведенное выше утверждение хорошо подчеркивает тот факт, что с древних времен врачи боролись с лихорадкой. Однако в последнее время лихорадка была признана фактически только одной из совокупности физиологических адаптаций, происходящих во время инфекции, называемых «болезнью» или «реакцией острой фазы».Реакция на болезнь включает поведенческую, когнитивную, метаболическую и нейроэндокринную адаптацию, которая направлена на то, чтобы сделать организм менее восприимчивым к патогенам, и наиболее ориентирована на оптимизацию иммунологической защиты. Таким образом, лихорадка возникает из-за того, что большинство бактерий плохо размножаются при температуре выше 39 градусов, тогда как функция лимфоидных клеток оптимальна при этой температуре. Лихорадка возникает во время инфекции после активации макрофагов и последующего синтеза и высвобождения эндогенных пирогенных веществ, включая интерлейкин-1 (IL-1), фактор некроза опухоли (TNF), интерлейкин-6 (IL-6) и интерфероны ( IFN).Эти пирогены попадают в кровоток и оказывают свое действие на ЦНС в сосудистом органе терминальной пластинки (OVLT). Как обсуждалось в предыдущем разделе, OVLT является одним из нескольких участков в ЦНС, где гематоэнцефалический барьер относительно проницаем, что позволяет мозгу «пробовать» на вкус внутреннюю среду тела. Эндотелиальные клетки OVLT имеют рецепторы для эндогенных пирогенов, которые при активации вызывают как синтез, так и высвобождение в ЦНС простаноидов, в частности, простагландина E2 (PGE2), а также синтез и высвобождение в ЦНС IL-1, IL-6, TNF и IFN.PGE2 получает доступ к чувствительным к теплу клеткам POAH, непосредственно прилегающим к OVLT, где он связывается с поверхностными рецепторами и вызывает повышение клеточных уровней циклического АМФ. Повышенный цАМФ активирует систему протеинкиназы А, что приводит к снижению возбудимости чувствительных к теплу нейронов и снижению скорости их разряда. Это позволяет увеличить скорость разряда чувствительных к холоду нейронов, тем самым устанавливая новое, более высокое заданное значение температуры. Использование жаропонижающих средств, таких как аспирин и индометацин, противодействует лихорадке, прерывая синтез PGE2 за счет антагонизма ферментной системы циклооксигеназы в эндотелии OVLT.
«У человечества всего три великих врага: лихорадка, голод и война,
и из них, безусловно, самым сильным и самым ужасным является лихорадка ». |
Рисунок 3.6 |
Выделение тепла.Продолжительное воздействие или перенапряжение в очень теплой среде может привести к чрезмерной потере жидкости и электролитов, что приведет к мышечным спазмам, головокружению, рвоте и обмороку. В экстремальных условиях может развиться артериальная гипотензия. Однако тепловое истощение отличается от теплового удара тем, что заданное значение температуры тела остается хорошо регулируемым, а механизмы, обеспечивающие отвод тепла, остаются нетронутыми. Таким образом, кожа прохладная и влажная, а температура тела нормальная или немного ниже нормы.Отдых и замена жидкости и электролитов быстро исправляют это состояние.
Тепловой удар. Если не устранить тепловое истощение, оно может перейти в тепловой удар. Сильная гипотензия приведет к снижению кожного кровотока и уменьшению потоотделения. Впоследствии внутренняя температура повысится. Если это повышение будет слишком сильным, нормальное функционирование мозга может быть прервано, и контроль заданного значения температуры не удастся. Это приводит к дальнейшему ухудшению механизмов рассеивания тепла и позволяет внутренней температуре повышаться, что приводит к повреждению тканей, которое может привести к коме и затем смерти.Пациенту с тепловым ударом требуется неотложная медицинская помощь, и ему необходимо срочно снизить внутреннюю температуру за счет замены жидкости и электролита. При этом состоянии часто встречается повреждение печени, и желтуха может развиться через 1-2 дня после госпитализации. Возможна острая олигурическая почечная недостаточность. Развитие комы и диссеминированное внутрисосудистое свертывание крови — очень плохие прогностические факторы.
Злокачественная гипертермия — это группа наследственных заболеваний, характеризующихся внезапным и резким повышением внутренней температуры после воздействия газообразных анестетиков, включая галотан, метоксифлуран, циклопропан или этиловый эфир; или после воздействия миорелаксантов, особенно сукцинилхолина.Эти агенты вызывают чрезмерное высвобождение кальция из мышечного саркоплазматического ретикулума, что приводит к активации миозиновой АТФазы и, следовательно, к избыточному тепловыделению. Одна форма заболевания наследуется по аутосомно-доминантному типу, в то время как вторая наследуется рецессивным образом у мальчиков и реже у девочек, которые также имеют ряд других врожденных аномалий, составляющих синдром Кинга. Злокачественная гипертермия также иногда возникает при других миопатиях, таких как врожденная миотония и мышечная дистрофия Дюшенна.У некоторых пациентов наблюдается повышенный уровень креатининфосфокиназы, но у большинства он остается нормальным между приступами. Биопсия мышцы покажет ненормальное сокращение под воздействием кофеина или газового анестетика, но это, очевидно, неуклюжий способ проверки состояния. Тщательный анамнез хирургических осложнений у родственников и выявление других сопутствующих состояний — лучший способ обнаружить и предотвратить злокачественную гипертермию. Возникновение требует неотложной медицинской помощи и требует немедленного введения протокола лечения, предписанного Американским обществом анестезиологов.Операция и газовая анестезия прекращаются, все трубки от анестезирующих устройств заменяются, и начинается внешнее охлаждение. Даны стопроцентный кислород, 1-2 мг / кг бикарбоната натрия и 1 мг / кг дантролена натрия. Лекарства от сердечной аритмии назначаются по мере необходимости.
Рисунок 3.7 |
Гипотермия определяется как внутренняя температура 35 градусов или ниже и представляет собой потенциальную неотложную медицинскую помощь.Случайное переохлаждение является обычным явлением зимой после длительного воздействия, не обязательно чрезмерно низких температур, и может сопровождать сепсис, гипотиреоз, гипофизарную или надпочечниковую недостаточность, гипогликемию, инфаркт миокарда и прием наркотиков, особенно алкоголя. Однако переохлаждение может также возникать при определенных заболеваниях без воздействия, включая застойную сердечную недостаточность, уремию, передозировку лекарствами, острую дыхательную недостаточность и гипогликемию. Большинство этих пациентов — пожилые люди.Пациенты с центральной температурой ниже 26,7 ° C обычно находятся в бессознательном состоянии, имеют миотический, брадипноэ, брадикардию и гипотензию с генерализованным отеком. При основной температуре ниже 25 градусов пациенты находятся в коме, теряют подвижность и могут появиться трупное окоченение. Лечение требует создания проходимости дыхательных путей и подачи кислорода. Объем крови можно увеличить с помощью подогретой глюкозы, при этом тщательно отслеживаются газы крови и сердечный ритм. Внешнее согревание применяется только к грудной клетке, чтобы конечности оставались суженными, чтобы предотвратить резкое падение артериального давления.
3.9 Резюме
Несколько структур переднего мозга, диэнцефальных и стволовых структур связаны между собой, чтобы организовать работу вегетативной нервной системы. В совокупности это называется центральной автономной сетью и далее организовано в иерархию функциональных петель.
Гипоталамус является ключевым участком мозга для центрального контроля вегетативной нервной системы, а паравентрикулярное ядро является ключевым участком гипоталамуса для этого контроля.Главный путь от гипоталамуса для вегетативного контроля — это продольный дорсальный пучок.
Регулирование температуры тела является одним из примеров гипоталамического контроля над вегетативными ядрами ствола мозга и позвоночника, связанных с долгосрочными вегетативными рефлексами. Терморегуляция — это, в основном, функция теплочувствительных нейронов переднего преоптического гипоталамуса, которые непосредственно контролируют рассеивание тепла.
Лихорадка — наиболее частое нарушение терморегуляции. Лихорадка следует за высвобождением эндогенных пирогенов, которые повышают уровень простагландина E2 в преоптическом переднем гипоталамусе, что вызывает снижение активности теплочувствительных нейронов и последующее растормаживание чувствительных к холоду нейронов.
Проверьте свои знания
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
А. перивентрикулярное ядро
Б. паравентрикулярное ядро
C. переднее ядро
D. заднее ядро
E.вентромедиальное ядро
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
A. перивентрикулярное ядро. Ответ НЕПРАВИЛЬНЫЙ.
Б. паравентрикулярное ядро
C. переднее ядро
D. заднее ядро
E.вентромедиальное ядро
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
А. перивентрикулярное ядро
B. паравентрикулярное ядро. Ответ ПРАВИЛЬНЫЙ!
C. переднее ядро
D. заднее ядро
E. вентромедиальное ядро
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
А.перивентрикулярное ядро
Б. паравентрикулярное ядро
C. anterior nucleus Этот ответ НЕПРАВИЛЬНЫЙ.
D. заднее ядро
E. вентромедиальное ядро
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
А. перивентрикулярное ядро
Б.паравентрикулярное ядро
C. переднее ядро
D. Заднее ядро. Ответ НЕПРАВИЛЬНЫЙ.
E. вентромедиальное ядро
Наиболее важным ядром гипоталамуса для центральной регуляции вегетативной нервной системы является:
А. перивентрикулярное ядро
Б. паравентрикулярное ядро
с.переднее ядро
D. заднее ядро
E. вентромедиальное ядро. Ответ НЕПРАВИЛЬНЫЙ.
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро
B. дорсомедиальное ядро
C. дугообразное ядро
D. паравентрикулярное ядро
E. преоптическое переднее ядро
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро. Этот ответ НЕПРАВИЛЬНЫЙ.
B. дорсомедиальное ядро
C. дугообразное ядро
D. паравентрикулярное ядро
E. преоптическое переднее ядро
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро
B. дорсомедиальное ядро. Ответ НЕПРАВИЛЬНЫЙ.
C. дугообразное ядро
D. паравентрикулярное ядро
E. преоптическое переднее ядро
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро
B. дорсомедиальное ядро
C. arcuate nucleus Этот ответ НЕПРАВИЛЬНЫЙ.
D. паравентрикулярное ядро
E. преоптическое переднее ядро
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро
B. дорсомедиальное ядро
C. дугообразное ядро
D. паравентрикулярное ядро. Ответ НЕПРАВИЛЬНЫЙ.
E. преоптическое переднее ядро
В каком из следующих ядер гипоталамуса заданная температура тела кодируется чувствительными к температуре нейронами?
А.вентромедиальное ядро
B. дорсомедиальное ядро
C. дугообразное ядро
D. паравентрикулярное ядро
E. преоптическое переднее ядро. Ответ ПРАВИЛЬНЫЙ!
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
А.переднее преоптическое ядро
Б. паравентрикулярное ядро
C. заднее ядро
D. супраоптическое ядро
E. дугообразное ядро
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
A. Преоптическое переднее ядро. Ответ НЕПРАВИЛЬНЫЙ.
Б. паравентрикулярное ядро
C. заднее ядро
D. супраоптическое ядро
E. дугообразное ядро
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
А. переднее оптическое ядро
B. паравентрикулярное ядро. Ответ НЕПРАВИЛЬНЫЙ.
C. заднее ядро
D. супраоптическое ядро
E. дугообразное ядро
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
А. переднее оптическое ядро
Б. паравентрикулярное ядро
C. Заднее ядро. Ответ ПРАВИЛЬНЫЙ!
Д.супраоптическое ядро
E. дугообразное ядро
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
А. переднее оптическое ядро
Б. паравентрикулярное ядро
C. заднее ядро
D. супраоптическое ядро. Ответ НЕПРАВИЛЬНЫЙ.
E.дугообразное ядро
Какое ядро гипоталамуса считается центром генерации / сохранения тепла?
А. переднее оптическое ядро
Б. паравентрикулярное ядро
C. заднее ядро
D. супраоптическое ядро
E. arcuate nucleus Этот ответ НЕПРАВИЛЬНЫЙ.
Главный путь центральной автономной сети:
А.медиальный пучок переднего мозга
Б. Терминальная полоса
C. дорсальный продольный пучок
D. маммиллотегментарный тракт
E. спиногипоталамический тракт
Главный путь центральной автономной сети:
A. медиальный пучок переднего мозга. Этот ответ НЕПРАВИЛЬНЫЙ.
Б. Терминальная полоса
C. дорсальный продольный пучок
D. маммиллотегментарный тракт
E. спиногипоталамический тракт
Главный путь центральной автономной сети:
A. медиальный пучок переднего мозга
B. stria terminalis Этот ответ НЕПРАВИЛЬНЫЙ.
C. дорсальный продольный пучок
D. маммиллотегментарный тракт
E. спиногипоталамический тракт
Главный путь центральной автономной сети:
A. медиальный пучок переднего мозга
Б. Терминальная полоса
C. дорсальный продольный пучок. Ответ ПРАВИЛЬНЫЙ!
Д.маммиллотегментарный тракт
E. спиногипоталамический тракт
Главный путь центральной автономной сети:
A. медиальный пучок переднего мозга
Б. Терминальная полоса
C. дорсальный продольный пучок
D. Маммиллотегментарный тракт. Этот ответ НЕПРАВИЛЬНЫЙ.
E.спиногипоталамический тракт
Главный путь центральной автономной сети:
A. медиальный пучок переднего мозга
Б. Терминальная полоса
C. дорсальный продольный пучок
D. маммиллотегментарный тракт
E. спиногипоталамический тракт. Этот ответ НЕПРАВИЛЬНЫЙ.
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
А.Чувствительные к холоду нейроны ингибируются IL-1 и уменьшают потерю тепла.
B. Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов.
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холоду нейроны
E. Пирогены сужают кровеносные сосуды
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
А.Чувствительные к холоду нейроны ингибируются IL-1 и уменьшают потерю тепла. Это НЕПРАВИЛЬНЫЙ ответ.
B. Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов.
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холоду нейроны
E.Пирогены сужают сосуды
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
A. Чувствительные к холоду нейроны ингибируются IL-1 и снижают потерю тепла.
B. Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла. Это НЕПРАВИЛЬНЫЙ ответ.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов.
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холоду нейроны
E. Пирогены сужают кровеносные сосуды
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
A. Чувствительные к холоду нейроны ингибируются IL-1 и снижают потерю тепла.
Б.Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов. Это ПРАВИЛЬНЫЙ ответ!
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холоду нейроны
E. Пирогены сужают кровеносные сосуды
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
А.Чувствительные к холоду нейроны ингибируются IL-1 и уменьшают потерю тепла.
B. Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов.
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холодным нейроны. Этот ответ НЕПРАВИЛЬНЫЙ.
E.Пирогены сужают сосуды
Какое из следующих событий лучше всего объясняет возникновение лихорадки?
A. Чувствительные к холоду нейроны ингибируются IL-1 и снижают потерю тепла.
B. Чувствительные к теплу нейроны возбуждаются простагландином E2 и увеличивают приток тепла.
C. Температурные нечувствительные нейроны увеличивают активность расторможенных холодных чувствительных нейронов.
D. Нейроны в сосудистом органе подавляют чувствительные к теплу нейроны и стимулируют чувствительные к холоду нейроны
E. Пирогены сужают кровеносные сосуды. Этот ответ НЕПРАВИЛЬНЫЙ.
Отделение и функции вегетативной нервной системы (ВНС)
- Биологическая психология
- Неврология
- ANS
Определение, подразделения и функции
Оливия Гай-Эванс, опубликовано 28 апреля 2021 г.
Система (ВНС) является частью периферической нервной системы и отвечает за контроль жизненно важных функций, таких как сердцебиение, дыхание и пищеварение.Он также участвует в острой стрессовой реакции, работая с эндокринной системой, чтобы подготовить организм к борьбе или бегству. В дальнейшем его можно подразделить на симпатическую и парасимпатические отделы.
| Симпатическая | Парасимпатическая |
|---|---|
| Расширение зрачка | Сужение зрачка |
| Расширение мускулов | |
| Мышечное расширение | Сужение мышц | Слюна Повышение слюны Пониженная частота сердечных сокращений
| Стимулирует пищеварение | Подавляет пищеварение |
| Стимулирует потоотделение | Подавляет потоотделение |
ВНС передает информацию от внутренних органов тела, таких как печень и легкие, и к ним.Он работает автоматически и обычно считается быть вне сферы добровольного контроля.
Примеры функций, контролируемых ВНС: слюноотделение, потоотделение, изменение размера зрачка, управление частотой сердечных сокращений, плач и секреция гормонов.
Таким образом, ВНС отличается от соматической нервной системы (другой ветви периферической нервной системы), поскольку эта система связана с контролем произвольных движений тела. Хотя большинство функций ВНС автоматические, они могут работать вместе с соматической нервной системой.
ВНС работает, получая информацию либо от внешних раздражителей, либо от тела. Гипоталамус, который находится прямо над стволом головного мозга, получает регуляторный сигнал вегетативной нервной системы от лимбической системы (группы структур в глубине мозга, которые связаны с такими функциями, как память, эмоции и страх). Гипоталамус использует этот вход для управления большей частью активности ВНС.
Есть также три ключевых нейротрансмиттера, участвующих в успешной коммуникации внутри ВНС:
- Ацетилхолин — в основном обнаруживается в парасимпатической нервной системе, которая оказывает тормозящее действие.
- Адреналин — также известный как адреналин, в основном обнаруживается в симпатической нервной системе и оказывает стимулирующее действие.
- Норэпинефрин — также известный как норадреналин, в основном обнаруживается в симпатической нервной системе и оказывает стимулирующее действие.
Функции
Ниже приведен список некоторых функций ANS:
- Механизм реакции «бей или беги»
- Регулировка артериального давления
- Регулировка частоты сердечных сокращений
- Секреция биологических жидкостей, таких как как слюна, пот и моча
- Дыхание
- Регулирование температуры тела
- Зрачковые реакции
- Регулирование метаболизма
ВНС важен для регулирования тела, необходим для поддержания гомеостаза.Это означает баланс условий и функций организма, необходимых для жизни.
В последнее время считается, что ВНС ассоциируется с эмоциями. Активация ВНС была обнаружена, когда люди реагировали на положительные и отрицательные эмоции (Shiota et al., 2011).
Подразделения ANS
Есть три отделения ANS; симпатическая нервная система, парасимпатическая нервная система и кишечная нервная система.
Симпатический и парасимпатический отделы вегетативной нервной системы имеют противоположные свойства. воздействие на различные системы.Две системы имеют взаимодополняющие функции, работая в тандем для поддержания гомеостаза тела
Нервы в симпатической нервной системе помогают подготовить организм к чему-то, что происходит в окружающей среде, и расходуют энергию. Нервы в парасимпатической нервной системе в основном работают, регулируя функции организма в состоянии покоя, контролируя в основном более «тихую» деятельность.
Симпатическая нервная система
Симпатическая нервная система, которая участвует в ответных реакциях, которые помогают нам справляться с чрезвычайными ситуациями.Замедляется телесно процессы, которые менее важны в чрезвычайных ситуациях, например, пищеварение. Например, если в комнате жарко, симпатическая система побуждает тело потеть в ответ на это изменение.Наиболее заметная функция симпатической ветви — это реакция «бей или беги». В условиях, которые считаются угрожающими или стрессовыми, симпатическая система активируется, обеспечивая автоматическую реакцию.
Например, когда вы идете домой в одиночестве по темной улице, это может быть пугающим для многих людей.Во время ходьбы ваши зрачки могут расширяться, частота сердечных сокращений может увеличиваться, и вы можете потеть.
Эта реакция на стрессовую ситуацию вызвана высвобождением большого количества нейромедиатора адреналина из надпочечников. Как только этот стимулирующий нейромедиатор высвобождается, это вызывает автоматические реакции организма. Цель стимуляции этих телесных реакций — подготовить человека либо к побегу, либо к борьбе в опасных ситуациях.
Хотя симпатическая нервная система эволюционно использовалась в опасных для жизни ситуациях, современная жизнь и психическое здоровье также могут вызвать эту реакцию.
Стресс, связанный с работой, финансовые проблемы и проблемы в отношениях — примеры того, когда симпатическая нервная система может вызывать эту стрессовую реакцию.
Точно так же люди с тревожными расстройствами и фобиями испытывают большое количество адреналина, в результате чего они испытывают такие же вегетативные реакции, как если бы они находились в опасных для жизни ситуациях.
Парасимпатическая нервная система
Парасимпатическая нервная система, которая расслабляет человека после того, как чрезвычайная ситуация прошла (например,замедляет сердце снижает скорость и снижает кровяное давление) и сохраняет естественную активность организма, уменьшая активность / поддерживая ее.Парасимпатическая нервная система связана с возвращением тело в состояние покоя, такие как регулирование частоты сердечных сокращений, расслабление мышц и управление мочевым пузырем. Это делает парасимпатическую нервную систему важной для поддержания гомеостаза.
Парасимпатическая нервная система также может вступить в действие после исчезновения угрожающей ситуации.Например, если вспомнить сценарий, когда вы идете ночью домой в одиночестве, когда вы вернулись домой и угроза исчезла, тело расслабляется.
Зрачки сужаются, частота сердечных сокращений возвращается к ритму покоя, а потоотделение уменьшается или прекращается.
Таким образом, парасимпатическая система важна для того, чтобы мы могли вернуться к нормальному состоянию после стрессовой ситуации. Без этой системы тело будет постоянно бдительным, истощая всю энергию, и может привести к хроническому стрессу.
Кишечная нервная система
Кишечная нервная система (ENS) — это ветвь ANS, которая действует независимо от центральной нервной системы. Эта система состоит из нейронов, которые ограничены желудочно-кишечным трактом (также известным как кишечник).Он также может функционировать автономно симпатической и парасимпатической нервной систем, хотя и может находиться под их влиянием.
Нейроны, составляющие кишечную систему, отвечают за управление моторными функциями системы, а также за секретирование ферментов в желудочно-кишечном тракте.Типы нейронов в кишечной системе: сенсорные, моторные и интернейроны.
Нейроны в этой системе взаимодействуют через множество нейромедиаторов, таких как дофамин, серотонин и ацетилхолин. Цепи нейронов в этой системе также способны контролировать местный кровоток и модулировать иммунные функции.
Вегетативная дисфункция
Даутономическая дисфункция или дизавтономия — это состояние, при котором вегетативная нервная система (ВНС) не функционирует должным образом.
В развитых странах наиболее частой причиной проблем с ВНС является диабет (Bishop, 2010). Однако другие причины могут быть связаны с наследственными причинами, старением, болезнью Паркинсона, раком или синдромом хронической усталости. Другие причины могут быть вызваны повреждением головы, повреждением шейных нервов, злоупотреблением алкоголем и наркотиками или инфекциями.
Если кто-то считает, что у него может быть проблема с ВНС, он может демонстрировать один или несколько из следующих симптомов:
- Аномально высокое или низкое кровяное давление
- Отсутствие реакции зрачков
- Тяжелая тревога или депрессия
- Проблемы с пищеварением
- Дыхание
- Отсутствие потоотделения или слишком сильное потоотделение
- Тахикардия (ненормально учащенное сердцебиение)
- Проблемы с недержанием мочи
- Ощущение недержания или боли
- Головокружение
- Чувство слабости или фактическое обморок
Вегетативная невропатия относится к повреждению вегетативных нервов.Это заболевания, которые могут поражать симпатические нервы, парасимпатические нервы или и то, и другое.
Признаки вегетативной невропатии включают фиксированную частоту сердечных сокращений, запор, аномальное потоотделение, уменьшение размера зрачка и отсутствие или задержку световых рефлексов (Bankenahally & Krovvidi, 2016).
Существует ряд других расстройств, которые могут быть результатом дисфункции ВНС:
- Острый вегетативный паралич — связанный с повреждением спинного мозга, приводящим к острой и неконтролируемой гипертензии.
- Множественная системная атрофия — редкое заболевание, которое вызывает постепенное повреждение нервных клеток. Чистая вегетативная недостаточность — нарушение многих процессов, контролируемых ВНС.
- Семейная дизавтономия — также известная как синдром Райли-Дея. Это наследственное заболевание, при котором нервные волокна не функционируют должным образом, поэтому эти люди плохо чувствуют боль, температуру, давление и не могут расположить руки и ноги.
Диагностика и лечение вегетативной дисфункции
Если человек испытывает вышеупомянутые симптомы и хочет знать, связано ли это с дисфункцией ВНС, существует множество тестов, которые можно провести, в зависимости от испытываемого симптома. .
Например, при нарушении сердечного ритма врач может использовать электрокардиограмму для измерения электрической активности сердца.
Мониторы артериального давления также можно использовать для проверки того, является ли артериальное давление аномально высоким или низким. Потовые пробы можно использовать для оценки того, правильно ли работают потовые железы.
Это включает использование электродов для стимуляции желез и измерения объемов пота, производимого при предъявлении раздражителя. Тесты зрачкового светового рефлекса также можно использовать для определения того, насколько зрачки чувствительны к изменениям света и реагируют ли они должным образом или нет.
Эти типы медицинских осмотров необходимы, если кто-то считает, что у него могут быть проблемы с ВНС. Как правило, если есть проблема, это может потребовать большого количества проб и ошибок многих тестов, чтобы можно было диагностировать состояние.
Возможность лечения дисфункционального ВНС опять же зависит от типа поставленного диагноза. Например, если причиной дисфункции является диабет, контроль уровня сахара в крови будет основным лечением. Во многих случаях лечение основного заболевания (если применимо) может позволить поврежденным нервам в ВНС восстановиться и восстановиться.
Возможно, врач порекомендует изменить образ жизни для лечения дисфункции ВНС. Это может быть более частые упражнения или изменение пищевых привычек или диеты, сокращение потребления кофеина или прием витаминных добавок.
Медикаментозная терапия также доказала свою эффективность в лечении или управлении дисфункцией ВНС. Это могут быть лекарства, которые используются для снижения артериального давления, и нестероидные противовоспалительные средства, которые помогают контролировать боль (особенно при фибромиалгии).
Точно так же антидепрессанты и лекарства от тревожности могут помочь с симптомами тревоги, и было показано, что они помогают восстановить баланс ВНС.
Об авторе
Оливия Гай-Эванс получила степень бакалавра педагогической психологии в Университете Эдж-Хилл в 2015 году. Затем она получила степень магистра психологии образования в Бристольском университете в 2019 году. Оливия работала в качестве помощника. работник для взрослых с нарушением обучаемости в Бристоле за последние четыре года.
Как ссылаться на эту статью: Как ссылаться на эту статью:Guy-Evans, O. (2021, 28 апреля). Вегетативная нервная система: определение, разделение и функции. Просто психология. https://www.simplypsychology.org/autonomic-nervous-system.html
Frontiers | Регуляция вегетативной нервной системы кишечника
Введение
Иннервация желудочно-кишечного тракта включает внешнюю вегетативную нервную систему (ВНС) и внутреннюю кишечную нервную систему (ЭНС).Родственные рецепторы нейромедиаторов широко распространены в различных клетках кишечника. Симпатический нерв кишечника берет свое начало от передних позвоночных ганглиев и иннервирует различные сегменты кишечника (рис. 1). Это свойство помогает сбалансировать различные функции гомеостаза, такие как контроль сосудистого напряжения, регулирование активности гладких мышц кишечника, уменьшение секреции слизистой оболочки (Browning and Travagli, 2014). Кишечный вагус регулирует перистальтику тонкой и толстой кишки, а также перистальтику желудка и секрецию (Costa et al., 2000; Bohorquez et al., 2015). Регуляция симпатических и парасимпатических путей желудочно-кишечного тракта играет решающую роль в регенерации слизистой оболочки кишечника и иммунном ответе. Симпатические и парасимпатические волокна, входящие в стенку кишечника, образуют синаптические связи с ганглиями кишечника, гладкими мышцами и слизистой оболочкой (Costa et al., 2000; Bohorquez et al., 2015). Симпатическая нервная система (СНС) и парасимпатическая нервная система (ПНС) могут функционировать независимо от кишечника. Нервные окончания из SNS плотно сконцентрированы в основании крипты, где расположены кишечные стволовые клетки (ISC) (Norberg, 1964; Gabella and Costa, 1968), тогда как нервы PNS и кишечные эпителиальные клетки (IEC) напрямую синапсируются (Bohorquez et al. al., 2015). Эффекты норадреналина NE на кишечные эпителиальные клетки могут передаваться посредством передачи сигналов SNS. Возможно, что SNS и PNS напрямую контролируют IEC. Хотя и PNS, и ENS используют ацетилхолин (Ach) в качестве нейромедиатора, денервация PNS с интактными цепями ENS отрицательно влияет на пролиферацию кишечного эпителия (Mcconalogue and Furness, 1994) и воспаление (Ghia et al., 2006, 2007). Эти данные предполагают, что ПНС может регулировать регенерацию и воспаление слизистой оболочки кишечника.
Рисунок 1. Распространение нейронной сети кишечника. Внешние симпатические и парасимпатические нервные волокна проникают во весь слой стенки кишечника, образуя сложные нейронные сети с внутренними кишечными нервными и EGC, которые иннервируют эпителиальные и иммунные клетки желудочно-кишечного тракта. Эпителий дифференцируется от стволовых клеток кишечника, демонстрируя энтероциты, эндокринные клетки, бокаловидные клетки и клетки Панета. Стромальные клетки кишечника и различные иммунные клетки находятся в стенке кишечника, последние включают макрофаги (Mϕs), лимфоциты, тучные клетки (MC), дендритные клетки (DC) и врожденные лимфоидные клетки (ILC).Нейронные сети кишечника регулируют клетки кишечника через нейротрансмиттеры (ACh, NE, ATP и т. Д.), Нейротрофические факторы (GDNF и т. Д.) И рецепторы (AChR, AR, P2Y4, RET и т. Д.).
Автономная нервная система может функционировать через кишечные стромальные клетки и иммунные клетки, которые включают макрофаги (Mϕs), лимфоциты, тучные клетки (MC), дендритные клетки (DC) и врожденные лимфоидные клетки (ILC) в кишечнике. Они либо образуют синапсы с вегетативными нервами, либо экспрессируют рецепторы нейромедиаторов, которые оказывают положительное или отрицательное влияние на физиологические и патологические состояния кишечника (Ghia et al., 2006, 2007). Документально подтверждено, что вегетативная нервная система прямо или косвенно регулирует физиологическую активность IEC, стромальных клеток, кишечных нервов и иммунных клеток кишечника. В настоящем обзоре мы обсудим регуляцию вегетативной нервной системы кишечника в физиологических и патологических условиях, что обеспечит новые стратегии лечения различных кишечных заболеваний.
Вегетативная нервная система регулирует пролиферацию эпителиальных клеток кишечника
Для поддержания надлежащей функции тканей IECs быстро обновляются, и этот процесс осуществляется с помощью ISC, которые размножаются в криптах (Barker et al., 2007). Стволовые клетки на дне крипты делятся с образованием клеток-предшественников, усиливающих транзит (ТА). Как только они достигают основания ворсинок, эти клетки завершают дифференцировку и созревают. Многочисленные доказательства показали, что ВНС участвует в пролиферации эпителиальных клеток и влияет на гомеостаз кишечника.
Влияние вегетативных нейротрансмиттеров и рецепторов на пролиферацию эпителиальных клеток кишечника
Симпатическая нервная система и нервные окончания ПНС примыкают к синапсу или непосредственно с ним (Gabella and Costa, 1968; Bohorquez et al., 2015). Было продемонстрировано, что IEC экспрессируют несколько вегетативных рецепторов нейромедиаторов [M1-5 (Greig and Cowles, 2017), α-2A (Paris et al., 1990; Valet et al., 1993; Schaak et al., 2000), β- 2 (Zeng et al., 2020), Table 1], которые участвуют в регуляции пролиферации кишечного эпителия. Исследователи сообщили, что холинергические нейроны напрямую контролируют ISC (Lundgren et al., 2011). Greig и Cowles (2017) обнаружили, что глубина подвздошных крипт была увеличена у всех пяти мышей с нокаутом, лишенных подтипов мускариновых рецепторов (M1KO-M5KO), чем у мышей дикого типа.Индекс пролиферации подвздошных крипт был значительно увеличен у четырех мышей с нокаутом, за исключением мышей M4KO. Schaak et al. (2000) подтвердили, что активация рецептора адреналина α2A увеличивает пролиферацию эпителиальных клеток CaCo2 кишечника. Примечательно, что подтипы M1 и M3 рецепторов α2A, ассоциированных с SNS, и рецепторов ACh, ассоциированных с PNS, повышены в ISC по сравнению с таковыми в клетках Панета (Davis et al., 2018). Мускариновые рецепторы M3 и M5 существуют на ISC (Lundgren et al., 2011).Они могут быть важными мишенями для последующего воздействия на распространение и дифференциацию ISC.
Таблица 1. ANS регулирует пролиферацию кишечных клеток.
Кроме того, хорошо известно, что клетки Панета и стромальные клетки, как содержимое высокоструктурированной ниши, в которой находятся ISC, являются источниками Wnts и R-спондинов для ISC. В частности, стромальные клетки продуцируют Wnts, R-спондин 1 и R-спондин 3 для активации пути Wnt в ISC, которые могут поддерживать стволовые клетки и предотвращать острое повреждение кишечника (Greicius et al., 2018; Wu et al., 2021). Было продемонстрировано, что нервная система регулирует пролиферацию и дифференцировку IEC через клетки Панета и стромальные клетки. Например, активация рецептора ацетилхолина (AChR) регулирует функцию клеток Панета (Satoh, 1988; Satoh et al., 1992), а иннервация блуждающего нерва требуется для функционирования стромальных клеток (Olivier et al., 2016).
Экзогенное введение первичных вегетативных нейромедиаторов изменяет пролиферацию кишечных клеток (таблица 1).Агонисты альфа-2 увеличивают пролиферацию эпителия в тощей кишке и толстой кишке у мышей и крыс, тогда как терапия фентоламином (альфа-адренергические антагонисты) снижает количество клеток в криптах тощей кишки у крыс. Напротив, агонисты α-1 и бета-адренорецепторов ингибируют пролиферацию клеток в кишечнике (Tutton, 1975; Kennedy et al., 1983). Эти методы не стимулируют и не ингибируют пролиферацию клеток рака толстой кишки (Tutton and Barkla, 1977). Недавние исследования показали, что NE и ACH регулируют пролиферацию органов кишечника за счет снижения экспрессии циклина D1 (Davis et al., 2018). Агонисты ACh снижают пролиферацию эпителиальных органов кишечника (Takahashi et al., 2014). Наша группа показала, что рецептор β2 совмещен с Olfm4 + ISC в криптах. Лечение изопротеренолом улучшает снижение количества ISC во время химиотерапии (Zeng et al., 2020). Это опосредуется активацией β2-адренергического рецептора на ISC (Zeng et al., 2020). Функция симпатических нервов также была продемонстрирована с использованием генетических подходов к стволовым клеткам, таким как гемопоэтические стволовые клетки (Lucas et al., 2013) и стволовые клетки волосяных фолликулов (Shwartz et al., 2020). Эти данные указывают на то, что вегетативная нервная система играет важную роль в регенерации слизистой оболочки кишечника при патологических состояниях. Вегетативные ко-трансмиттеры связываются с рецепторами на ISC, чтобы влиять на клеточную пролиферацию. Например, вазоактивные пептиды (Khedr et al., 2018; Iwasaki et al., 2019), нейропептиды Y (Erlinge et al., 1994; Oben et al., 2003) и аденозинтрифосфат (АТФ) (Erlinge et al., 1993, 1994) могут регулировать пролиферацию кишечных клеток.Эти исследования подтверждают, что ANS может регулировать пролиферацию ISC и регенерацию тканей через нейротрансмиттеры и их рецепторы.
Влияние денервации вегетативных нервов на пролиферацию эпителиальных клеток кишечника
Хирургическая или химическая абляция ветвей ВНС, симпатических или парасимпатических нервов, вызывает потерю автономных источников нейротрансмиттеров и изменяет пролиферацию клеток кишечных крипт (Tutton and Helme, 1974; Musso et al., 1975; Цибулевский и Орлова, 1976; Lachat and Goncalves, 1978; Kennedy et al., 1983; Каллаган, 1991). Направление изменений пролиферации основано на времени после денервации (Davis et al., 2017). Было показано, что после денервации SNS или PNS пролиферация увеличивается (Цибулевский, Орлова, 1976; Lachat, Goncalves, 1978; Callaghan, 1991) и уменьшается (Tutton, Helme, 1974; Musso et al., 1975; Lachat and Goncalves, 1978; Kennedy et al., 1983; Callaghan, 1991) в разные моменты времени. Несколько исследований показали, что после удаления SNS или PNS кишечник возвращается к нормальному уровню пролиферации (Musso et al., 1975; Лачат и Гонсалвес, 1978; Davis et al., 2017), что является удовлетворительной информацией для пациентов, которым требуется денервация вегетативных нервов. Пролиферация кишечного эпителия в кишечнике крыс после денервации ПНС снижалась в течение первых 3 дней (Musso et al., 1975; Lachat, Goncalves, 1978), тогда как пролиферация клеток в тощей кишке (Цибулевский, Орлова, 1976; Callaghan, 1991) и подвздошной кишке ( Callaghan, 1991) вернулся в норму через 7 дней после денервации PNS. Предыдущие исследования выявили косвенное влияние на пролиферацию из-за изменений в приеме пищи, воспаления или других факторов, которые изменяют пролиферацию IEC после операции по денервации (Dailey, 2014; Slater et al., 2017; Goldstein et al., 2021). Например, нейроны, экспрессирующие связанный с агути белок (AgRP), представляют собой высокоактивную группу гипоталамусов во время голода, которые значительно способствуют пищевому поведению, а прямая инъекция питательных веществ в кишечник приводит к устойчивому и быстрому снижению активности нейронов AgRP (Aponte et al. ., 2011). Субдиафрагмальная ваготомия снижала влияние жира на активность нейронов AgRP, изменяя потребление определенной пищи (Goldstein et al., 2021).
Влияние денервации SNS на пролиферацию кишечного эпителия, по-видимому, связано со степенью денервации, вызванной различными методами денервации.Химическая денервация (6-OHDA) симпатических нервов привела к долгосрочному снижению пролиферации (Tutton and Helme, 1974; Kennedy et al., 1983), наряду с уменьшением скрытых ISC (Zeng et al., 2020). Однако более точная денервация оказывает краткосрочное воздействие на тощую кишку (Tutton and Helme, 1974). Следовательно, вегетативная нервная система кишечника может напрямую влиять на пролиферацию IEC на ранней стадии после денервации.
Иммунная регуляция кишечника с помощью системы ANS
Эпителиальные клетки кишечника (IEC)
Кишечный физический барьер был образован IEC и плотным соединением между IEC, которое является самой большой поверхностью обмена между телом и внешней средой.Как только барьерная функция кишечного эпителия нарушена или нарушена, это вызовет бактериальную транслокацию, что приведет к серьезному удару по множественным органам и системам организма с сепсисом и даже смертью (Magnotti and Deitch, 2005). Вегетативный нерв может изменять барьерную функцию при физиологических и патологических состояниях. Экстрадуральный внутригрудной лидокаин может блокировать симпатические нервы, подавляя активацию кишечных макрофагов и разрушение кишечного барьера слизистой оболочки у мышей с эндотоксемией (Schaper et al., 2013). Стимуляция блуждающего нерва (VNS) снижает проницаемость кишечника у мышей с эндотоксемией, вызванной липополисахаридами (LPS), и противодействует повреждению плотных соединений (Zhou et al., 2013).
Было продемонстрировано влияние парасимпатических нейромедиаторов и рецепторов на барьерную функцию. Ацетилхолин (ACh) опосредует повышенную проницаемость толстой кишки при дисфункции барьера, вызванной стрессом, у крыс, в то время как антагонисты мускариновых рецепторов блокируют повышенную проницаемость толстой кишки в стрессовых условиях (Gareau et al., 2007). Активация рецептора M3 увеличивает транспорт макромолекул в IEC мыши и человека (Cameron and Perdue, 2007). Однако защитный эффект мускариновых рецепторов на поддержание кишечного эпителиального барьера наблюдался в различных условиях. Было продемонстрировано, что активация мускариновых рецепторов в монослое эпителиальных клеток CaCO-2 противодействует индуцированному интерлейкином (IL) -1β нарушению барьера за счет снижения трансляции белка киназы легкой цепи миозина (Schutz et al., 2015). Активация мускаринового рецептора бетанехолом вызывает цитокиновую экспозицию эпителиальных клеток и снижение экспрессии окклюдина (Slater et al., 2017). Точно так же активация мускариновых рецепторов M1 или M3 противодействует разрушению единственного слоя кишечного эпителиального барьера, вызванному медиаторами воспаления (Khan et al., 2014; Uwada et al., 2017). Кроме того, никотиновые рецепторы влияют на поддержание целостности кишечного эпителиального барьера, особенно на никотиновые ацетилхолиновые рецепторы α7 (α7-nAchR).Было показано, что рецептор противодействует изменениям в белке плотных контактов у крыс и увеличивает проницаемость кишечника, вызванную LPS (Zhang and Li, 2012; Zhou et al., 2013). Подобные результаты наблюдались на моделях нарушения целостности барьера, вызванного ожогами, в которых инъекции никотина предотвращают снижение индуцированного ожогом окклюдина и zonula occludens (ZO) -1 для поддержания функции кишечного барьера (Costantini et al., 2012). Активация AChR опосредует функцию клеток Панета (Satoh, 1988; Satoh et al., 1992), бокаловидные клетки (Gustafsson et al., 2012; Birchenough et al., 2016) и энтероэндокринные клетки (Anini and Brubaker, 2003), такие как дегрануляция и секреция. Активация AChR приводит к увеличению презентации антигена бокаловидными клетками (Mcdole et al., 2012). Таким образом, парасимпатический нерв играет незаменимую роль в регуляции кишечного барьера.
Кишечная нервная система (ENS)
Кишечную нервную систему называют «вторым мозгом», которому позволено регулировать поведение кишечника без участия центральной нервной системы.Хотя ENS может функционировать независимо, вегетативные нервные волокна, входящие в стенку кишечника, могут образовывать синаптические связи с частью ганглиозных клеток кишечника (Costa et al., 2000; Рисунок 1). Внешние связи от ЦНС к ENS состоят из симпатических и парасимпатических нервных волокон. ENS может регулировать иммунитет кишечника через синапсы с кишечным нейроном.
Энтероглиальные клетки (EGC) в качестве опорных клеток кишечных нейронов образуют коммуникационную сеть в стенке кишечника посредством секреции связанных с нейронами факторов, регулирующих кишечный иммунитет и пролиферацию эпителиальных клеток (Ochoa-Cortes et al., 2016). Исследователи признали роль вегетативной иннервации в EGCs (Рисунок 1). Гулбрансен и Шарки (2009) и Гулбрансен и др. (2010) продемонстрировали, что симпатические пути участвуют в регуляции EGCs. Симпатические волокна активируют EGC, высвобождая АТФ через пуринергические рецепторы P2Y4 на EGC. Nasser et al. (2006) обнаружили, что EGCs экспрессируют альфа-2-адренергический рецептор, несмотря на то, что функциональное значение рецептора не оценивалось. Активация EGC ослабляет нарушение кишечного эпителиального барьера через VNS (Costantini et al., 2010). EGC секретируют оксид азота, который участвует в поддержании гомеостаза кишечника и регуляции транспорта ионов в эпителиальных клетках (Maceachern et al., 2011).
Стромальные клетки
Стромальные клетки кишечника, как часть ниши стволовых клеток, также называются миофибробластами кишечника. Его важная роль в распространении и дифференциации ИЭК была описана выше. Было показано, что стромальные клетки экспрессируют широкий спектр рецепторов нейромедиаторов в различных тканях и обладают способностью реагировать на различные нейротрансмиттеры.Таким образом, вероятно, что ANS-иннервация кишечника может прямо или косвенно влиять на стромальные клетки кишечника (Wheatley et al., 1992; Obara et al., 2000; Pereira et al., 2003; Méndez-Ferrer et al. , 2010; рисунок 1). Было показано, что стромальные клетки толстой кишки активировались во время острого воспаления, вызванного декстрансульфатом натрия (DSS). Повышающая регуляция экспрессии хемокинов CXCL13 и CCL20 в стромальных клетках блокировалась, когда блокировалась внешняя иннервация блуждающего нерва, что подразумевает функцию чувствительности и ответа блуждающего нерва (Olivier et al., 2016). Кроме того, трансплантация мезенхимальных стволовых клеток (МСК), горячая область исследований, может способствовать de novo функциональной регенерации кишечного нерва посредством нейротрофического фактора глиальных клеток (GDNF), но не посредством прямой транс -дифференцировки (Lin et al. ., 2015). Эти исследования выявили возможность двунаправленной регуляции стромальных клеток и ВНС.
Макрофаги (Mϕs)
Макрофаги в желудочно-кишечном тракте представляют собой весьма гетерогенную популяцию, способную воспринимать сигналы окружающей среды и адаптироваться к ним (Lavin et al., 2014; Окабе, Меджитов, 2014). Морфологические исследования показали, что как внешние вегетативные нервы, так и внутренние нервные пути являются синаптическими с мышечными Mϕs (Ghia et al., 2007; Phillips and Powley, 2012; Figure 1). Cailotto et al. (2014) предоставили доказательства того, что эфферентные волокна блуждающего нерва находятся в контакте с холинергическими нейронами в миентерическом слое, тогда как холинергические нейроны кишечника имеют нервные окончания, которые близки к резидентным Mϕs, экспрессирующим α7-nAChR. Агонист α7-nAChR, агонист рецептора 5-гидрокситриптамина 4 (5-HT4R) и VNS активируют рецептор α7-nAChR на Mϕ для улучшения опорожнения желудка и воспаления кишечника (de Jonge et al., 2005; The et al., 2007; Цучида и др., 2011). Эфферентные волокна блуждающего нерва преимущественно взаимодействуют с энтеросолюбильными нейронами nNOS, VIP и ChAT в мышцах кишечника, а не с Mϕs. Эти nNOS, VIP и ChAT-положительные нейрональные волокна тесно контактируют с Mϕs (Cailotto et al., 2014), которые могут модулировать Mϕ кишечника для получения противовоспалительных эффектов, таких как стимулирование выработки IL-10 и подавление экспрессии. iNOS в макрофагах (Delgado et al., 1999). Активность блуждающего нерва усиливает фагоцитоз кишечных макрофагов, подавляя иммунную реактивность через α4β2nAChR (van der Zanden et al., 2009). Внешние симпатические нейроны, иннервирующие мышечную оболочку кишечника, активируют β2-адренорецепторы на мышечных макрофагах, усиливая программы тканевой защиты при бактериальной инфекции просвета (Gabanyi et al., 2016). Следовательно, Mϕs регулируются сложным набором нейронов, включая непрямую регуляцию с помощью блуждающего нерва и прямую регуляцию с помощью симпатического пути (Matteoli et al., 2014), которые помогают ограничивать чрезмерное повреждение тканей и воспалительную реакцию. Следовательно, Mϕ участвуют в противовоспалительном пути, опосредованном симпатическими и парасимпатическими путями.
Лимфоциты
Лимфоциты — главный исполнитель иммунной системы в организме. Недавние открытия показывают, что ПНС регулирует баланс между различными типами лимфоцитов в кишечнике (рис. 1). Morishita et al. (2015) продемонстрировали, что VNS в модели травмы / геморрагического шока увеличивает соотношение Treg / Th47 в мезентериальных лимфатических узлах после повреждения, что способствует толерантности к воспалению. Сообщалось о подавляющем эффекте никотина на активацию В-клеток, который опосредуется субъединицами α2, α4 и β2 нАХР (Skok et al., 2005). Эти данные показывают, что парасимпатическая иннервация защищает от иммунных / воспалительных реакций. Ваготомия подавляла активность Treg-клеток, что приводило к нарушению толерантности к антигену, что увеличивало тяжесть колита (Di Giovangiulio et al., 2016). Печеночный афферентный нерв блуждающего нерва отвечает за непрямую сенсорную микросреду кишечника и передает входной сигнал в ядро солитарного тракта ствола мозга, в конечном итоге эфферентный к блуждающему нерву и энтеральным нейронам.Этот путь поддерживает периферические регуляторные Т-клетки через AChR в кишечных антиген-презентирующих клетках (Teratani et al., 2020).
Было показано, что адренергический нейрональный путь оказывает прямое и косвенное влияние на активность Treg-клеток. Все первичные и вторичные лимфоидные органы получают симпатический вход от постганглионарных симпатических волокон, таких как селезенка, лимфоидные узлы, тимус и костный мозг (Felten et al., 1985; Nance and Burns, 1989; Bellinger et al., 1992). Активация сигнала β2-адренорецептора симпатического нерва нарушает дифференцировку и функцию Th2-клеток и снижает продукцию IL-12, TNF-α и IFN-γ (Sanders et al., 1997; Еленков и др., 2000). Симпатические волокна активируют рецептор адреналина β2 для усиления иммуносупрессивной активности Treg-клеток (Guereschi et al., 2013). Было продемонстрировано, что активация Treg-клеток опосредована косвенно через DC (Nijhuis et al., 2014). Лимфоциты играют жизненно важную роль в холинергическом противовоспалительном пути (CAIP) (Рисунок 2), что было подтверждено наблюдением, что CAIP не возникает у голых мышей, лишенных Т-клеток (Rosas-Ballina et al., 2011). CAIP зависит от норэпинефрина, продуцируемого симпатическими волокнами селезенки (Rosas-Ballina et al., 2008), что может приводить к тому, что Т-клетки ChAT + высвобождают ацетилхолин через рецептор β2 (Rosas-Ballina et al., 2011; Vida et al., 2011). Ацетилхолин из лимфоцитов связывается с α7-nAChR на не-Т-клетках костного мозга вместе с ингибированием LPS-опосредованной продукции цитокинов (Olofsson et al., 2012). Следовательно, симпатическая иннервация кишечника может играть важную роль в Treg-клетках, активируя β2 рецептор надпочечников для поддержания ответа кишечной толерантности, опосредованного иммуносупрессией Treg-клеток.Эти данные позволяют предположить, что как холинергические, так и адренергические пути участвуют в пролиферации лимфоцитов и функционируют в процессе воспаления кишечника.
Рисунок 2. Механизмы холинергического противовоспалительного пути. CAIP зависит от норэпинефрина, продуцируемого симпатическими волокнами селезенки, что может привести к тому, что Т-клетки ChAT + высвобождают ACh через рецептор β2. ACh из ChAT + T-клетки связывается с α7-nAChR на не-T-клетках костного мозга, таких как макрофаги, вместе с ингибированием LPS-опосредованной продукции цитокинов.
прочие
В дополнение к вышеупомянутым ячейкам, MC, DC и ILC могут регулироваться ANS (рисунок 1). MC представляют собой тип кишечных иммунных клеток, которые контролируют нейроиммунную активность посредством двусторонней связи. Анатомически блуждающий нерв проникает в слизистую оболочку кишечника и контактирует с ТК, тогда как ваготомия снижает плотность ТК (Stead et al., 2006). Активация nAChRs может ингибировать IgE-индуцированную дегрануляцию MC костного мозга у мышей (Kageyama-Yahara et al., 2008).VNS может вызывать усиление гистаминового иммунного ответа в MC слизистой оболочки кишечника, что может быть опосредовано снижением дегрануляции MC (Stead et al., 2006). Богатое липидами энтеральное питание ослабляет активацию МК кишечника в модели послеоперационной кишечной непроходимости (POI) и в модели LPS-индуцированного острого энтерита за счет стимуляции вагусного пути (Lubbers et al., 2009; de Haan et al., 2013).
Кишечные ДК участвуют в презентации антигена, регулируют дифференцировку лимфоцитов и одновременно экспрессируют несколько рецепторов нейромедиаторов, что позволяет регулировать нервную систему (Alpaerts et al., 2015). Например, активация рецептора β-2 надпочечников стимулирует противовоспалительные свойства DC in vitro , о чем свидетельствует усиление эндоцитоза и увеличение продукции IL-10 (Nijhuis et al., 2014). ДК экспрессируют рецепторы M3, M4 и M5. Холинергический агонист карбахол индуцирует дифференцировку ДК, увеличивая экспрессию HLA-DR и CD86 и увеличивая продукцию TNF-α и IL-8, которые полностью блокируются атропином (Salamone et al., 2011). Наконец, ILC в первую очередь связаны с ENS.Было продемонстрировано, что нейротрофические факторы или нейропептиды обладают потенциалом иммунорегуляции для ILC. EGC секретируют различные нейротрофические факторы семейства GDNF, которые индуцируют экспрессию и секрецию IL-22 в клетках ILC3. Это поддерживает защиту кишечника и гомеостаз за счет продукции муцина и антимикробных пептидов эпителиальными клетками. Нейрорегуляторный рецептор RET, экспрессируемый в кишечных клетках ILC3, контролирует активацию IL-22 и ERK-3, которые являются нижестоящими факторами передачи сигналов p38MAPK / Akt (Ibiza et al., 2016). Клетка ILC2 экспрессирует несколько рецепторов нейропептидов, включая NMUR1. Экспрессия NMUR1 увеличивалась при инфекции. Нейропептид NMU играет важную роль в производстве IL-25 и IL-33 и активации ILC2-опосредованного иммунитета, например, в ответ на инфекции легких и кишечных гельминтов (Cardoso et al., 2017; Wallrapp et al., 2017) . В совокупности ВНС потенциально может регулировать иммунную функцию клеток кишечника.
Парасимпатическая нервная система и болезни кишечника
Холинергический противовоспалительный путь был впервые идентифицирован Borovikova et al.(2000) Стимуляция блуждающего нерва защищает от летального септического шока, вызванного LPS. Афферентная активность блуждающего нерва опосредует индуцированный цитокинами пиретический ответ (Fleshner et al., 1998). Воздействие CAIP на иммунную функцию кишечника может включать: косвенное регулирование воспаления кишечника через изменение системного воспаления через селезеночный нерв (Huston et al., 2006; Rosas-Ballina et al., 2008; Рисунок 2) или прямое регулирование воспаления кишечника через парасимпатические нервы. нерв (Matteoli et al., 2014).Ниже мы обсудим противовоспалительные эффекты ПНС при различных заболеваниях.
Воспалительное заболевание кишечника (ВЗК)
Воспалительные заболевания кишечника (ВЗК), включая болезнь Крона и язвенный колит, представляют собой сложные заболевания на клиническом, иммунологическом, генетическом, молекулярном и микробном уровнях. Парасимпатическая иннервация участвует в патофизиологическом процессе ВЗК у животных моделей и пациентов. Клиническое исследование обнаружило дисфункцию блуждающего нерва у 45% обследованных пациентов с язвенным колитом (ЯК) (Lindgren et al., 1993). Ghia et al. (2006) показали, что поддиафрагмальная ваготомия усугубила острый экспериментальный колит у мышей, получавших DSS в виде 5- или 3-дневной интраректальной инъекции DNBS. Поддиафрагмальная ваготомия увеличивала вероятность и тяжесть острых эпизодов хронического экспериментального колита (Ghia et al., 2007). О’Махони и др. (2009) показали, что поддиафрагмальная ваготомия усугубила острый экспериментальный колит через 5 дней после введения DSS. Тяжесть колита, вызванного острым DSS у мышей α7-nAChR — / — , увеличивалась на модели мыши с депрессией и уменьшалась после лечения холина хлоридом (α7-nAChR-специфический агонист) (Ghia et al., 2009). Однако данные показали, что ваготомия не оказывает значительного влияния на течение колита у мышей, получавших DSS в течение 7 дней (Willemze et al., 2018). Эти различия можно объяснить несоответствием продолжительности лечения, методов экспериментального индуцированного колита и ваготомии. Противоположностью ваготомии является VNS, который, как было показано, активирует CAIP и облегчает воспалительное заболевание кишечника. Хронический VNS активирует холиновый противовоспалительный путь, а сигнальный путь MAPK / NF-κB ослабляет экспериментальный колит (Sun et al., 2013). Клиническое исследование показало, что длительное применение ВНС улучшило тонус блуждающего нерва у 5 из 7 пациентов с болезнью Крона (Bonaz et al., 2016). В дополнение к VNS никотиновая терапия всего тела может подавлять острый DSS-индуцированный колит путем подавления провоспалительных цитокинов IL-6 и TNF-α (Ghia et al., 2006; Hayashi et al., 2014). Ингибиторы ацетилхолинэстеразы, такие как неостигмин, физостигмин, галантамин, могут ослаблять повреждение кишечника на модели вызванного DNBS колита у крыс (Miceli and Jacobson, 2003; Ji et al., 2014). Богатое липидами энтеральное питание посредством активации регулируемой блуждающим нервом активации MC слизистой оболочки для облегчения LPS-индуцированного острого энтерита у мышей (de Haan et al., 2013). Недавнее исследование показало, что ультразвуковая терапия может облегчить вызванный DSS колит за счет CAIP, опосредованного α7-nAChR (Nunes et al., 2019). Эти данные предполагают, что дисфункция блуждающего нерва играет важную роль в патогенезе ВЗК. Подавление вагусной активности ингибиторами, денервация и редактирование генов могут усугубить ВЗК. И наоборот, CAIP может активироваться физической стимуляцией и активаторами рецепторов, облегчая колит, в котором рецепторы α7-nAChR могут играть важную роль.
Синдром кишечника Ирри (СРК)
Синдром кишечника Ирри (СРК) — одно из наиболее распространенных расстройств взаимодействия кишечника и мозга. ВНС может быть эффективной мишенью для лечения СРК. Нарушение вегетативного нерва — объективный физиологический фактор СРК (Cheng et al., 2013). Результаты клинических исследований продемонстрировали нарушение парасимпатической активности и повышение симпатического тонуса у пациентов (Pellissier et al., 2010; Chalaye et al., 2012; Mazur et al., 2012; Tanaka et al., 2018). Регулирование настроения может изменять вегетативную дисфункцию у пациентов с ВЗК, тогда как вегетативная дисфункция сохраняется независимо от регуляции настроения у пациентов с СРК (Pellissier et al., 2010). Антидепрессанты могут улучшить желудочно-кишечный и психологический статус пациентов с СРК и улучшить стрессовую реакцию ВНС (Wan and Chen, 2010). VNS считается потенциальным терапевтическим подходом при СРК. Чрескожная электрическая стимуляция блуждающего нерва с глубоким медленным дыханием в сочетании с электрической и физиологической модуляцией тонуса блуждающего нерва, усилением гастродуоденальной моторики и снижением соматической болевой чувствительности (Frokjaer et al., 2016).
Послеоперационная подвздошная кишка (POI)
Послеоперационная кишечная непроходимость, характеризующаяся дисфункцией желудочно-кишечного тракта, сопровождающейся тошнотой, нарушением орального кормления, рвотой, вздутием живота и задержкой отхождения стула или газов, является частым осложнением абдоминальной хирургии (Vather et al., 2014). Патогенез ПНЯ в основном включает воспалительные реакции в стенке кишечника и вегетативные нервные расстройства, представленные повышенной симпатической активностью и нарушением парасимпатической активности (Bauer and Boeckxstaens, 2004).На модели ПНЯ на мышах нейроанатомические данные демонстрируют наличие вагусного противовоспалительного рефлекса в стенке кишечника. Абдоминальная хирургия привела к незначительному воспалению кишечника, при котором сенсорные и моторные нейроны блуждающего нерва активируются во время ПНЯ. Блуждающий нерв в основном выводится в область воспаления, и 42% мотонейронов, иннервирующих кишечник, экспрессируют c-fos, в отличие от 7% селезеночного нерва (Cailotto et al., 2012). Никотин оказывает противовоспалительное действие на перитонеальные макрофаги, активируя α7-nAChR.VNS улучшает воспаление и послеоперационную непроходимость кишечника в модели POI, активируя пути STAT3 в кишечных макрофагах, оба из которых являются противовоспалительными благодаря сигнальному пути Jak2-Stat3, опосредованному α7-nAChR (de Jonge et al., 2005). VNS потерпел неудачу в модели POI у мышей альфа-7nAChR — / — (Matteoli et al., 2014), что подчеркивает противовоспалительное действие блуждающего нерва, опосредованное α7-nAChR. Стимуляция никотин-холинергических рецепторов в модели POI снижает воспалительную реакцию кишечника и противодействует задержке опорожнения желудка (The et al., 2007). Введение богатого липидами энтерального питания снимает ПНЯ, активируя блуждающий нерв, подавляя секрецию провоспалительных цитокинов (Lubbers et al., 2009). Агонисты 5-HT4R опосредуют высвобождение ACh из кишечных нейронов, что снижает воспалительную активность макрофагов у крыс с ПНЯ (Tsuchida et al., 2011), предполагая, что не только блуждающий нерв оказывает противовоспалительное действие, но и ENS опосредует CAIP. Активация блуждающего нерва снимает воспаление и симптомы послеоперационной кишечной непроходимости.Следовательно, регулирование ВНС может быть новой клинической стратегией предотвращения послеоперационной кишечной непроходимости.
Болезни системы симпатических нервов и кишечника
Симпатическая нервная система, по-видимому, играет более важную роль в воспалительной реакции кишечника по сравнению с ПНС. CAIP требует вовлечения симпатических нервов (Rosas-Ballina et al., 2008). Истощение норадреналина резерпином у крыс предотвращало противовоспалительное действие стимуляции блуждающего нерва (Rosas-Ballina et al., 2008). Пациенты с ЯК демонстрировали гипертонический симпатический нерв при ВЗК (Maule et al., 2007), в то время как потеря симпатических волокон была обнаружена у пациентов с CD (Straub et al., 2008). Изменения в SNS могут быть связаны с возникновением и исходом IBD. Симпатэктомия (6-OHDA) облегчила острый колит DSS и обострение хронического колита DSS у мышей дикого типа и хронический колит у мышей Il-10 — / — (Straub et al., 2008). Виллемзе и др. (2018) сообщили, что симпатэктомия, а не блуждающий нерв, оказывает значительное повреждающее действие на острый вызванный DSS колит у мышей, в то время как электрическая стимуляция верхнего брыжеечного нерва улучшает колит.Различия в концентрациях нейромедиаторов из-за различных подходов к симпатэктомии и вариабельная экспрессия подтипов адренергических рецепторов в воспалительном процессе кишечника объясняют противоречивые результаты. Исследование показало, что рецепторы адреналина β2 и β3 могут действовать как противовоспалительные агенты при высоких уровнях норадреналина (Borger et al., 1998; Vasina et al., 2008; Nijhuis et al., 2014), тогда как рецепторы α2 имели относительно высокое сродство к норэпинефрину (Bai et al., 2009).Катехоламины оказывают значительное влияние на состав микробной популяции в просвете и ее взаимодействие с эпителиальными клетками, что может повлиять на исход кишечного иммунитета (Lyte et al., 2011).
Симпатические нервы могут быть вовлечены в вызванный химиотерапией мукозит кишечника. Было документально подтверждено, что химиотерапевтические препараты повреждают симпатический нерв (Lucas et al., 2013). 5-ФУ-индуцированное повреждение симпатического нерва кишечника было дозозависимым и приводило к снижению ISC.6-OHDA снижает количество ISC в крипте тощей кишки мыши вместе с уменьшением количества клеток Панета. Изопротеренол (ISO), активирующий бета-2-адренергический рецептор на ISC, уменьшил повреждение кишечника после химиотерапии, что опосредовано уменьшением клеточного апоптоза и защитой симпатического нерва кишечника (Zeng et al., 2020). Таким образом, активация симпатических путей или нейропротекторные препараты могут быть новой терапевтической стратегией для предотвращения побочных эффектов химиотерапии.
Заключение и будущее применение регуляции вегетативных нервов в кишечнике
Регулирование кишечного гомеостаза с помощью ВНС может быть ценным инструментом в клинике и открыть новую стратегию лечения различных рефрактерных или хронических кишечных заболеваний. Чтобы исследовать влияние ВНС на кишечник, нам необходимо понять два основных эффекта ВНС: (1) регуляция пролиферации IEC и (2) иммунная система в кишечнике.
Автономная нервная система регулирует пролиферацию IEC и играет эффективную роль в регенерации слизистой оболочки кишечника после травм, хирургических вмешательств и инфекций.Передача сигналов ANS индуцирует пролиферацию и дифференцировку стволовых клеток, которые поддерживают различные типы эпителиальных клеток и влияют на спектр кишечного поглощения. Считается, что некоторые виды рака желудочно-кишечного тракта, такие как рак толстой кишки, происходят из стволовых клеток, которые сохраняют свойства, аналогичные ISC в условиях опухоли (Barker et al., 2009; Merlos-Suarez et al., 2011; Schepers et al. , 2012; Cortina et al., 2017; Shimokawa et al., 2017). Некоторые раковые клетки кишечника экспрессируют вегетативные рецепторы и нейротрансмиттеры или активаторы рецепторов, которые могут влиять на пролиферацию опухолевых клеток (Park and Cho, 2008; Huang et al., 2012; Коэльо и др., 2015; Wang et al., 2016). Регуляция ВНС может быть использована в качестве новой мишени для разработки эффективной противораковой стратегии. ВНС можно защитить и активировать в кишечнике с помощью лекарств, предотвращающих краткосрочные и долгосрочные осложнения после химиотерапии. Поскольку повреждение кишечного нерва после химиотерапии может быть вовлечено в формирование воспаления кишечника, было показано, что изопротеренол улучшает повреждение кишечника после химиотерапии (Zeng et al., 2020). Следовательно, передача сигналов ВНС может эффективно уменьшить повреждение кишечника после химиотерапии.Это повысит качество жизни и выживаемость больных раком. В заключение следует отметить, что понимание роли и механизма ВНС в регуляции ИЭК может помочь улучшить текущие терапевтические стратегии и добиться прорывов в клинической практике.
Автономная нервная система как мост между ЦНС и кишечником может быть лучшей терапевтической мишенью по сравнению с неуправляемой ЦНС или сложной кишечной средой. Вегетативные расстройства, такие как ВЗК, СРК и ПНЯ, характеризующиеся нарушением парасимпатической активности и повышенным симпатическим тонусом у пациентов.Иммунный / воспалительный ответ ВНС на кишечник использовался в клинических испытаниях. Исследователи определили роль CAIP в POI и CD (Bonaz et al., 2016; Stakenborg et al., 2017). Stakenborg et al. (2017) представляют стимуляцию брюшного блуждающего нерва как метод лечения послеоперационной кишечной непроходимости. VNS брюшной полости снижает LPS-индуцированное повышение уровня IL-6 и IL-8 в цельной крови, собранной на 1-й день после колэктомии, без значительных побочных эффектов у пациентов с колэктомией. VNS безопасен и эффективен для пациентов с послеоперационной кишечной непроходимостью и обладает определенным противовоспалительным действием.VNS нормализует тонус блуждающего нерва независимо от начального состояния активации, что является преимуществом у пациентов с низким тонусом блуждающего нерва.
Несмотря на то, что количество исследований регуляции ВНС для кишечника растет, существуют противоречия в отношении всего нервного контура регуляции ВНС. Как мы координируем многие роли ВНС в кишечнике? Работает ли CAIP через нерв селезенки или через блуждающий нерв, проходящий в стенку кишечника? Где в CAIP расположены социальные сети? Необходим дополнительный механизм симпатической и парасимпатической регуляции воспаления, который позволит получить эффективные методы регуляции, позволяющие ANS-опосредованную регуляцию гомеостаза кишечника.
Авторские взносы
HoD и LS разработали исследование. Все авторы составили рукопись, прочитали и одобрили рукопись.
Финансирование
Исследование было частично поддержано Национальным фондом естественных наук Китая (гранты № 81960104 и 81860026), ключевым планом НИОКР Департамента науки и технологий провинции Цзянси (гранты № 20192BBG70043 и 20202ACB206009), Междисциплинарным инновационным фондом естественных наук, Наньчанский университет (гранты №9166-27060003-YB13 и 202010403062). Проект традиционной китайской медицины в провинции Цзянси (грант № 2019A176). Национальная программа бакалавриата по инновациям и предпринимательству (грант № 202010403062).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Qingxian Zhu (Университет Наньчана, Китай), который дал полезные советы по разделу вегетативной нервной системы и кишечных заболеваний.
Список литературы
Альпертс, К., Букинкс, Р., Адриансен, Д., ван Нассау, Л., и Тиммерманс, Дж. П. (2015). Идентификация и предполагаемая роль различных подтипов дендритных клеток кишечника в нейроиммунной коммуникации: чему можно научиться у других систем органов? Анат. Рек. 298, 903–916. DOI: 10.1002 / ar.23106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анини Ю., Брубейкер П. (2003). Мускариновые рецепторы контролируют секрецию глюкагоноподобного пептида 1 эндокринными L-клетками человека. Эндокринология 144, 3244–3250. DOI: 10.1210 / en.2003-0143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Апонте, Ю., Атасой, Д., Стернсон, С. (2011). Нейронов AGRP достаточно, чтобы управлять пищевым поведением быстро и без обучения. Nat. Neurosci. 14, 351–355. DOI: 10.1038 / nn.2739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бай А., Лу Н., Го Ю., Чен Дж. И Лю З. (2009). Модуляция воспалительного ответа с помощью блокады альфа2-адренорецепторов при остром колите у мышей. Clin. Exp. Иммунол. 156, 353–362. DOI: 10.1111 / j.1365-2249.2009.03894.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер Н., Риджуэй Р. А., ван Эс Дж. Х., ван де Ветеринг М., Бегтель Х., ван ден Борн М. и др. (2009). Стволовые клетки крипт как клетки происхождения рака кишечника. Природа 457, 608–611.
Google Scholar
Баркер, Н., ван Эс, Дж. Х., Койперс, Дж., Куяла, П., ван ден Борн, М., Козейнсен, М., и другие. (2007). Идентификация стволовых клеток тонкой и толстой кишки по маркерному гену Lgr5. Природа 449, 1003–1007. DOI: 10.1038 / nature06196
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беллинджер Д., Лортон Д., Фелтен С. и Фелтен Д. (1992). Иннервация лимфоидных органов и ее влияние на развитие, старение и аутоиммунитет. Внутр. J. Immunopharmacol. 14, 329–344. DOI: 10.1016 / 0192-0561 (92)
-e
CrossRef Полный текст | Google Scholar
Бирчено, Г., Нистрем, Э., Йоханссон, М., и Ханссон, Г. (2016). Сторожевые бокаловидные клетки охраняют крипту толстой кишки, запуская Nlrp6-зависимую секрецию Muc2. Наука 352, 1535–1542. DOI: 10.1126 / science.aaf7419
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бохоркес, Д. В., Шахид, Р. А., Эрдманн, А., Крегер, А. М., Ван, Ю., Калакос, Н., и др. (2015). Нейроэпителиальный контур образован иннервацией сенсорных энтероэндокринных клеток. J. Clin. Инвестировать. 125, 782–786. DOI: 10.1172 / jci78361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bonaz, B., Sinniger, V., Hoffmann, D., Clarencon, D., Mathieu, N., Dantzer, C., et al. (2016). Хроническая стимуляция блуждающего нерва при болезни Крона: пилотное исследование через 6 месяцев. Нейрогастроэнтерол. Мотил. 28, 948–953. DOI: 10.1111 / nmo.12792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боргер, П., Хекстра, Ю., Эсселинк, М.Т., Постма, Д. С., Заагсма, Дж., Велленга, Э. и др. (1998). Опосредованное бета-адренорецептором ингибирование накопления мРНК IFN-гамма, IL-3 и GM-CSF в активированных Т-лимфоцитах человека опосредуется исключительно подтипом бета2-адренорецепторов. Am. J. Respir. Cell Mol. Биол. 19, 400–407. DOI: 10.1165 / ajrcmb.19.3.2765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боровикова, Л.В., Иванова, С., Чжан, М., Янг, Х., Бочкина, Г.И., Уоткинс, Л.Р. и др.(2000). Стимуляция блуждающего нерва ослабляет системную воспалительную реакцию на эндотоксин. Природа 405, 458–462. DOI: 10.1038 / 35013070
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браунинг, К. Н., Травагли, Р. А. (2014). Центральная нервная система контролирует моторику желудочно-кишечного тракта, секрецию и модуляцию желудочно-кишечных функций. Компр. Physiol. 4, 1339–1368. DOI: 10.1002 / cphy.c130055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кайлотто, К., Costes, L., van der Vliet, J., van Bree, S.H., van Heerikhuize, J.J., Buijs, R., et al. (2012). Нейроанатомические данные, подтверждающие наличие противовоспалительного рефлекса блуждающего нерва в кишечнике. Нейрогастроэнтерол. Мотил. 24, 191–200. DOI: 10.1111 / j.1365-2982.2011.01824.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кайлотто К., Гомес-Пинилья П. Дж., Костес Л. М., ван дер Влит Дж., Ди Джовангиулио М., Неметхова А. и др. (2014).Нейроанатомические данные, указывающие на косвенную модуляцию макрофагов блуждающими эфферентами в кишечнике, но не в селезенке. PLoS One 9: e87785. DOI: 10.1371 / journal.pone.0087785
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каллаган, Б. Д. (1991). Влияние пинеалэктомии и автономной денервации на пролиферацию клеток крипт в тонком кишечнике крыс. J. Pineal Res. 10, 180–185. DOI: 10.1111 / j.1600-079x.1991.tb00813.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэмерон, Х.Л. и Пердью М. Х. (2007). Активация мускаринового рецептора ацетилхолина увеличивает трансцеллюлярный транспорт макромолекул через эпителий кишечника мышей и человека in vitro. Нейрогастроэнтерол. Мотил. 19, 47–56. DOI: 10.1111 / j.1365-2982.2006.00845.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кардосо В., Чесне Дж., Рибейро Х., Гарсия-Кассани Б., Карвалью Т., Бушери Т. и др. (2017). Нейрональная регуляция врожденных лимфоидных клеток 2-го типа через нейромедин U. Природа 549, 277–281. DOI: 10.1038 / nature23469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chalaye, P., Goffaux, P., Bourgault, P., Lafrenaye, S., Devroede, G., Watier, A., et al. (2012). Сравнение модуляции боли и вегетативных реакций у пациентов с фибромиалгией и синдромом раздраженного кишечника. Clin. Дж. Пейн 28, 519–526. DOI: 10.1097 / ajp.0b013e31823ae69e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ченг, П., Ши В., Альберто М., Прессон А. П., Ликудин А., Майер Е. А. и др. (2013). Вегетативная реакция на висцеральный стрессор не регулируется при синдроме раздраженного кишечника и коррелирует с продолжительностью заболевания. Нейрогастроэнтерол. Мотил. 25, e650 – e659.
Google Scholar
Коэльо М., Моз М., Коррейя Г., Тейшейра А., Медейрос Р. и Рибейро Л. (2015). Антипролиферативные эффекты бета-адреноблокаторов на клетки колоректального рака человека. Онкол. Rep. 33, 2513–2520.DOI: 10.3892 / или 2015.3874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cortina, C., Turon, G., Stork, D., Hernando-Momblona, X., Sevillano, M., Aguilera, M., et al. (2017). Подход редактирования генома для изучения раковых стволовых клеток в опухолях человека. EMBO Mol. Med. 9, 869–879. DOI: 10.15252 / emmm.201707550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коста М., Брукс С. Дж. И Хенниг Г. В. (2000). Анатомия и физиология кишечной нервной системы. Кишечник 47 (Приложение 4), v15 – v26.
Google Scholar
Costantini, T. W., Bansal, V., Krzyzaniak, M., Putnam, J. G., Peterson, C. Y., Loomis, W. H., et al. (2010). Стимуляция блуждающего нерва защищает от ожогового повреждения кишечника за счет активации клеток кишечной глии. Am. J. Physiol. Гастроинтест. Liver Physiol. 299, G1308 – G1318.
Google Scholar
Costantini, T. W., Krzyzaniak, M., Cheadle, G.A., Putnam, J. G., Hageny, A.М., Лопес Н. и др. (2012). Нацеленность на никотиновый ацетилхолиновый рецептор альфа-7 в кишечной нервной системе: холинергический агонист предотвращает нарушение кишечного барьера после тяжелой ожоговой травмы. Am. J. Pathol. 181, 478–486.
Google Scholar
Дэвис, Э. А., Вашингтон, М. К., Яниз, Э. Р., Филлипс, Х., Сайег, А. И. и Дейли, М. Дж. (2017). Долгосрочное влияние парасимпатической или симпатической денервации на пролиферацию эпителиальных клеток кишечника и апоптоз. Exp. Биол. Med. 242, 1499–1507. DOI: 10.1177 / 1535370217724790
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, Э. А., Чжоу, В., и Дейли, М. Дж. (2018). Доказательства прямого влияния вегетативной нервной системы на пролиферацию кишечных эпителиальных стволовых клеток. Physiol. Реп. 6: e13745.
Google Scholar
de Haan, J. J., Hadfoune, M., Lubbers, T., Hodin, C., Lenaerts, K., Ito, A., et al. (2013). Богатое липидами энтеральное питание регулирует активацию тучных клеток слизистой оболочки посредством вагусного противовоспалительного рефлекса. Am. J. Physiol. Гастроинтест. Liver Physiol. 305, G383 – G391.
Google Scholar
de Jonge, W.J., van der Zanden, E.P., The, F.O., Bijlsma, M.F., van Westerloo, D.J., Bennink, R.J., et al. (2005). Стимуляция блуждающего нерва ослабляет активацию макрофагов за счет активации сигнального пути Jak2-STAT3. Nat. Иммунол. 6, 844–851. DOI: 10.1038 / ni1229
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дельгадо, М., Муньос-Элиас, Э. Дж., Гомариз, Р. П., и Ганеа, Д. (1999). Вазоактивный кишечный пептид и полипептид, активирующий аденилатциклазу гипофиза, предотвращают индуцибельную транскрипцию синтазы оксида азота в макрофагах, ингибируя активацию NF-каппа B и регуляторного фактора 1 IFN. J. Immunol. 162, 4685–4696.
Google Scholar
Di Giovangiulio, M., Bosmans, G., Meroni, E., Stakenborg, N., Florens, M., Farro, G., et al. (2016). Ваготомия влияет на развитие оральной толерантности и увеличивает предрасположенность к развитию колита независимо от никотинового рецептора альфа-7. Мол. Med. 22, 464–476. DOI: 10.2119 / molmed.2016.00062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Еленков И. Дж., Уайлдер Р. Л., Хрусос Г. П. и Визи Э. С. (2000). Симпатический нерв — интегративный интерфейс между двумя суперсистемами: мозгом и иммунной системой. Pharmacol. Ред. 52, 595–638.
Google Scholar
Эрлинге, Д., Бранкуолл, Дж., И Эдвинссон, Л. (1994). Нейропептид Y стимулирует пролиферацию гладкомышечных клеток сосудов человека: взаимодействие с норадреналином и Atp. Регул. Pept. 50, 259–265. DOI: 10.1016 / 0167-0115 (94)
-x
CrossRef Полный текст | Google Scholar
Эрлинге, Д., Ю, Х., Эдвинссон, Л., Рейс, Д. Дж., И Уолестедт, К. (1993). Митогенные эффекты Атр на гладкомышечные клетки сосудов VS. другие факторы роста и симпатические котрансмиттеры. Am. J. Physiol. 265, h2089 – h2097.
Google Scholar
Фелтен, Д., Фелтен, С., Карлсон, С., Ольшука, Дж., И Ливнат, С. (1985). Норадренергическая и пептидергическая иннервация лимфоидной ткани. J. Immunol. 135, 755s – 765s.
Google Scholar
Флешнер М., Гёлер Л. Е., Шварц Б. А., Макгорри М., Мартин Д., Майер С. Ф. и др. (1998). Термогенный и кортикостероновый ответы на внутривенные цитокины (IL-1beta и TNF-alpha) ослабляются поддиафрагмальной ваготомией. J. Neuroimmunol. 86, 134–141. DOI: 10,1016 / s0165-5728 (98) 00026-5
CrossRef Полный текст | Google Scholar
Фрокьяер, Дж. Б., Бергманн, С., Брок, К., Madzak, A., Farmer, A.D., Ellrich, J., et al. (2016). Модуляция тонуса блуждающего нерва усиливает перистальтику желудочно-кишечного тракта и снижает соматическую болевую чувствительность. Нейрогастроэнтерол. Мотил. 28, 592–598. DOI: 10.1111 / nmo.12760
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Габани И., Мюллер П. А., Фейгери Л., Оливейра Т. Ю., Коста-Пинто Ф. А. и Муцида Д. (2016). Нейроиммунные взаимодействия управляют программированием тканей в макрофагах кишечника. Мобильный 164, 378–391.DOI: 10.1016 / j.cell.2015.12.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаро, М. Г., Джури, Дж., И Пердью, М. Х. (2007). Неонатальное отделение крысят от матери приводит к аномальной холинергической регуляции проницаемости эпителия. Am. J. Physiol. Гастроинтест. Liver Physiol. 293, G198 – G203.
Google Scholar
Гиа, Дж. Э., Бленнерхассет, П., Дэн, Ю., Верду, Э. Ф., Хан, В. И., и Коллинз, С. М. (2009). Реактивация воспалительного заболевания кишечника на мышиной модели депрессии. Гастроэнтерология 136, 2280–2288. DOI: 10.1053 / j.gastro.2009.02.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиа Дж. Э., Бленнерхассет П., Эль-Шаркави Р. Т. и Коллинз С. М. (2007). Защитный эффект блуждающего нерва на мышиной модели хронического рецидивирующего колита. Am. J. Physiol. Гастроинтест. Liver Physiol. 293, G711 – G718.
Google Scholar
Ghia, J. E., Blennerhassett, P., Kumar-Ondiveeran, H., Верду, Э. Ф., и Коллинз, С. М. (2006). Блуждающий нерв: тонизирующее ингибирующее влияние, связанное с воспалительным заболеванием кишечника на мышиной модели. Гастроэнтерология 131, 1122–1130. DOI: 10.1053 / j.gastro.2006.08.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Голдштейн, Н., Макнайт, А. Д., Карти, Дж. Р. Э., Арнольд, М., Бетли, Дж. Н., и Альхадефф, А. Л. (2021). Гипоталамическое обнаружение макроэлементов через несколько путей от кишечника к мозгу. Cell Metab. 33, 676–687. DOI: 10.1016 / j.cmet.2020.12.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грейсиус, Г., Кабири, З., Зигмундссон, К., Лян, К., Бунте, Р., Синг, М. К. и др. (2018). α-перикриптальные стромальные клетки являются критическим источником Wnts и RSPO3 для кишечных стволовых клеток мышей in vivo. Proc. Natl. Акад. Sci. США 115, E3173 – E3181.
Google Scholar
Грейг, К. Дж., И Коулз, Р. А. (2017). Мускариновые рецепторы ацетилхолина участвуют в гомеостазе слизистой оболочки тонкого кишечника. J. Pediatr. Surg. 52, 1031–1034. DOI: 10.1016 / j.jpedsurg.2017.03.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Guereschi, M. G., Araujo, L. P., Maricato, J. T., Takenaka, M. C., Nascimento, V. M., Vivanco, B.C., et al. (2013). Передача сигналов бета2-адренорецептора в CD4 + Foxp3 + регуляторных Т-клетках усиливает их подавляющую функцию PKA-зависимым образом. Eur. J. Immunol. 43, 1001–1012. DOI: 10.1002 / eji.201243005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гульбрансен, Б.Д., Бейнс, Дж. С., Шарки, К. А. (2010). Кишечная глия является мишенью симпатической иннервации кишечного сплетения в дистальном отделе толстой кишки морской свинки. J. Neurosci. 30, 6801–6809. DOI: 10.1523 / jneurosci.0603-10.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Густафссон, Дж., Эрмунд, А., Йоханссон, М., Шютте, А., Ханссон, Г., и Шеваль, Х. (2012). Метод ex vivo для изучения образования, свойств и толщины слизи в биоптатах толстой кишки человека и эксплантатах тонкого и толстого кишечника мышей. Am. J. Physiol. Гастроинтест. Liver Physiol. 302, G430 – G438.
Google Scholar
Хаяси, С., Хамада, Т., Заиди, С. Ф., Оширо, М., Ли, Дж., Ямамото, Т. и др. (2014). Никотин подавляет острый колит и онкогенез толстой кишки, связанный с хроническим колитом у мышей. Am. J. Physiol. Гастроинтест. Liver Physiol. 307, G968 – G978.
Google Scholar
Хуанг, X. Y., Ван, Х. К., Юань, З., Хуанг, Дж., И Чжэн, Q. (2012). Норэпинефрин стимулирует пролиферацию, миграцию и инвазию раковых клеток поджелудочной железы посредством зависимой от бета-адренорецепторов активации пути P38 / MAPK. Гепатогастроэнтерология 59, 889–893.
Google Scholar
Хьюстон, Дж. М., Очани, М., Росас-Баллина, М., Ляо, Х., Очани, К., Павлов, В. А. и др. (2006). Спленэктомия инактивирует холинергический противовоспалительный путь при летальной эндотоксемии и полимикробном сепсисе. J. Exp. Med. 203, 1623–1628. DOI: 10.1084 / jem.20052362
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ибица, С., Гарсия-Кассани, Б., Рибейро, Х., Карвалью Т., Алмейда Л., Маркес Р. и др. (2016). Нейрорегуляторы, происходящие из глиальных клеток, контролируют врожденные лимфоидные клетки 3-го типа и защиту кишечника. Природа 535, 440–443. DOI: 10.1038 / природа18644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивасаки, М., Акиба, Ю., и Кауниц, Дж. Д. (2019). Последние достижения в физиологии и патофизиологии вазоактивных кишечных пептидов: основное внимание уделяется желудочно-кишечной системе. F1000Research 8: F1000 Faculty Rev-1629.
Google Scholar
Джи, Х., Раввин, М. Ф., Лабис, Б., Павлов, В. А., Трейси, К. Дж., И Гиа, Дж. Э. (2014). Центральная холинергическая активация цепи блуждающего нерва к селезенке облегчает экспериментальный колит. Mucosal Immunol. 7, 335–347. DOI: 10.1038 / mi.2013.52
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кагеяма-Яхара, Н., Суэхиро, Ю., Ямамото, Т., и Кадоваки, М. (2008). IgE-индуцированная дегрануляция тучных клеток слизистой оболочки отрицательно регулируется никотиновыми рецепторами ацетилхолина. Biochem. Биофиз. Res. Commun. 377, 321–325. DOI: 10.1016 / j.bbrc.2008.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кеннеди, М. Ф., Туттон, П. Дж., И Баркла, Д. Х. (1983). Адренергические факторы, участвующие в контроле пролиферации клеток крипт в тощей и нисходящей ободочной кишке мыши. Clin. Exp. Pharmacol. Physiol. 10, 577–586. DOI: 10.1111 / j.1440-1681.1983.tb00226.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Р.I., Yazawa, T., Anisuzzaman, A. S., Semba, S., Ma, Y., Uwada, J., et al. (2014). Активация киназы очаговой адгезии через мускариновый ацетилхолиновый рецептор M1 необходима для восстановления барьерной функции кишечника после повреждения эпителия. Biochim. Биофиз. Acta 1842, 635–645. DOI: 10.1016 / j.bbadis.2013.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хедр, М., Абдельмотельб, А. М., Бедвелл, Т. А., Штая, А., Алзуби, М. Н., Абу, Х. М. и др.(2018). Вазоактивный кишечный пептид вызывает пролиферацию гепатоцитов человека. Cell Prolif. 51: e12482. DOI: 10.1111 / cpr.12482
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лачат, Дж. Дж., И Гонсалвес, Р. П. (1978). Влияние вегетативной денервации на кинетику эпителия подвздошной кишки крысы. Cell Tissue Res. 192, 285–297.
Google Scholar
Лавин, Ю., Винтер, Д., Блехер-Гонен, Р., Дэвид, Э., Керен-Шауль, Х., Мерад, М. и др. (2014). Резидентные в тканях ландшафты энхансеров макрофагов формируются местной микросредой. Ячейка 159, 1312–1326. DOI: 10.1016 / j.cell.2014.11.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линь Р., Дин З., Ма, Х., Ши, Х., Гао, Й., Цянь, В. и др. (2015). Кондиционированные in vitro мезенхимальные стволовые клетки костного мозга способствуют функциональной регенерации кишечных нервов de novo, но не посредством прямой трансдифференцировки. Стволовые клетки 33, 3545–3557. DOI: 10.1002 / стержень.2197
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линдгрен, С., Стюениус, Дж., Шолунд, К., Лилья, Б., и Сундквист, Г. (1993). Дисфункция вегетативного блуждающего нерва у больных язвенным колитом. Сканд. J. Gastroenterol. 28, 638–642. DOI: 10.3109 / 0036552930
03
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Любберс, Т., Люйер, М. Д., де Хаан, Дж.Дж., Хадфун М., Буурман В. А. и Греве Дж. У. (2009). Богатое липидами энтеральное питание уменьшает послеоперационную непроходимость кишечника у крыс за счет активации рецепторов холецистокинина. Ann. Surg. 249, 481–487. DOI: 10.1097 / sla.0b013e318194d187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лукас Д., Шейерманн К., Чоу А., Кунисаки Ю., Брунс И., Баррик К. и др. (2013). Повреждение нервов костного мозга, вызванное химиотерапией, нарушает регенерацию кроветворения. Nat.Med. 19, 695–703. DOI: 10,1038 / нм 3155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лундгрен, О., Йодал, М., Янссон, М., Риберг, А. Т., и Свенссон, Л. (2011). Кишечные эпителиальные стволовые клетки / клетки-предшественники контролируются афферентными нервами слизистой оболочки. PLoS One 6: e16295. DOI: 10.1371 / journal.pone.0016295
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лайт, М., Вулчанова, Л., Браун, Д. Р. (2011). Стресс на поверхности кишечника: взаимодействие катехоламинов и бактерий слизистой оболочки. Cell Tissue Res. 343, 23–32. DOI: 10.1007 / s00441-010-1050-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейсахерн, С. Дж., Патель, Б. А., Маккей, Д. М., и Шарки, К. А. (2011). Регуляция оксидом азота переноса ионов эпителия толстой кишки: новая роль кишечной глии в мышечно-кишечном сплетении. J. Physiol. 589, 3333–3348. DOI: 10.1113 / jphysiol.2011.207902
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Магнотти, Л.Дж. И Дейч Э. А. (2005). Ожоги, бактериальная транслокация, барьерная функция кишечника и отказ. J. Burn Care Rehabil. 26, 383–391. DOI: 10.1097 / 01.bcr.0000176878.79267.e8
CrossRef Полный текст | Google Scholar
Маттеоли, Г., Гомес-Пинилья, П. Дж., Неметова, А., Ди Джовангиулио, М., Кайлотто, К., ван Бри, С. Х. и др. (2014). Отдельный вагусный противовоспалительный путь модулирует резидентные макрофаги мышечной ткани кишечника независимо от селезенки. Кишечник 63, 938–948.DOI: 10.1136 / gutjnl-2013-304676
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мауле, С., Пиеранджели, Г., Чеволи, С., Гримальди, Д., Джионкетти, П., Барбара, Г., и др. (2007). Симпатическая гиперактивность у больных язвенным колитом. Clin. Auton Res. 17, 217–220. DOI: 10.1007 / s10286-007-0425-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мазур М., Фургала А., Яблонски К., Мах Т. и Тор П. (2012).Активность вегетативной нервной системы у пациентов с синдромом раздраженного кишечника с преобладанием запоров. Med. Sci. Монит. 18, R493 – R499.
Google Scholar
Макконалог К. и Фернесс Дж. Б. (1994). Нейромедиаторы желудочно-кишечного тракта. Baillieres Clin. Эндокринол. Метаб. 8, 51–76. DOI: 10.1016 / s0950-351x (05) 80226-5
CrossRef Полный текст | Google Scholar
Макдол, Дж., Уиллер, Л., Макдональд, К., Ван, Б., Коньюфка, В., Кнуп, К., и другие. (2012). Бокаловидные клетки доставляют люминальный антиген к дендритным клеткам CD103 + в тонком кишечнике. Природа 483, 345–349. DOI: 10.1038 / nature10863
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мендес-Феррер, С., Баттиста, М., и Френетт, П.С. (2010). Сотрудничество бета (2) и бета (3) -адренергических рецепторов в мобилизации гематопоэтических клеток-предшественников. Ann. N.Y. Acad. Sci. 1192, 139–144.
Google Scholar
Мерлос-Суарес, А., Баррига, Ф. М., Юнг, П., Иглесиас, М., Сеспедес, М. В., Росселл, Д. и др. (2011). Сигнатура стволовых клеток кишечника позволяет идентифицировать стволовые клетки рака прямой кишки и прогнозировать рецидив заболевания. Cell Stem Cell 8, 511–524. DOI: 10.1016 / j.stem.2011.02.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мичели, П. К., и Якобсон, К. (2003). Холинергические пути модулируют экспериментальный колит динитробензолсульфоновой кислоты у крыс. Auton. Neurosci. 105, 16–24. DOI: 10.1016 / s1566-0702 (03) 00023-7
CrossRef Полный текст | Google Scholar
Моришита К., Коимбра Р., Лангнесс С., Элисейри Б. П. и Костантини Т. В. (2015). Нейроэнтериальная ось модулирует баланс регуляторных Т-клеток и Т-хелперов 17 в мезентериальном лимфатическом узле после травмы / геморрагического шока. Am. J. Physiol. Гастроинтест. Liver Physiol. 309, G202 – G208.
Google Scholar
Муссо, Ф., Лашат, Дж. Дж., Круз, А. Р., и Гонсалвес, Р. П. (1975). Влияние денервации на митотический индекс кишечного эпителия крысы. Cell Tissue Res. 163, 395–402.
Google Scholar
Nance, D., and Burns, J. (1989). Иннервация селезенки у крысы: свидетельство отсутствия афферентной иннервации. Brain Behav. Иммун. 3, 281–290. DOI: 10.1016 / 0889-1591 (89)
-7
CrossRef Полный текст | Google Scholar
Насер Ю., Хо В. и Шарки К.А. (2006). Распределение адренорецепторов в кишечной нервной системе морских свинок, мышей и крыс. J. Comp. Neurol. 495, 529–553. DOI: 10.1002 / cne.20898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nijhuis, L.E., Olivier, B.J., Dhawan, S., Hilbers, F.W., Boon, L., Wolkers, M.C., et al. (2014). Активация адренергического бета2-рецептора стимулирует противовоспалительные свойства дендритных клеток in vitro. PLoS One 9: e85086.DOI: 10.1371 / journal.pone.0085086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Норберг, К. А. (1964). Адренергическая иннервация кишечной стенки изучается с помощью флуоресцентной микроскопии. Внутр. J. Neuropharmacol. 3, 379–382. DOI: 10.1016 / 0028-3908 (64)-x
CrossRef Полный текст | Google Scholar
Нуньес, Н. С., Чандран, П., Сундби, М., Визиоли, Ф., Да, К. Г. Ф., Беркс, С. Р. и др. (2019). Терапевтический ультразвук ослабляет колит, вызванный DSS, через холинергический противовоспалительный путь. Эбиомедицина 45, 495–510. DOI: 10.1016 / j.ebiom.2019.06.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Обара К., Араи К., Миядзима Н., Хатано А., Томита Ю. и Такахаши К. (2000). Экспрессия мРНК m2 мускаринового ацетилхолинового рецептора в первичной культуре стромальных клеток простаты человека. Урол. Res. 28, 196–200. DOI: 10.1007 / s002400000113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Обен, Дж.А., Янг, С., Лин, Х., Оно, М., Дил, А. М. (2003). Норадреналин и нейропептид Y способствуют пролиферации и экспрессии гена коллагена звездчатых миофибробластных клеток печени. Biochem. Биофиз. Res. Commun. 302, 685–690. DOI: 10.1016 / s0006-291x (03) 00232-8
CrossRef Полный текст | Google Scholar
Очоа-Кортес, Ф., Турко, Ф., Линан-Рико, А., Согомонян, С., Уитакер, Э., Венер, С. и др. (2016). Кишечные глиальные клетки: новый рубеж в нейрогастроэнтерологии и клиническая мишень для воспалительных заболеваний кишечника. Inflamm. Кишечник. 22, 433–449. DOI: 10.1097 / mib.0000000000000667
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Окабе Ю., Меджитов Р. (2014). Тканеспецифические сигналы управляют обратимой программой локализации и функциональной поляризации макрофагов. Мобильный 157, 832–844. DOI: 10.1016 / j.cell.2014.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оливье, Б. Дж., Кайлотто, К., ван дер Влит, Дж., Книппенберг, М., Гройтер, М. Дж., Хильберс, Ф. В. и др. (2016). Иннервация блуждающего нерва требуется для образования третичной лимфоидной ткани при колите. Eur. J. Immunol. 46, 2467–2480. DOI: 10.1002 / eji.201646370
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олофссон П., Кац Д., Росас-Баллина М., Левин Ю., Очани М., Вальдес-Феррер С. и др. (2012). Экспрессия α7 никотинового ацетилхолинового рецептора (α7nAChR) в не Т-клетках костного мозга необходима для воспалительного рефлекса. Мол. Med. 18, 539–543. DOI: 10.2119 / molmed.2011.00405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Махони, К., ван дер Клейдж, Х., Биненсток, Дж., Шанахан, Ф., и О’махони, Л. (2009). Утрата вагусного противовоспалительного действия: визуализация in vivo и адаптивный перенос. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 297, R1118 – R1126.
Google Scholar
Paris, H., Voisin, T., Remaury, A., Rouyer-Fessard, C., Daviaud, D., Langin, D., et al. (1990). Альфа-2 адренорецептор в эпителиальных клетках тонкой кишки крысы: характеристика с [3H] RX821002 и распределение вдоль оси ворсинка-крипта. J. Pharmacol. Exp. Ther. 254, 888–893.
Google Scholar
Парк, Ю. С., Чо, Н. Дж. (2008). Усиленная пролиферация клеток рака толстой кишки человека SNU-407 мускариновыми рецепторами ацетилхолина. BMB Rep. 41, 803–807. DOI: 10.5483 / bmbrep.2008.41.11.803
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пеллиссье, С., Данцер, К., Канини, Ф., Матье, Н., и Боназ, Б. (2010). Психологическая адаптация и вегетативные нарушения при воспалительных заболеваниях кишечника и синдроме раздраженного кишечника. Психонейроэндокрино 35, 653–662. DOI: 10.1016 / j.psyneuen.2009.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перейра А., Макларен А., Белл В. Р., Кополов Д. и Дин Б. (2003). Возможные сайты-мишени клозапина на периферических кроветворных клетках и стромальных клетках костного мозга. Фармакогеном. J. 3, 227–234. DOI: 10.1038 / sj.tpj.6500179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филлипс, Р. Дж., И Паули, Т. Л. (2012). Макрофаги, связанные с внутренней и внешней вегетативной иннервацией желудочно-кишечного тракта крыс. Auton. Neurosci. 169, 12–27. DOI: 10.1016 / j.autneu.2012.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росас-Баллина, М., Очани, М., Пэрриш В., Очани К., Харрис Ю., Хьюстон Дж. И др. (2008). Селезеночный нерв необходим для контроля холинергического противовоспалительного пути Tnf при эндотоксемии. Proc. Natl. Акад. Sci. США 105, 11008–11013. DOI: 10.1073 / pnas.0803237105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росас-Баллина, М., Олофссон, П., Очани, М., Вальдес-Феррер, С., Левин, Ю., Рирдон, К., и др. (2011). Т-клетки, синтезирующие ацетилхолин, передают нервные сигналы в цепи блуждающего нерва. Наука 334, 98–101. DOI: 10.1126 / science.1209985
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Salamone, G., Lombardi, G., Gori, S., Nahmod, K., Jancic, C., Amaral, M., et al. (2011). Холинергическая модуляция функции дендритных клеток. J. Neuroimmunol. 236, 47–56. DOI: 10.1016 / j.jneuroim.2011.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сандерс, В. М., Бейкер, Р. А., Рамер-Куинн, Д. С., Каспрович, Д.Дж., Фукс Б. А. и Стрит Н. Е. (1997). Дифференциальная экспрессия бета2-адренорецептора клонами Th2 и Th3: влияние на продукцию цитокинов и помощь В-клеткам. J. Immunol. 158, 4200–4210.
Google Scholar
Сато Ю. (1988). Атропин подавляет дегрануляцию клеток Панета у мышей, лишенных микробов. Cell Tissue Res. 253, 397–402.
Google Scholar
Сато, Ю., Исикава, К., Оомори, Ю., Такеда, С., и Оно, К.(1992). Бетанехол и активатор G-белка NaF / AlCl3 вызывают секреторный ответ в клетках Панета кишечника мыши. Cell Tissue Res. 269, 213–220. DOI: 10.1007 / bf00319611
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schaak, S., Cussac, D., Cayla, C., Devedjian, J.C., Guyot, R., Paris, H., et al. (2000). Альфа (2) адренорецепторы регулируют пролиферацию эпителиальных клеток кишечника человека. Кишечник 47, 242–250. DOI: 10.1136 / gut.47.2.242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шапер, Дж., Вагнер, А., Энигк, Ф., Брелл, Б., Муса, С. А., Хабазеттл, Х. и др. (2013). Регионарная симпатическая блокада ослабляет активацию кишечных макрофагов и снижает нарушение кишечного барьера. Анестезиология 118, 134–142. DOI: 10.1097 / aln.0b013e3182784c93
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schepers, A.G., Snippert, H.J., Stange, D.E., van den Born, M., ван Эс, Дж. Х., ван де Ветеринг, М. и др. (2012). Отслеживание клонов выявляет активность стволовых клеток Lgr5 + в аденомах кишечника мышей. Наука 337, 730–735. DOI: 10.1126 / science.1224676
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schutz, B., Jurastow, I., Bader, S., Ringer, C., von Engelhardt, J., Chubanov, V., et al. (2015). Химическое кодирование и хемосенсорные свойства холинергических щеточных клеток в желудочно-кишечном тракте и желчных путях мышей. Фронт.Physiol. 6:87. DOI: 10.3389 / fphys.2015.00087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Симокава М., Охта Ю., Нисикори С., Матано М., Такано А., Фуджи М. и др. (2017). Визуализация и нацеливание на стволовые клетки рака толстой кишки человека LGR5 (+). Природа 545, 187–192. DOI: 10.1038 / nature22081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шварц, Ю., Гонсалес-Селейро, М., Чен, К.-Л., Пазолли, Х.А., Sheu, S.-H., Fan, S.M.-Y., et al. (2020). Типы клеток, вызывающие мурашки по коже, образуют нишу для регулирования стволовых клеток волосяного фолликула. Ячейка 182, 578–593. DOI: 10.1016 / j.cell.2020.06.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скок, М., Граиль, Р., Ченжакс, Дж. П. (2005). Никотиновые рецепторы регулируют активацию В-лимфоцитов и иммунный ответ. Eur. J. Pharmacol. 517, 246–251. DOI: 10.1016 / j.ejphar.2005.05.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Слейтер, Т.В., Финкельштейн, А., Маскаренхас, Л. А., Мель, Л. К., Бутин-Исраэль, В., и Сумагин, Р. (2017). Микрочастицы нейтрофилов доставляют активную миелопероксидазу к поврежденной слизистой оболочке, препятствуя заживлению эпителиальных ран. J. Immunol. 198, 2886–2897. DOI: 10.4049 / jimmunol.1601810
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Stakenborg, N., Wolthuis, A. M., Gomez-Pinilla, P. J., Farro, G., Di Giovangiulio, M., Bosmans, G., et al. (2017). Стимуляция брюшного блуждающего нерва как новый терапевтический подход к профилактике послеоперационной кишечной непроходимости. Нейрогастроэнтерол. Мотил. 29: 13075.
Google Scholar
Стед, Р. Х., Колли, Э. К., Ван, Б., Партосоедарсо, Э., Лин, Дж., Станиш, А. и др. (2006). Вагус влияет на тучные клетки. Auton. Neurosci. 125, 53–61. DOI: 10.1016 / j.autneu.2006.01.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Straub, R.H., Grum, F., Strauch, U., Capellino, S., Bataille, F., Bleich, A., et al. (2008). Противовоспалительная роль симпатических нервов при хроническом воспалении кишечника. Кишечник 57, 911–921. DOI: 10.1136 / gut.2007.125401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, P., Zhou, K., Wang, S., Li, P., Chen, S., Lin, G., et al. (2013). Участие передачи сигналов Mapk / Nf-kappaB в активации холинергического противовоспалительного пути при экспериментальном колите путем хронической стимуляции блуждающего нерва. PLoS One 8: e69424. DOI: 10.1371 / journal.pone.0069424
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такахаши, Т., Ohnishi, H., Sugiura, Y., Honda, K., Suematsu, M., Kawasaki, T., et al. (2014). Ненейрональный ацетилхолин как эндогенный регулятор пролиферации и дифференцировки Lgr5-положительных стволовых клеток у мышей. FEBS J. 281, 4672–4690. DOI: 10.1111 / febs.12974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танака Ю., Канадзава М., Палссон О. С., Тилбург М., Гангароса Л. М., Фукудо С. и др. (2018). Повышенная постпрандиальная перистальтика толстой кишки и активность вегетативной нервной системы у пациентов с синдромом раздраженного кишечника: проспективное исследование. J. Neurogastroenterol. Мотил. 24, 87–95. DOI: 10.5056 / jnm16216
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тератани Т., Миками Ю., Накамото Н., Судзуки Т., Харада Ю., Окабаяси К. и др. (2020). Нервная дуга печень-мозг-кишечник поддерживает нишу Т-клеток в кишечнике. Природа 585, 591–596. DOI: 10.1038 / s41586-020-2425-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
The, F. O., Boeckxstaens, G.E., Snoek, S.A., Cash, J.L., Bennink, R., Larosa, G.J., et al. (2007). Активация холинергического противовоспалительного пути улучшает послеоперационную кишечную непроходимость у мышей. Гастроэнтерология 133, 1219–1228. DOI: 10.1053 / j.gastro.2007.07.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цибулевский А., Орлова Е. Н. (1976). [Физиологическая регенерация эпителия тощей кишки после двусторонней субдиафрагмальной ваготомии у крыс]. Biull. Эксп.Биол. Med. 81, 236–237.
Google Scholar
Tsuchida, Y., Hatao, F., Fujisawa, M., Murata, T., Kaminishi, M., Seto, Y., et al. (2011). Нейрональная стимуляция рецептором 5-гидрокситриптамина 4 вызывает противовоспалительное действие через рецепторы alpha7nACh на мышечные макрофаги, связанные с послеоперационной кишечной непроходимостью. Кишечник 60, 638–647. DOI: 10.1136 / gut.2010.227546
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Туттон, П.Дж. (1975). Влияние активности холиноцепторов на скорость митоза в криптах Либеркуна в тонкой кишке крыс. Clin. Exp. Pharmacol. Physiol. 2, 269–276. DOI: 10.1111 / j.1440-1681.1975.tb03032.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Туттон, П. Дж., И Баркла, Д. Х. (1977). Влияние активности адренорецепторов на пролиферацию клеток ипителия крипт толстой кишки и аденокарциномы толстой кишки. Арка Вирхова. B Cell. Патол. 24, 139–146.
Google Scholar
Туттон П. Дж. И Хельм Р. Д. (1974). Влияние активности адренорецепторов на пролиферацию клеток крипт в тощей кишке крыс. Cell Tissue Kinet. 7, 125–136. DOI: 10.1111 / j.1365-2184.1974.tb00405.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Увада, Дж., Ядзава, Т., Ислам, М. Т., Хан, М., Круг, С. М., Фромм, М., и др. (2017). Активация мускариновых рецепторов предотвращает опосредованное TNF-альфа нарушение кишечного эпителиального барьера через p38 MAPK. Cell Signal. 35, 188–196. DOI: 10.1016 / j.cellsig.2017.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валет, П., Сенард, Дж. М., Деведжян, Дж. К., Планат, В., Саломон, Р., Вуазен, Т. и др. (1993). Характеристика и распределение альфа-2-адренорецепторов в слизистой оболочке кишечника человека. J. Clin. Инвестировать. 91, 2049–2057. DOI: 10.1172 / jci116427
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван дер Занден, Э.П., Снук, С., Хайнсбрук, С., Станисор, О., Версейден, К., Бёкксстенс, Г. и др. (2009). Активность блуждающего нерва усиливает фагоцитоз кишечных макрофагов через никотиновый ацетилхолиновый рецептор альфа4бета2. Гастроэнтерология 137, 1029–1039. DOI: 10.1053 / j.gastro.2009.04.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Васина В., Абу-Гарбие Э., Барбара Г., де Джорджио Р., Колуччи Р., Бландицци К. и др. (2008). Агонист бета3-адренорецепторов SR58611A облегчает экспериментальный колит у крыс. Нейрогастроэнтерол. Мотил. 20, 1030–1041. DOI: 10.1111 / j.1365-2982.2008.01138.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вазер Р., О’Грэйди Г., Биссетт И. П. и Диннинг П. Г. (2014). Послеоперационная кишечная непроходимость: механизмы и дальнейшие направления исследований. Clin. Exp. Pharmacol. Physiol. 41, 358–370. DOI: 10.1111 / 1440-1681.12220
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вида, Г., Пенья, Г., Канаширо А., Томпсон-Бонилья Мдел Р., Паланж Д., Дейч Э. и др. (2011). β2-адренорецепторы регуляторных лимфоцитов необходимы для нейромодуляции блуждающего нерва врожденной иммунной системы. FASEB J. 25, 4476–4485. DOI: 10.1096 / fj.11-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wallrapp, A., Riesenfeld, S.J., Burkett, P.R., Abdulnour, R.E., Nyman, J., Dionne, D., et al. (2017). Нейропептид NMU усиливает вызванное ILC2 аллергическое воспаление легких. Природа 549, 351–356. DOI: 10.1038 / nature24029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Х., Чен, Ю. (2010). Эффекты антидепрессивного лечения экстрактом зверобоя, связанные с вегетативной нервной функцией у женщин с синдромом раздраженного кишечника. Внутр. J. Psychiatry Med. 40, 45–56. DOI: 10.2190 / pm.40.1.d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Л., Чжи, X., Чжан, К., Вэй, С., Ли, З., Чжоу, Дж. И др. (2016). Мускариновый рецептор M3 опосредует пролиферацию клеток, индуцированную ацетилхолином, и способствует апоптозу при раке желудка. Tumor Biol. 37, 2105–2117. DOI: 10.1007 / s13277-015-4011-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уитли, Л. М., Урсо, Д., Тумас, К., Мальцман, Дж., Ло, Э., и Левинсон, А. И. (1992). Молекулярные доказательства экспрессии альфа-цепи никотинового ацетилхолинового рецептора в тимусе мыши. J. Immunol. 148, 3105–3109.
Google Scholar
Виллемзе Р. А., Велтинг О., ван Хамерсвельд Х. П., Мейер С. Л., Фолгеринг Дж., Дарвинкель Х. и др. (2018). Нейронный контроль экспериментального колита осуществляется посредством симпатической кишечной иннервации. Нейрогастроэнтерол. Мотил. 30: 13163.
Google Scholar
Wu, N., Sun, H., Zhao, X., Zhang, Y., Tan, J., Qi, Y., et al. (2021 г.). Map3K2-регулируемые стромальные клетки кишечника определяют отдельную нишу для стволовых клеток. Природа 592, 606–610. DOI: 10.1038 / s41586-021-03283-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zeng, H., Li, H., Yue, M., Fan, Y., Cheng, J., Wu, X., et al. (2020). Изопреналин защищает стволовые клетки кишечника от повреждений, вызванных химиотерапией. Br. J. Pharmacol. 177, 687–700. DOI: 10.1111 / bph.14883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан Ю. и Ли Дж. (2012). Карбахол уменьшает вызванное липополисахаридом повреждение плотных контактов кишечного эпителия за счет подавления NF-каппабета и киназных путей легкой цепи миозина. Biochem. Биофиз. Res. Commun. 428, 321–326. DOI: 10.1016 / j.bbrc.2012.10.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, Х., Лян, Х., Ли, З. Ф., Сян, Х., Лю, В., и Ли, Дж. Г. (2013). Стимуляция блуждающего нерва ослабляет разрушение плотных контактов кишечного эпителия у мышей с эндотоксемией через никотиновые ацетилхолиновые рецепторы альфа7. Ударная волна 40, 144–151. DOI: 10.1097 / shk.0b013e318299e9c0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Автономная нервная система — Квинслендский институт мозга
Автономная нервная система (ВНС) также называется вегетативной нервной системой .
Управляет непроизвольными функциями и влияет на деятельность внутренних органов. Вегетативная нервная система регулируется гипоталамусом и необходима для сердечной функции, дыхания и других рефлексов , включая рвоту, кашель и чихание.
Вегетативную нервную систему можно разделить на симпатическую и парасимпатическую нервные системы.
Просто симпатическая и парасимпатическая нервные системы действуют противоположно.
Симпатические волокна, расположенные в спинномозговых нервах, отвечают за «бей или беги» ответ , который является острой реакцией, которая имеет место в случае неминуемого вредного события или сильного психического расстройства. Чтобы активировать этот ответ, симпатические волокна используют нейромедиатор , норадреналин , чтобы активировать кровоток в скелетных мышцах и легких, расширяя легкие и кровеносные сосуды и повышая частоту сердечных сокращений.
Другими словами, они инициируют физиологические события, которые подготавливают тело к самообороне посредством боя или побега, и поэтому тип синапсов является возбуждающим.
Напротив, парасимпатические волокна регулируют такие реакции в состоянии покоя, как частота сердечных сокращений, слюноотделение, слезотечение (выделение слез), пищеварение, за исключением сексуального возбуждения. Парасимпатические двигательные волокна обнаружены в четырех из 12 пар черепных нервов.
Итак, синапсы, создаваемые парасимпатическими волокнами, обычно тормозящие с ацетилхолином в качестве основного нейромедиатора.
Хотя большинство реакций вегетативной нервной системы являются непроизвольными, они могут интегрироваться с соматической нервной системой, которая отвечает за произвольные движения.Например, в случае дефекации существует взаимосвязь между произвольными и непроизвольными движениями.
Автор: Алессандра Донато из Hilliard Lab
14.3D: Контроль функции вегетативной нервной системы
Продолговатый мозг в нижней половине ствола мозга является центром управления вегетативной нервной системой.
Задачи обучения
- Описать контроль вегетативной нервной системы
Ключевые моменты
- В мозговом веществе находятся сердечный, дыхательный и вазомоторный центры.
- ВНС классически делится на два подразделения: симпатический и парасимпатический.
- Как правило, социальная сеть выполняет действия, требующие быстрой реакции, в то время как сеть социальной сети (PSNS) инициирует действия, не требующие немедленной реакции.
Ключевые термины
- Бей или беги : Эта теория утверждает, что животные реагируют на угрозы общим разрядом симпатической нервной системы, подстрекая животное к драке или бегству.
Вегетативная нервная система (ВНС) — это часть периферической нервной системы, которая контролирует непроизвольные функции, которые имеют решающее значение для выживания. ВНС участвует в регулировании частоты сердечных сокращений, пищеварения, частоты дыхания, расширения зрачков и сексуального возбуждения, среди других процессов в организме.
В головном мозге ВНС находится в продолговатом мозге в нижней части ствола мозга. Основные функции мозгового вещества — контролировать сердечный, дыхательный и вазомоторный центры, опосредовать автономные, непроизвольные функции, такие как дыхание, частоту сердечных сокращений и артериальное давление, а также регулировать рефлекторные действия, такие как кашель, чихание, рвота и глотание.
Ствол головного мозга с гипофизом и шишковидной железой : продолговатый мозг является частью ствола мозга и главным центром управления вегетативной нервной системой.
Гипоталамус интегрирует вегетативные функции и получает для этого автономную регуляторную обратную связь от лимбической системы. ВНС классически делится на два подразделения: симпатический и парасимпатический.
Симпатический отдел ВНС часто называют симпатической нервной системой (СНС).SNS обеспечивает норадренергический драйв ANS. Ее часто называют мобилизующей системой быстрого реагирования, которая инициирует реакцию организма «бей или беги».
Входной сигналPSNS в ANS отвечает за стимуляцию реакций «кормить и размножать» и «отдыхать и переваривать», в отличие от реакции «бей или беги», инициированной SNS. Парасимпатический отдел ВНС (PSNS) действует, чтобы дополнить и модулировать драйв, обеспечиваемый нейротрансмиссией SNS в ANS.
Как правило, социальная сеть выполняет действия, требующие быстрого реагирования, в то время как PSNS инициирует действия, не требующие немедленной реакции.
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
- Кураторство и пересмотр. Автор : Boundless.com. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
- Симпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Sympath…tem%23Overview . Лицензия : CC BY-SA: Attribution-ShareAlike
- Симпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Sympath…nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Бой или бегство. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Fight-o…ight-or-flight . Лицензия : CC BY-SA: Attribution-ShareAlike
- Симпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Sympath…tem%23Function . Лицензия : CC BY-SA: Attribution-ShareAlike
- Бой или бегство. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Fight-or-flight_response . Лицензия : CC BY-SA: Attribution-ShareAlike
- Бой или бегство. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Fight-o…e%23Physiology . Лицензия : CC BY-SA: Attribution-ShareAlike
- Симпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Sympath…n_transmission . Лицензия : CC BY-SA: Attribution-ShareAlike
- Симпато-адреналовый ответ. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/sympath…nal%20response . Лицензия : CC BY-SA: Attribution-ShareAlike
- стрессовая реакция. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/stress%20response . Лицензия : CC BY-SA: Attribution-ShareAlike
- Симпатическая нервная система (СНС). Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/sympath…system%20(SNS) . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 838. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray838.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Вегетативная нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Autonomic_nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Парасимпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Parasym…nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Парасимпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Parasym…em%23Receptors . Лицензия : CC BY-SA: Attribution-ShareAlike
- Парасимпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Parasym…nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- слезотечение. Источник : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/lacrimation . Лицензия : CC BY-SA: Attribution-ShareAlike
- ацетилхолин. Источник : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/acetylcholine . Лицензия : CC BY-SA: Attribution-ShareAlike
- Парасимпатическая нервная система. Источник : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/parasy…nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 838. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray838.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Серый 839. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray839.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Вегетативная нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Autonom…tem%23Function . Лицензия : CC BY-SA: Attribution-ShareAlike
- кормовой и племенной. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/feed-and-breed . Лицензия : CC BY-SA: Attribution-ShareAlike
- Бей или беги. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/fight%20or%20flight . Лицензия : CC BY-SA: Attribution-ShareAlike
- жизненно важная функция. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/vital%20function . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 838. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray838.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Серый 839. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray839.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 839. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray839.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Симпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Sympathetic_nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Вегетативная нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Autonomic_nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Парасимпатическая нервная система. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Parasym…nervous_system . Лицензия : CC BY-SA: Attribution-ShareAlike
- Бей или беги. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/fight%20or%20flight . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 838. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray838.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Серый 839. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray839.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Открытие и разработка лекарств: агонисты никотиновых ацетилхолиновых рецепторов. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Drug_Di…eptor_Agonists . Лицензия : CC BY-SA: Attribution-ShareAlike
- Серый 839. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Gray839.png . Лицензия : Общественное достояние: неизвестно Авторские права
- Иллюзия эпифиза гипофиза. Источник : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/File:Il…eal_glands.jpg . Лицензия : Общественное достояние: неизвестно Авторские права